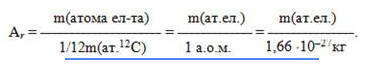Молекулы и атомы это что
Атом и молекула – что это и отличия
Мельчайшие частицы – атом и молекула, об этом знают многие люди, но не все могут рассказать подробно, что же это такое. Также сложно, не имея специальных знаний, объяснить, в чем состоят отличия между этими структурами. Из различных исторических источников известно, что про эти структурные единицы знали еще древнегреческие ученые. Так философ Демокрит одним из первых высказал предположение о том, что все известная людям материя состоит из крошечных по своим размерам, неделимых человеческому глазу частиц. Их он назвал атомами. Современные ученые подтвердили эту теорию и установили опытным путем, что вещества состоят из атомов и молекул. Для того чтобы установить разницу межу этими структурными единицами, необходимо сначала дать им определение, а затем сравнить, чтобы определить, в чем состоят различия.
Определение понятий
На первых этапах изучения считалось, что атом и молекула – элементы неделимые. Более глубокие исследования и всесторонние изучения позволили опровергнуть это мнение. Сегодня этими терминами обозначают самостоятельные элементы, которые образуют все, что окружает человека.
Атомом называют мельчайшую структурную единицу, составляющую любое вещество.
Молекулой принято считать элементарную частицу, из которых состоят все окружающие людей вещества, материи и компоненты.
Сравнение
После приведенных определений можно приступить к сравнению элементарных структурных единиц вещества. Атом является наименьшей ее составляющей. Он имеет собственную массу и размер. Основная задача – определение, какими свойствами будет обладать то или иное химическое вещество.
Нужно учитывать, что атом не является конечным элементом. Он в свою очередь делится на ядро и электроны, которые совершают движение по орбите, расположенной вокруг ядра. Подобное строение и определяет, какими свойствами будет обладать то или иное вещество. Особенностью атома является то, что его невозможно увидеть вне компонента, в свободном состоянии. Все атомы имеют тесные связи между собой, которые и образуют молекулу. Происходит это благодаря электрическим зарядам частиц, из которых состоят атомы.
Молекула — это единица, составляющая вещество. В состав молекул входят атомы. Разное их количество определяет свойства. Атомы внутри молекулы имеют межатомные связи. Каждая молекула состоит из атомных ядер и внутренних электронов. Они совершают движение по своим орбитам. В состав входят также внешние валентные электроны. В разных молекулах находится разное количество атомов. Это свойство и определяет разнообразие химических веществ и компонентов. Молекула имеет сложную архитектурную постройку. Так у каждого атома свое место внутри молекулы. Количеством атомов в ней определяются свойства – химические реакции и превращения. Имеющиеся свойства влияет порядок и конфигурация соединения всех атомов. Атомная постройка, которая образует молекулу, может быть жесткой. Также бывают и исключения. Особенность мельчайшей единицы – постоянное движение. Атомы никогда не останавливаются, они продолжают колебание на положенном ему месте в молекуле, чтобы удержать равновесие.
Выводы
Атомы и молекулы – структурные единицы, образующие любое вещество. Атомы образуют молекулу. В составе атома присутствуют еще более мелкие элементы — ядро и электроны, которые движутся по своим орбитам вокруг ядра. Молекулы состоят из атомов (одного или нескольких).
Атом имеет электрический заряд (положительный или отрицательный) а молекула по этому показателю полностью нейтральная. Только молекула в веществе обладает способностью к самостоятельному существованию.
Атомы, ионы, молекулы
Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē. Электроны движутся вокруг ядра, перемещаясь по сложным траекториям. Ядро атома состоит из двух типов частиц: протонов и нейтронов. Протоны обозначают буквой р, а нейтроны – n.
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда совпадает с количеством протонов. С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд. Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8.
Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8. Как определить количество нейтронов?
В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
С учетом вышесказанного можем записать несколько простых выражений:
Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»).
Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов. Нуклиды обозначают символом элемента и массовым
Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд).
Есть и элементы одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
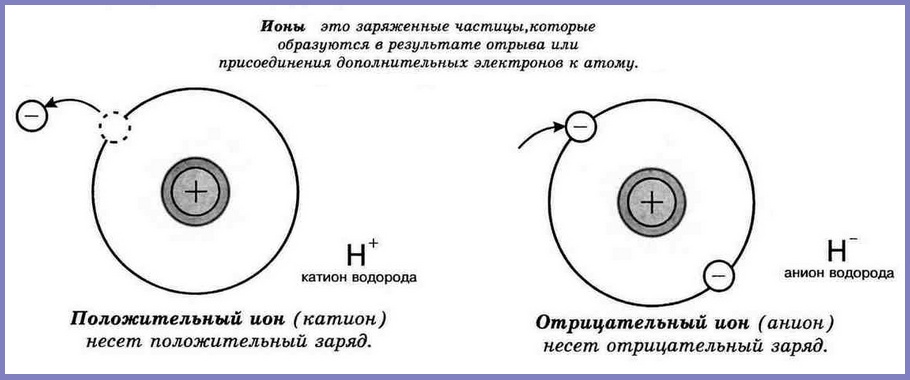
Ионы
В отличие от атомов, ионы – это заряженные частицы. Ионы образуются в том случае, если нейтральный атом «потеряет» или «приобретет» часть электронов. Например, в результате некоторой реакции, атом натрия утратил один электрон. Обратимся к Периодической Системе, согласно которой узнаем, что в атоме натрия 11 электронов. Если один электрон покинет атом, их останется 10, тогда нарушится принцип электронейтральности атома и положительно заряженное ядро будет доминировать, то есть частица приобретет положительный заряд. Частица Na+ и есть ион. Возможен и другой вариант, атом, в результате химической реакции, может присоединять электроны. В этом случае образуется избыток электронов и, следовательно, суммарный отрицательный заряд электронов больше, чем положительный заряд ядра. Такой ион будет заряжен отрицательно.
Молекулы
Из курса природоведения вам известно, что молекулы образуются из атомов посредством их взаимодействия в результате химических реакций. Например, молекула водорода Н2, образуется при взаимодействии двух атомов водорода. Молекула – наименьшая частица вещества, обладающая его химическими свойствами, состоящая из двух или более атомов Подобно молекулам водорода образуются и другие молекулы, например: молекула азота N2, кислорода О2, хлора Cl2 и другие молекулы. Конечно же, существуют и более сложные молекулы, состоящие из большего числа атомов. Например, сладкий вкус фруктам придает глюкоза. Существуют очень большие молекулы, в состав которых входят десятки, сотни и даже тысячи атомов! Например, молекулы белков, из которых состоят все живые организмы, состоят из сотен и тысяч различных атомов!
Атомно-молекулярная теория
Процесс познания складывается таким образом, что блестящие догадки и великие теории, являвшиеся в свое время результатом гениального творчества, через более или менее продолжительное время становятся едва ли не тривиальными фактами, которые большинство людей принимает на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая, или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят всем известными положениями.
Но для ученых прошлого, пытавшихся решить два основных вопроса:
Результатом стала атомно- молекулярная теория, основные положения которой можно сформулировать следующим образом:
Вывод из статьи про Атомы, ионы, молекулы
Атомы и молекулы: что о них известно
Атомы и молекулы: Freepick
С изучения атомов и молекул начинается знакомство с химией. Современной науке известны миллионы молекул. Разобраться с их строением и свойствами помогут особенности мельчайшей частицы — атома.
Что такое атомы
С древних времен люди стремились изучить природу вещей, которые их окружали. Постепенно пришли к мысли о том, что все вокруг состоит из мельчайших частиц.
По мере развития науки появилось понятие об атомах и молекулах. Эти частички чрезвычайно малы, и невооруженным глазом их не разглядеть. Любое крошечное количество вещества, например, пылинка, содержит невероятно большое количество атомов и молекул.
Что же такое атом? Так называют мельчайшую химически неделимую частицу вещества, а также наименьшую часть химического элемента, которая отражает его свойства. Атомы очень маленькие: их размеры находятся в диапазоне от 1 до 5 ангстрем (обозначается — Å.). Один ангстрем — это 10⁻¹⁰ м.
Когда атомы только открыли, их считали самыми маленькими из возможных частиц. Но сегодня нам известна их внутренняя структура:
Например, в атоме гелия есть ядро с двумя протонами и двумя нейтронами, а вокруг него двигаются по своим орбитам два электрона.
Мир атомов: Freepick
Элементарные или субатомные частицы во всех атомах одинаковы, отличается только их количество:
Ядра атомов заряжены положительно, так как в них находятся положительно заряженные протоны и нейтральные нейтроны. По величине заряд соответствует количеству протонов в ядре и равен порядковому номеру элемента в периодической системе.
Заряды протонов и электронов одинаковые по величине, но имеют противоположные знаки. В любом атоме число протонов и электронов равно. Поэтому заряд ядра и суммарный заряд всех электронов также равны, но имеют противоположные знаки. Следовательно, атом — электронейтральная частица.
Каждый известный атом обозначен специальным символом — латинской буквой. Все они представлены в периодической системе Д. И. Менделеева.
На современном этапе развития науки ученые стремятся разрушить атом, чтобы получить еще более мелкие частички. Однако они очень неустойчивы, и добиться их долговременного существования пока не получается.
Что известно о молекулах
Атомы различным образом соединяются друг с другом. Как из букв алфавита составляются тысячи слов, так одни и те же атомы образуют молекулы большого количества разных веществ, которые видим в окружающем мире.
Молекулой называют наименьшую частицу вещества, которая определяет его свойства и способна к самостоятельному существованию. Каждая молекула строится из атомов, которые составляют ее массу:
Таким образом, вещества не вечны, так как их молекулы не могут быть вечными. Однако их атомы практически вечны. В тех веществах и предметах, которые окружают нас сегодня, находятся атомы, которые существовали еще во времена динозавров, походов Александра Македонского и открытия Колумбом Америки.
Что такое молекулы: Freepick
Хоть молекулы и очень малы, их устройство определяют с помощью различных физических и химических методов. Чистые вещества состоят из молекул одного вида.
Если в физическом теле есть молекулы разных видов, то речь идет о смеси веществ. Когда в быту говорим о чистом воздухе, то называем так сложную смесь различных газообразных веществ. Химику придется серьезно поработать, чтобы выделить из нее отдельные чистые вещества.
Все вещества делят на простые и сложные:
Часто физические тела состоят из молекул нескольких веществ. Их называют смесями. Важно не путать сложные вещества и смеси. Если в сложном веществе содержатся молекулы одного вида, то это не смесь.
Благодаря свойству атомов объединяться в разных вариациях количество веществ, как и видов молекул, бесконечно. Никто не сможет точно назвать число веществ, которые сегодня известны людям. Ориентировочно их количество исчисляется миллионами, а химики каждый день создают новые молекулы.
Таким образом все вещества, которые мы видим вокруг нас, состоят из молекул, а те, в свою очередь, построены из атомов. Ученым удалось исследовать мельчайшие частички — атомы — и подробно описать их структуру. Эти знания стали ключом к пониманию природы молекул и даже дали возможность создавать новые молекулы.
Узнавайте обо всем первыми
Подпишитесь и узнавайте о свежих новостях Казахстана, фото, видео и других эксклюзивах.
Молекулы и атомы это что
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Древнегреческий философ Демокрит 2500 лет назад предположил, что все тела состоят из мельчайших, невидимых, неделимых, вечно движущихся частиц — атомов. В переводе «атом» означает «неделимый».
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.
Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.
Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу — ион. Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу. Подробнее электронно-ионная теория рассматривается в курсе физики (читать Конспект «Электронно-ионная теория»)
Конспект урока «Атомы, молекулы и ионы».
Вещество, атом, молекула
Согласно современным представлениям основные положения атомно-молекулярной теории сводятся к следующим тезисам:
Важнейшие понятия атомно-молекулярного учения
Согласно атомно-молекулярному учению, главными объектами химии являются атомы, молекулы, химические элементы, простые и сложные вещества.
Атомы — химически неделимые частицы, которые сохраняются при химических реакциях, но при этом частично может меняться строение электронной оболочки. Однако атомы разрушаются в процессе ядерных реакций.
Атом — это наименьшая, химически неделимая, электронейтральная частица элемента, которая состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Нуклоны — это положительно заряженные протоны и электронейтральные нейтроны. Электронная оболочка, размер которой определяет радиус всего атома — это совокупность электронов. Положительный заряд ядра определяется количеством протонов и равна по абсолютной величине отрицательному заряду электронной оболочки, который соответствует количеству электронов. Благодаря равенству по абсолютной величине зарядов протонов и электронов, атом электронейтрален. Протоны, нейтроны и электроны объединяются общим названием — субатомные частицы.
Заряд ядра атома равен порядковому номеру элемента (закон Мозли).
Относительная атомная масса Аr — это физическая величина, равная отношению средней массы атома элемента к одной двенадцатой массы атома изотопа углерода-12:
m (ат.О) = А r (О) · 1,66 · 10 — 27 = 16 · 1,66 · 10 — 27 = 26,56 · 10 — 27 кг.
Молекула
Молекулы — это реально существующие природные объекты, что подтверждается многими экспериментально доказанными фактами.
Молекула — это наименьшая частица вещества, которая способна самостоятельно существовать и имеет все химические свойства вещества.
Молекула сохраняет химические свойства вещества. Известно, что вещество характеризуется определенными физическими и химическими свойствами. Физические свойства — это агрегатное состояние, плотность, температуры кипения и плавления, электропроводность, диэлектрическая проницаемость, цвет, запах, вкус и тому подобное. Понятно, что перечисленные свойства веществ могут быть присущи не одной молекуле, а достаточно большой их совокупности. Однако молекула имеет и собственные физические свойства: дипольный и магнитный моменты, способность к поляризации и тому подобное. А химические свойства вещества (способность вступать в химическое взаимодействие с другими веществами) в полной мере относятся и каждой отдельной молекуле.
Молекулы состоят из атомов, которые соединены между собой химическими связями в определенной последовательности и определенным образом ориентированы в пространстве. Количество атомов в молекуле колеблется от двух (Н2, О2, НСl) до нескольких тысяч (витамины, гормоны, белки). Атомы благородных газов (He, Ne, Ar, Kr, Xe, Rn) иногда называют одноатомными молекулами. Состав молекулы — важнейшая характеристика молекулы и вещества — описывается химическими формулами.
При физических явлениях молекулы сохраняются, а при химических превращениях — разрушаются, образуя новые вещества.
Относительная молекулярная масса Мr— это отношение средней массы молекулы вещества к 1/12 массы атома углерода-12.
В системе СИ относительная молекулярная масса Mr — безразмерная величина, а внесистемной единицей ее измерения является а.е.м.
Абсолютная масса молекулы определяется как произведение Мr на атомную единицу массы:
m (молекулы SO 2 ) = M r (SO 2 ) · 1,66 · 10 — 27 = 64 · 1,66 · 10 — 27 = 1,06 · 10 — 25 кг.
Молекулярное строение имеют органические соединения и часть неорганических веществ, но большинство неорганических веществ состоит из ионов, в которых носителями химических свойств является условные частицы — ассоциаты ионов. Поэтому к веществам ионной строения невозможно применять понятие «молекула» так же как и к металлов и их сплавов, кристаллическая решетка которых имеет свои специфические особенности. Таким образом, с современной точки зрения молекула — это наименьшая электронейтральна замкнутая совокупность атомов, образует определенную структуру с помощью химических связей.
Химический элемент
Сейчас известно 118 химических элементов: из них 89 обнаружены в природе, а другие получены искусственно при проведении ядерных реакций.
Химический элемент — это вид атомов с одинаковым зарядом ядра.
Каждый элемент имеет свое название и символ. Названия элементов с порядковыми номерами 104-109 утверждены советом IUPAC (1997.) Позже были названы другие элементы. Теперь элемент №104 имеет следующие название и символ: Резерфорд Rf, №105 — Дубний Db, №106 — Сиборгий Sg, №107 — Борий Bh, элемент №108 — Хассий Hs, №109 — Мейтнерий Mt, №110 — Дармштадтий Ds. Химические элементы №№111-118 еще не получили официальных названий, поэтому их пока называют по порядковым номерам, например: №111 — Унунуний Uuu (один, один, один) №112 — Унунбий Uub (один, один, два) и т.д.
Химический символ означает, во-первых, название элемента, во-вторых, — один атом этого элемента при записях формул химических реакций.
Формулы изотопов конечно записывают с помощью символа химического элемента, отметив заряд ядра (слева снизу) и массового числа (слева сверху). Исключением являются изотопы элемента водорода, для которых наряду с традиционной символикой допускаются и индивидуальные названия и обозначения.
Простые и сложные соединения
Поскольку вещество — это любая совокупность атомов или молекул, то по составу все соединения можно разделить на простые и сложные.
Простыми веществами называются вещества, которые состоят из атомов одного элемента; простые вещества — это форма существования химического элемента в свободном состоянии.
Насчитывается более 500 простых веществ, а элементов известно всего 118. Такое расхождение объясняется явлением под названием аллотропия.
Аллотропия — это способность элемента образовывать несколько простых, отличающихся по свойствам веществ, которые называются аллотропными модификациями, или алотропамы.
Простые вещества могут иметь молекулярное и немолекулярное строение — атомное или металлическое. Молекулярное строение присуще кислороду, галогенам; атомное — благородным газам, алмазу, графиту; металлическое — металлам в разном состоянии.
Сложными веществами называются вещества, содержащие атомы различных элементов, то есть это форма существования элементов в связанном состоянии.
Сложные вещества могут иметь как молекулярное строение (Н2S, CH4, HCl, H2O), так и немолекулярное: ионное (NaCl, Na2O, NaOH) или металлическое (Fe3C — карбид железа).
Химические реакции, их классификация
Химическими реакциями являются процессы, при которых изменяется состав соединений вследствие разрушения связей в одних веществах и образования новых соединений.
Химические реакции — это явления, при которых происходят превращения одних веществ в другие без изменения состава атомных ядер.
Для условного записи химических реакций применяют уравнения химических реакций, где в левой части указывают формулы исходных веществ, а в правой — конечных продуктов, образовавшихся в результате реакции Перед формулами всех веществ проставляют необходимые стехиометрические коэффициенты — числа, с помощью которых сравнивают количества атомов каждого элемента слева и справа.
Химические реакции всегда сопровождаются физическими эффектами, которые подтверждают протекание реакции. Визуальными признаками химических реакций обычно является выделение газа, выпадение осадка, изменение окраски реакционной среды или тепловой эффект.
Для химических реакций, проходящих между неорганическими реагентами, чаще всего используются такие классификации:
Одна и та же реакция в зависимости от признака рассматриваемого может классифицироваться по-разному. Например, синтез NH3 с N2 и H2 в присутствии железного катализатора является реакцией сообщения и одновременно относится к окислительно-восстановительным, гомогенным, молекулярным, каталитическим, термохимическим и оборотным реакциям.