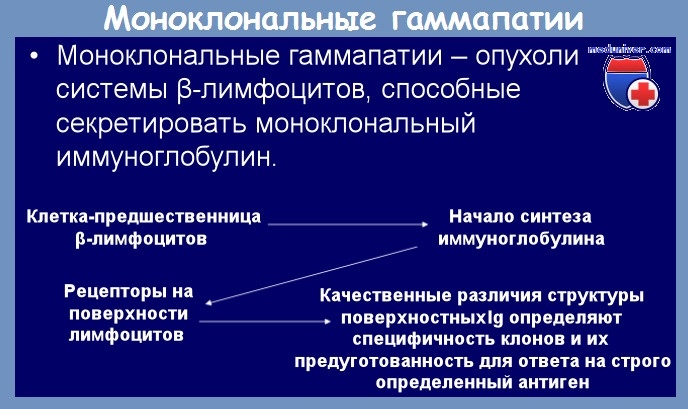
Моноклональная гаммапатия что это
Моноклональная гаммапатия что это
Синонимы доброкачественных моноклональных гаммапатий: моноклональные идиопатические (асимптомные) гаммапатии; идиопатическая парапротеинемия; немиэломатозная парапротеинемия.
Доброкачественная моноклональная гаммапатия характеризуется наличием в плазме моноклонального протеинового компонента, подобного множественной миеломе или болезни Вальденштрема, но не сопровождающегося никаким клиническим симптомом.
За последние 3 десятилетия сообщалось о ряде случаев, которые включались в это определение, причем каждый автор давал им другое название. В 1961 г. Waldenstrom включает их в класс моноклокальных гаммапатии, присвоив им название доброкачественных.
Этиология и патогенез доброкачественных моноклональных гаммапатий
Исследования, проведенные на широких группах населения, показали, что наличие сывороточного моноклонального компонента не является редкостью. Изучение почти 7 000 случаев позволило Axelsson и сотр. (1961) найти компонент М у 1% населения старше 25 лет и у 3% лиц старше 70 лет. В рамках моноклональных гаммапатии пропорция доброкачественных форм варьирует между 8 и 68%, в зависимости от авторов, причем эта цифра не может являться показателем частоты, так как она относится к ограниченной группе лиц.
Причина этого состояния неизвестна. Waldenstrom считает ее доброкачественной лимфоцитарной опухолью типа Б, в то время как миелома и болезнь Вальденштрема представляют собой злокачественные формы.
Ossermann показал какую роль могут играть хронические инфекции, особенно билиарные и ренальные, в возникновении доброкачественной моноклональной гаммапатии. Так например, в группе 10 добровольцев подвергнувшихся противохолерной вакцинации, 2 представляли моноклональный рост Ig. Эти внешние иммунные раздражения вызывают у большинства индивидов поликлональные Ig реакции. Однако от отдельных субъектов возможно по генетическим или другим, еще неизвестных причинам, происходит селекция одного секреторного клеточного клона монотипного Ig (лимфоцита Б).
При доброкачественных моноклональных гаммапатиях, этот клон контролируется, а его пролиферация уравновешена. В других случаях, этот клон начинает безконтрольно развиваться, создавая доброкачественные моноклональные гаммапатии.
Было отмечено появление компонента М при многочисленных воспалительных или автоиммунных заболеваниях, в том числе: малярия, токсоплазмоз, врожденный сифилис, болезнь агглютининов на холоде; эти случаи подтверждают роль фактора иммунного раздражения в его появлении.
При многих злокачественных заболеваниях лимфатической системы часто встречается моноклональный рост Ig. Взаимосвязь между этими двумя процессами неизвестна. Waldenstrom цитирует несколько гипотез:
1) больной с сывороточным компонентом М более восприимчив к развитию карциномы;
2) компонент М может являться антителом для известного туморального антигена;
3) глобулины могут быть синтетизированным продуктом раковых клеток — как это бывает при лимфомах;
4) может являться просто случайным сочетанием.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение моноклональной гаммапатии неясного генеза в Германии
Риск развития МГНГ увеличивается с возрастом и диагностируется у 3% населения старше 50 и у около 5% людей — старше 70 лет. При этом мужчины страдают МГНГ чаще чем женщины и риск развития заболевания возрастает, если у кровных родственников первой линии была диагностирована моноклональная гаммапатия неясного генеза.
Риск прогрессии МГНГ
При моноклональной гаммапатии неясного генеза с тяжелыми цепями иммуноглобулинов риск развития болезни во множественную миелому или в другую злокачественную лимфому составляет 1-1,5% в год, в то время как при МГНГ с легкими цепями — около 0,3% в год. Однако вероятность малигнизации МГНГ зависит также от индивидуальных отклонений, имеющихся у каждого отдельного пациента. Основными факторами риска малигнизации МГНГ являются:
Как правило, моноклональная гаммапатия неясного генеза не имеет симптомов и диагностируется в рамках рутинного контроля или при диагностике в Германии другого заболевания. Подробно о методах диагностики МГНГ читайте в статье «Диагностика моноклональной гаммапатии неясного генеза в Германии».
Терапия МГНГ
Пациентам с моноклональной гаммапатией неясного генеза терапия не показана, однако, при основном заболевании, связанном с патологическими иммуноглобулинами, терапия все же может быть рекомендована. Но в таком случае природа гаммапатии установлена и пациент должен получать терапию, соответствующую данному виду.
Моноклональная гаммапатия что это
Пациенты с доброкачественными моноклональными гаммапатиями не представляют никакого клинического симптома, а лишь биологические изменения сывороточных протеинов. В плазме этих лиц обнаруживается при электрофорезе один глобулин в большем количестве. Иммунохимические исследования показали, что речь идет о гомогенном, монотипном Ig, состояшем из одной тяжелой цепи и одной легкой цепи. Описывались случаи с компонентом IgG, IgA и IgM. He известны случаи доброкачественных моноклональных гаммапатии с IgE или IgD. В известных случаях наблюдается преобладание Ig с легкой цепью ламбда по отношению к каппа.
При доброкачественной моноклональной гаммапатии, моноклональный компонент существует в малом количестве (1—3 г/100 мл сыворотки), не сопровождается сокращением остальных Ig и не изменяется количественно в течение долгих периодов времени. Кроме этого, пациенты не представяют протеинурии Бене-Джонса (Вепсе-Jones).
Остальные лабораторные исследования нехарактерны. Гемограмма обычно нормальная. СОЭ может быть нормальной, но бывает и весьма ускоренной.
Исследование костного мозга показывает обычно слегка повышенное число плазмоцитов, но не превышающее 10—15% общего количества миэлоидных элементов.
Дифференциальная диагностика доброкачественных моноклональных гаммапатий производится в первую очередь с множественной миэломой в начальной фазе. Ritzmann и сотр. попытались определить клинические или биологические признаки, которые могут способствовать дифференциации этих двух заболеваний. Они обнаружили, что ни один из биологических тестов (количество IgM, отсутствие или наличие протеина Бене-Джонса, нормальное или пониженное количество остальных Ig) не может давать точное указание. Единственно верный метод дифференциации состоит в наблюдении больного в течение долгого времени.
При доброкачественной моноклональной гаммапатии, количество моноклонального компонента остается без изменений в течение нескольких лет, в то время как при множественной миэломе, патологический протеин представляет явный рост от одного анализа к другому.
Эволюция и прогноз доброкачественных моноклональных гаммапатий. Как показывает и самое название, доброкачественная моноклональная гаммапатия имеет обычно долгую эволюцию и хороший прогноз.
Однако в литературе по специальности отмечаются случаи, которые после многолетнего типично стационарного аспекта, эволюировали в дальнейшем как множественная миэлома. Отсюда вытекает необходимость для таких больных находиться под тщательным медицинским надзором в течение долгих периодов времени.
Лечение доброкачественных моноклональных гаммапатий. Пациенты с доброкачественной моноклональной гаммапатией не нуждаются в лечении. Однако существует необходимость тщательного медицинского надзора в течение долгих периодов и применения лечения при первых же признаках эволютивности, особенно в случае повышения количества компонента М.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Моноклональная гаммапатия неясного генеза (МГНГ)
, MD, Institute for Myeloma and Bone Cancer Research
Частота встречаемости моноклональной гаммапатии неясного генеза (МГНГ) повышается с возрастом (от 1% среди лиц до 25 лет до > 5% среди лиц старше 70 лет). МГНГ может быть ассоциирована с другими заболеваниями (см. таблицу Классификация плазмоклеточных заболеваний Классификация плазмоклеточных заболеваний Плазмоклеточные заболевания представляют собой разнородную группу заболеваний неизвестной этиологии, характеризующихся Чрезмерной пролиферацией одного клона В-клеток Наличием структурно и электрофоретически. Прочитайте дополнительные сведения ), при которых антитела синтезируют большое количество М-протеинов (моноклональных иммуноглобулиновых белков, которые могут состоять из тяжелых и легких цепей, или только из легких цепей) в ответ на длительное антигенное воздействие.
Подозрение на МГНГ, как правило, возникает при случайном выявлении М-протеина в крови или моче во время рутинного обследования. Характерен низкий уровень М-протеина в сыворотке крови ( 3 г/дл) или в моче ( 200 мг/24 часа). Дифференциальная диагностика с злокачественными плазмоклеточными заболеваниями основана на сохранении низкого уровня М-протеина, отсутствии литических костных поражений, анемии, почечной дисфункции. Из-за риска развития переломов, исходно необходимо обследовать кости скелета (т.е. провести обзорную рентгенографию черепа, длинных трубчатых костей, позвоночника, костей таза, ребер) и денситометрию. Для костного мозга характерен легкий плазмоцитоз ( 10% ядерных клеток).
Моноклональная гаммапатия неясного генеза
Моноклональными гаммапатиями называют увеличение концентрации моноклонального парапротеина (М-протеина) в плазме крови или моче. Чаще всего увеличивается концентрация IgG, следом по частоте возникновения идет повышение IgA, IgM или IgD. При отсутствии заболевания, лежащего в основе такого роста концентрации иммуноглобулинов, говорят о моноклональной гаммапатии неясного генеза (МГНГ, monoclonal gammopathy of undetermined significance, MGUS), что служит окончательным диагнозом, не является (пока что) признаком злокачественного заболевания и поэтому не требует лечения.
Вероятность возникновения МГНГ-заболеваний увеличивается с каждым годом жизни человека. Заболеваемость среди людей старше 50 лет составляет 1–3 %, а среди 85-летних — до 7,5 %. Мужчины заболевают немного чаще женщин. В настоящее время проводятся многочисленные исследования по выявлению причин возникновения моноклональных гаммапатий (рис. 1).
Рисунок 1 | Причины возникновения моноклональных гаммапатий
Их злокачественная трансформация может быть связана со многими патологическими процессами. При этом не все из представленных выше причин считаются обязательными для озлокачествления МГНГ. Например, гипердиплоидия клеток встречается только в 50 % случаев. Как можно увидеть на изображении, если такая трансформация происходит, то она остается на протяжении всего заболевания.
На ранних этапах особую роль играют транслокации IgH — обычно t(4;14), t(14;16), t(6;14), t(11;14) и t(14;20) — и гипердиплоидия клеток. Одна из этих трансформаций чаще всего встречается в комбинации с делецией 13-й хромосомы. В 80–90 % случаев делеция происходит при транслокации IgH t(4;14), t(14;16) и t(14;20). Также часто происходит дисрегуляция в гене циклина D. Активирующие мутации в системах NRAS и KRAS наблюдаются в 15 % случаев множественной миеломы; NRAS-мутации при этом больше характерны для МГНГ.
Постоянная активация ядерного фактора (nuclear factor κB — NFκB) является мутацией, приводящей к прогрессии заболевания; также причиной этому может стать инактивация или делеция генов, кодирующих белки p53 и p18, что чаще всего происходит в случаях внутрикостной и экстрамедуллярной множественной миеломы. Зависимость клеток от микроокружения костного мозга определяется стадией заболевания. Экстрамедуллярные опухолевые клетки, в свою очередь, приобрели в процессе мутаций свойства, делающие их независимыми от микроокружения опухоли.
Предполагается, что изменения в составе костного мозга происходят еще до возникновения гаммаглобулинемии. В предыдущих исследованиях ученым удалось доказать, что иммунная система способна распознавать нарушения гомеостаза еще на ранних стадиях, что приводит к снижению риска прогрессии заболевания. Иммуномодуляторы, такие как леналидомид и помалидомид, используемые при терапии множественной миеломы, способны предотвращать злокачественную трансформацию.
Считается, что в патологических процессах, предшествующих развитию МГНГ, принимают участие так называемые врожденные лимфатические клетки (innate lymphoid cells — ILCs). Им приписывают участие в регуляции различных процессов, в том числе аутоиммунных, защите от патогенов, поддержании тканевого гомеостаза. ILC1 способны вырабатывать большое количество Ikzf316 — белка, связывающего ДНК, что играет роль в злокачественных процессах, делая эти клетки возможной мишенью для терапии. Ученым удалось обнаружить, что у больных МГНГ количество этих клеток в костном мозге действительно увеличивается, что нельзя сказать о циркулирующей фракции этих клеток.
Диагностика МГНГ
Для диагностики МГНГ в первую очередь проводят сбор анамнеза и осмотр больного: могут быть жалобы на костные боли, частые инфекционные заболевания, симптомы анемии, пенящуюся мочу (признак протеинурии), отеки конечностей, симптомы и признаки сердечной недостаточности.
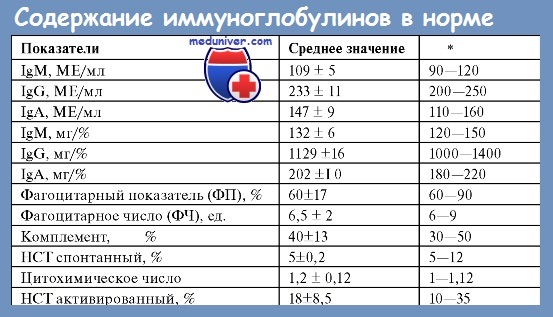
После этого начинается клиническое обследование с использованием лабораторных методов исследования. В плазме крови определяют концентрацию общего белка, альбумина, креатинина, мочевины, натрия, калия и кальция, а также проводят качественный анализ крови и мочи на иммуноглобулины IgG, IgA, IgM и свободные легкие цепи κ и λ.
Важно провести дифференциальную диагностику МГНГ с множественной миеломой, AL-амилоидозом, макроглобулинемией Вальденстрема, неходжкинскими лимфомами и солитарной плазмоцитомой. Необходимо учитывать, что при ВИЧ-инфекции и гепатите С также встречается криоглобулинемия. Похожая клиническая картина может быть у некоторых аутоиммунных заболеваний, цитомегаловирусной инфекции и лейшманиозов.
Для постановки диагноза необходимо определить в сыворотке крови наличие моноклонального пика (М-градиента) бета- или гамма-фракций глобулинов при одновременном уменьшении или отсутствии других глобулиновых фракций. После электрофореза проводится иммунофиксация иммуноглобулинов в сыворотке крови — количественный анализ посредством их инкубации с антителами, направленными против них самих (определяется количество IgG, IgA, IgM и κ- или λ-легких цепей, а также их соотношение).
Для диагностики также важно количественное определение иммуноглобулинов и их цепей в моче. Патологические низкомолекулярные белки из моноклональных легких цепей иммуноглобулинов (например, κ- или λ-цепей), которые в избыточном количестве продуцируются плазматическими клетками и выводятся почками, называются белками Бенс-Джонса и служат маркером многих иммунологических заболеваний, в том числе множественной миеломы.
Обычно проводят определение только вышеуказанных иммуноглобулинов и их частей, но при неоднозначных результатах можно выполнить анализ с помощью анти-IgD и анти-IgE антител. Количественный анализ проводится с помощью нефелометрического метода.
При определении фракции М-протеинов в количестве
Рисунок 2 | Критерии CRAB