Моноклональные антитела препараты что это такое
Терапевтические моноклональные антитела
Терапевтические моноклональные антитела
Моноклональные антитела — один из современных инструментов для лечения различных заболеваний
Автор
Редакторы
В четвертой статье спецпроекта о моноклональных антителах мы обсудим их способность лечить различные заболевания: от злокачественных опухолей до болезни Альцгеймера. Мы разберемся в многообразии современных препаратов, созданных на основе моноклональных антител, расскажем, какие особенности структуры антител могут быть использованы в современной фармацевтике.
Терапевтические антитела
Спецпроект об антителах, истории их изучения, методах работы с ними, а также о применении антител в современной медицине и биотехнологии.
Партнер спецпроекта — Департамент вычислительной биологии одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
В первой статье мы рассказали об истории открытия и применения антител [1]. Второй текст был посвящен тому, как эти молекулы распознают чужеродные нашему организму вещества и участвуют в иммунных процессах [2]. Сложный многоступенчатый процесс получения моноклональных антител стал темой третьего материала спецпроекта [3]. Эта статья будет посвящена моноклональным антителам, которые используются в качестве лекарств.
Лекарства-гурманы и препараты-обжоры
Когда человеку предстоит принимать новое лекарство, он обычно задает вопросы о безопасности и побочных эффектах. Многим врачам знакомы дотошные пациенты, приходящие на повторные приемы с инструкциями от препаратов и вопросами о возможных «побочках». Доктора много объясняют, приводят примеры и статистику, но для некоторых пациентов побочные эффекты могут стать весомой причиной для отказа от терапии. Побочные эффекты часто связаны с тем, что лекарство действует не только на болезнь, но и на нормально протекающие в организме процессы. По этому признаку лекарства можно поделить по избирательности. Избирательность в данном случае — это специфичность воздействия лечебной молекулы на процессы и реакции, лежащие в основе патологических изменений. Таргетная терапия с применением лекарств, направленных на конкретную молекулярную цель, является основой современной (доказательной) медицины [4]. Чем выше избирательность препарата, тем меньше его способность влиять на «здоровую» часть организма.
Препараты можно сравнить с человеком, подошедшим на завтрак по типу шведского стола. Гурман будет поедать только те блюда, которые он выберет в ходе пристального рассматривания тарелок, и будет почти незаметен в ресторане гостиницы. Через некоторое время на завтрак ворвется обжора, который шумно накинется на еду и будет поглощать всё без разбора. При этом он разольет по столу кофе, смешает между собой хлопья для завтрака и будет громко нахваливать поваров. Разница между едоками будет очевидна всем окружающим, особенно официантам, которым предстоит разбираться с последствиями нападения на ничего не подозревающий стол с завтраком.
Лекарства отличаются друг от друга. Одни действуют аккуратно и точно, а другие врываются в наш организм ураганом, выполняя свою задачу, но оставляя заметные разрушения после себя в виде побочных эффектов. Любой препарат ценен и опасен тем, на какие процессы он влияет. Чем ниже избирательность лекарства, чем в большее число нормальных процессов оно способно вмешаться, тем опаснее лекарство для организма. Использование «неразборчивых» медикаментов грозит более высоким риском осложнений.
Благодаря Паулю Эрлиху, внесшему огромный вклад в изучение антител [1], теоретическая медицина обогатилась концепцией «волшебной пули» [5]. Под этим названием скрывается идея о том, что можно создать препарат, обладающий высокой избирательностью. Такое лекарство должно подавлять патологические процессы и не наносить вреда организму человека, который его принял. Высокая эффективность и отсутствие побочных эффектов у препарата — мечта любой фармкомпании и любого специалиста.
Неразборчивые лекарства
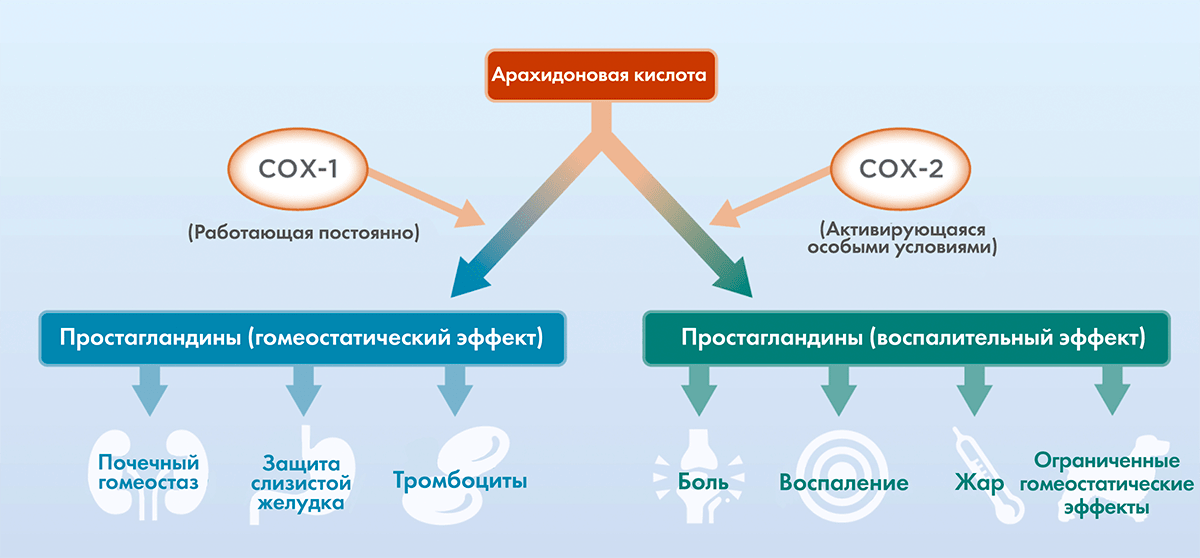
Селективность всегда была проблемой для лекарств. Хорошей иллюстрацией этого являются нестероидные противовоспалительные препараты (НПВС). Ацетилсалициловая кислота (аспирин) обладает способностью подавлять активность двух ферментов: циклооксигеназ (ЦОГ) 1 и 2. ЦОГ-1 — это фермент, который работает в нашем организме всегда. Благодаря ему производится относительно небольшое количество биологически активных веществ, которые позволяют осуществлять нормальные процессы. К таким процессам можно отнести образование защитной пленки на слизистой желудка. ЦОГ-2 «включается» при воспалении и производит массу медиаторов воспаления. НПВС принимают для того, чтобы уменьшить активность ЦОГ-2, но при приеме аспирина (препарата из «старого» поколения НПВС) «за компанию» ингибируется и ЦОГ-1. Это может вызвать такие побочные эффекты, как кровотечения и язвы слизистой желудка (ульцерогенное действие НПВС) (рис. 1).
Рисунок 1. Две изоформы ЦОГ превращают арахидоновую кислоту в простагландины. ЦОГ-1 делает так, чтобы эти вещества образовывались в небольших количествах и поддерживали физиологические процессы. Реакция воспаления тоже происходит благодаря простагландинам, но для этого их должно быть намного больше, чем при нормальных условиях. Такое ударное производство простагландинов обеспечивает ЦОГ-2. «Старые» НПВС (ацетилсалициловая кислота) подавляли активность обеих изоформ, а препараты новых поколений (коксибы) избирательно ингибируют «патологическую» изоформу фермента.
Высокая эффективность у ацетилсалициловой кислоты сочетается с низкой селективностью. Со временем фарминдустрия смогла освоить методы поиска и синтеза более селективных и не менее эффективных препаратов. Среди таких НПВС можно назвать целекоксиб, который избирательно подавляет работу ЦОГ-2 и не влияет на ЦОГ-1. И воспаление подавлено, и слизистая цела.
О том, как вычислительные технологии используются компанией BIOCAD для производства и испытания новых препаратов, мы расскажем в пятой статье спецпроекта.
Плюсы, минусы, подводные камни
Антитела — это специальные молекулы, производимые клетками иммунной системы. Они умеют распознавать антигены — структуры, чуждые для нашего организма, — и помогают в атаке на них [2]. Антитела уже давно используются в лечении различных заболеваний [1]. Тот этап развития медицинского знания, который мы видим сейчас, был бы невозможен без исследований конца XIX — начала XX веков, например, развития метода гибридóм, о котором мы уже не раз писали [1], [9], [10].
Моноклональные антитела — это класс препаратов, которые обладают высокой селективностью в отношении молекулярной мишени, являющейся, как правило, одним из ключевых компонентов патологического процесса. Антитела обладают способностью точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую специфичность. Для лекарств на основе антител это определяет их селективность в отношении конкретной мишени.
Новые лекарства используют новые точки приложения, действуют там, куда не добрались предыдущие. По этой причине они могут быть эффективнее предшественников или использоваться там, где те не справились, — в случаях, когда болезнь оказалась резистентной к традиционным препаратам. Традиционные лекарства (будем для удобства называть их химическими) действуют за счет того, что напрямую вмешиваются в биохимические реакции синтеза и распада. В медицинской практике мы встречаемся, как правило, как раз с химическими лекарствами. Жаропонижающие, антибиотики, противоопухолевые препараты (цитостатики), антидепрессанты — это препараты, полученные традиционными методами химического синтеза. Так, пенициллин — первый из числа антибиотиков, получивших медицинское применение, — убивает микробы не каким-то неизвестным волшебным образом. Он препятствует синтезу элементов клеточной стенки бактерий, которая из-за этого становится непрочной, и бактерии погибают.
Новые лекарства — новые мишени?
Когда на рынок выходит новый препарат, у специалистов возникает обоснованный вопрос, чем это лекарство отличается от предыдущих. В случае с моноклональными антителами его актуальность усиливается из-за высокой стоимости препаратов этого класса. Насколько обоснованным является выбор в их пользу?
Моноклональные антитела как новый класс препаратов имеют принципиально новые мишени (точки приложения), которые раньше не затрагивались другими препаратами. Так, цитостатики, применяемые для терапии аутоиммунных и онкологических заболеваний, в качестве точки приложения используют процессы репликации ДНК. Нарушение этих процессов в итоге приводит к прекращению роста опухолей. Звучит хорошо, но на деле химиотерапия цитостатиками напоминает применение напалма в джунглях Вьетнама. Прекращается рост не только опухолевых клеток, но и здоровых.
Кроме новизны точек приложения для моноклональных антител характерна высокая избирательность действия. Даже если мишень для препарата новая, лекарство может снова бить без разбора, нанося вред и здоровым клеткам. Моноклональные антитела способны точечно воздействовать на патологический процесс, не вмешиваясь в жизнь нормально функционирующих клеток.
Моноклональные антитела действуют тоньше, чем традиционные методы терапии. Они вмешиваются в патологические процессы не внутри клетки, а снаружи. Моноклональные антитела связываются с внеклеточными структурами, и в этом одно из их принципиальных отличий.
Лекарственные антитела выгодно отличаются от химических препаратов избирательностью действия. Этот класс лекарств относится к биологическим препаратам (biopharmaceuticals, biologics). Лекарства этой группы производятся на основе компонентов биологического происхождения и включают в себя вакцины, препараты генной и клеточной терапии.
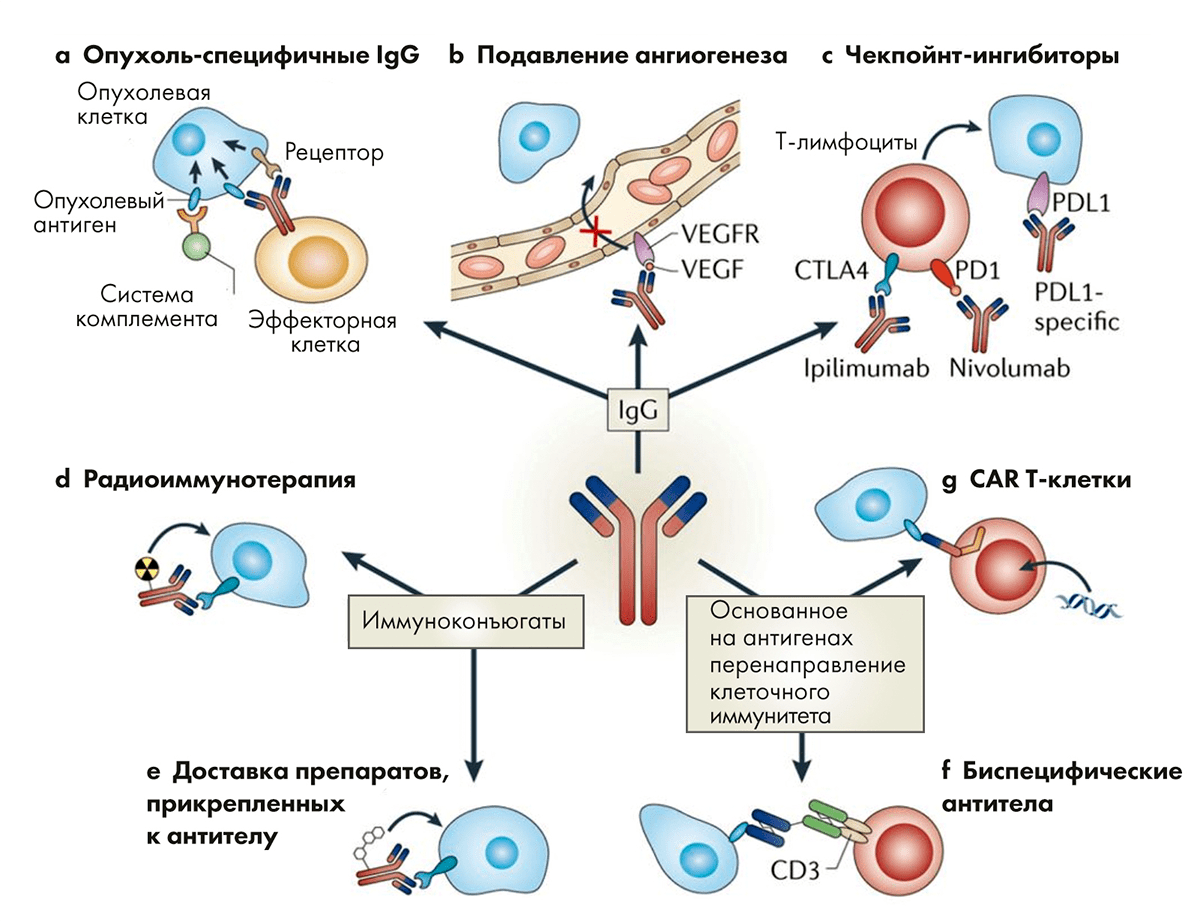
Рисунок 2. Антитела способны выполнять множество задач в организме пациента. Это очень удачный инструмент для расширения лечебного воздействия при онкологических заболеваниях.
Традиционные препараты действовали грубо и топорно при этих расстройствах. Так, для терапии аутоиммунных заболеваний можно использовать преднизолон — глюкокортикостероид, который вмешивается в разнообразные каскады иммунных реакций. Противоопухолевые препараты тоже действуют не очень изящно. Циклофосфамид — это соединение, которое применяют для лечения множества опухолей: от рака лёгких до лейкозов. Противоопухолевое действие циклофосфамида основано на его способности образовывать сшивки между нитями ДНК. Такая ДНК не способна реплицироваться, и нарушается процесс деления клеток опухоли. Всё было бы здорово, но циклофосфамид не разбирается, где опухолевая клетка, а где здоровая. Итогом его применения становится нарушение митоза в здоровых клетках организма. «Под раздачу» попадают клетки с самыми высокими темпами деления, например, кроветворные клетки и клеточные элементы крови — тромбоциты, лейкоциты, предшественники эритроцитов. По этой причине среди побочных эффектов циклофосфамида и других цитостатиков значатся кровотечения из-за недостатка тромбоцитов, подавление иммунитета из-за дефицита лейкоцитов и анемия (уменьшение количества эритроцитов).
По большому счету эти препараты пытаются держать ручку двери, которую уже вскрыл взломщик. Он дергает ее иногда так сильно, что может сломать и саму дверь, то есть вызвать серьезные побочные эффекты. Вмешательство в патологические процессы сопровождается нарушениями нормально протекающих процессов.
Лекарственные антитела действуют более аккуратно. Они работают не внутри клетки, а за ее пределами. Антитело связывается со специфическим сайтом и не дает запустить внутриклеточные процессы, приводящие к патологическим изменениям в тканях и органах. Моноклональные антитела защищают замки от взлома, и это более тонкая и безопасная стратегия, чем у традиционных препаратов. Антитела как лекарства имеют множество направлений для применения. Это не только блокирование сайтов связывания, но и доставка радионуклидных препаратов точно в цель (рис. 2) [16].
Опухолевую «крепость» можно не просто осаждать, а перекрыть ей пути поступления пищи. Антитела могут заблокировать действие фактора роста эндотелия сосудов (VEGF), за счет чего рост новых сосудов в опухоли остановится, и она начнет гибнуть из-за несоответствия потребностей и поступающих питательных веществ.
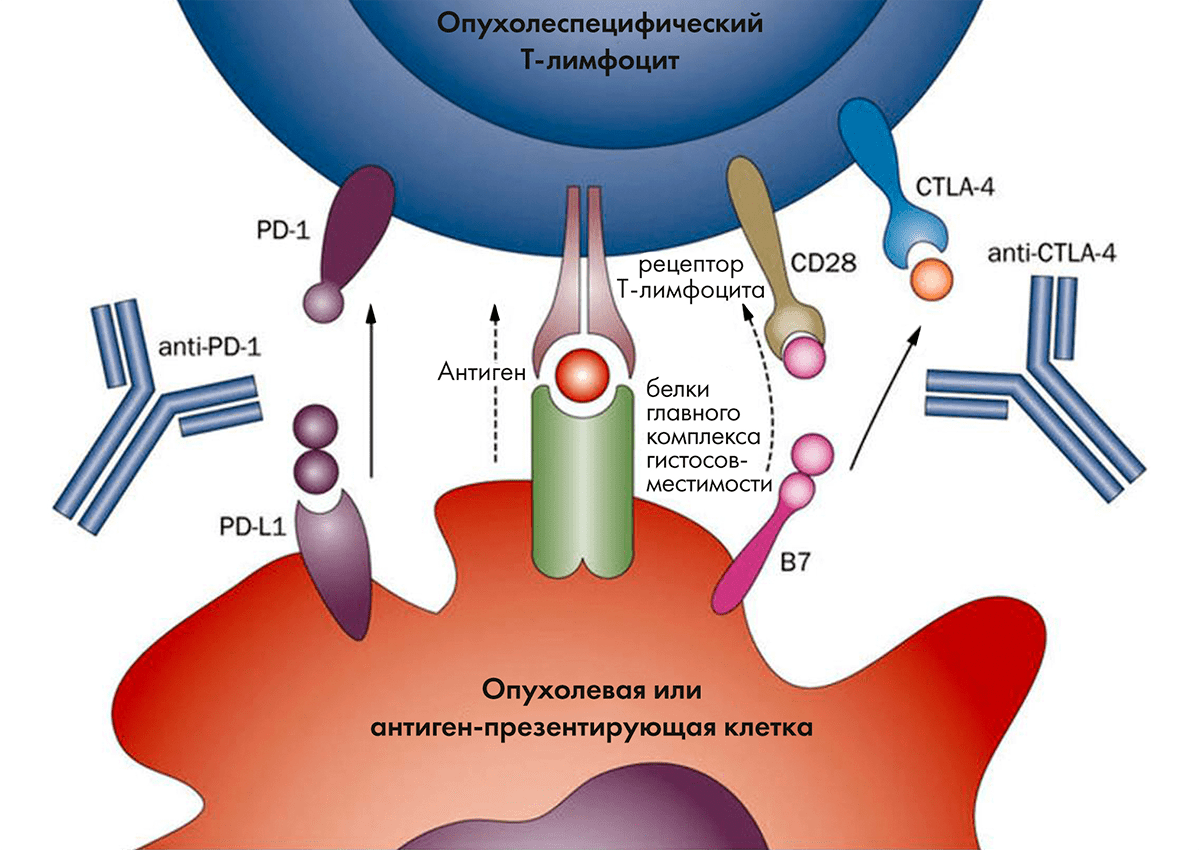
Еще один способ борьбы с опухолями — это ингибирование иммунных чекпоинтов. Воздействие одних веществ усиливает иммунную реакцию организма, а других — подавляет ее (рис. 3) [17]. Стратегия разблокировки подавляющих путей используется препаратами чекпоинт-ингибиторами. Антитела могут блокировать факторы, подавляющие иммунитет, что приводит к развитию и усилению собственной иммунной реакции, направленной на опухолевые клетки.
Рисунок 3. Мишенью для чекпоинт-ингибиторов стали молекулы, подавляющие собственный иммуннитет организма. Это цитотоксический Т-лимфоцитарный антиген 4 (cytotoxic T-lymphocyte antigen 4, CTLA4) и система PD-1/PD-L1. Пояснения к тому, как работают эти молекулы, можно найти в тексте статьи.
Цитотоксический Т-лимфоцитарный антиген 4 (cytotoxic T-lymphocyte antigen 4, CTLA4) известен также под обозначением CD152. Стимуляция CTLA4 подавляет активность T-лимфоцитов на уровне получения информации от антигенпрезентирующих клеток. Ипилимумаб и тремелимумаб способны связываться с CTLA4, не давая другим лигандам подавлять иммунный ответ на этом этапе [18].
Другое направление в терапии — это химерные антигенные рецепторы. Т-клетки, вооруженные ими, способны выборочно уничтожать опухолевые клетки. Химерный антигенный рецептор собран из двух частей. Антительный компонент, находящийся на поверхности Т-клетки, обладает высокой специфичностью и способен выявлять опухолевую клетку. Этот компонент закреплен на белковом фрагменте, который пронизывает мембрану и погружен в цитоплазму. Когда антительный фрагмент взаимодействует с мишенью, происходит активация Т-лимфоцита, и он атакует раковую клетку.
Биспецифические антитела могут связывать вместе иммунную и раковую клетки [20]. Благодаря такой «усиленной дружбе» происходит усиление иммунного ответа, и раковые клетки гибнут. В некоторых случаях они находят третьего товарища в виде макрофага: здесь также произойдет усиление иммунных реакций против клеток опухоли. Иммуноконъюгаты — это класс веществ, где антитело соединено с лекарством, которое надо точечно доставить к раковой клетке. В качестве лекарства может быть радионуклид или противоопухолевое лекарство — то, что может ударить по всем клеткам, но лучше бы било только по опухолевым.
Разработка и получение моноклональных антител стандартизированы и хорошо контролируются производителями. Моноклональные антитела — это блестящий на солнце лекарственный биотех. Он существенно отличается от «паровых котлов» традиционной фармакотерапии. Однако аварии происходят даже с самыми современными машинами. В случае моноклональных антител побочные эффекты также могут возникнуть, но обычно они легче, чем при традиционной терапии химическими препаратами. Гриппоподобные синдромы, инфекционные осложнения, поражение кожи и слизистых могут сопровождать терапию моноклональными антителами. Известны случаи, когда введение экспериментальных лекарственных антител приводило к развитию «цитокинового шторма» [21]. При этом состоянии иммунные клетки нашего тела начинают активно вырабатывать медиаторы воспаления, и человек впадает в состояние, похожее на септический шок, только без бактериального возбудителя. Лекарство всегда остается лекарством. Если вещество может принести пользу, значит, оно может и навредить. Побочных эффектов нет только у гомеопатических препаратов, потому что они не работают.
Следом за селективностью подтянулись безопасность и стоимость. Оригинальные лекарства дороги, потому что в их стоимость закладывается множество трат. Стоимость разработки препарата, всех этапов тестирования, расходы на тупиковые ветки (лекарства, которые не показали своей эффективности) — всё это спрятано в цене, которую мы видим в аптеке. Фармацевтический рынок заполнен не только оригинальными препаратами: большую часть полок в аптеках занимают лекарства-аналоги. Оригинальные препараты защищены от копирования патентом: в течение какого-то времени на рынке будет только новый препарат от одного производителя. Когда срок действия патента истечет, другие производители смогут выпустить на рынок свои препараты с этим же веществом. Такие легальные копии оригинального препарата называются лекарствами-аналогами или дженериками (англ. generics) [22].
Фармакологическим компаниям, занимающимся дженериками, не надо тратиться на весь исследовательский этап: в некоторых случаях даже не надо полностью подтверждать эффективность препарата. Можно сделать цену на дженерик ниже, чем цена оригинального препарата, а прибыли получить гораздо больше. Эта одна из причин, по которым у фармкомпаний снижается интерес к поиску и производству новых препаратов. Стоимость лекарств на основе моноклональных антител высока также потому, что процесс их получения отличается от синтеза традиционных лекарств. Это серьезная биотехнологическая процедура, для которой нужны специальные условия производства и люди с образованием, отличающимся от традиционного в этой индустрии [3].
Арсенал судьи Дредда
Если говорить о лекарствах как о пулях, то моноклональные антитела — это арсенал судьи Дредда. Существующее множество биологических препаратов позволяет проводить терапию самых разных болезней. Стоит оговориться, что моноклональные антитела приобретают особую ценность в лечении заболеваний с мощным иммунным компонентом патогенеза. В патогенезе многих аутоиммунных заболеваний можно обнаружить ключевую иммунную реакцию — процесс, на котором держится весь патологический каскад. Его блокировка способна приостановить развитие аутоиммунного процесса и значительно облегчить состояние пациента.
Антительный «арсенал» сегодня составлен из множества препаратов. Они представлены в первой статье спецпроекта в виде таблицы [1]. Каждое из этих лекарств «нацелено» на 2–3 заболевания. Причина кроется в избирательности антител: они метят в молекулу, которая имеет ключевое значение для развития или поддержания болезни. Аутоиммунные заболевания и заболевания с вовлечением других иммунных процессов — это подходящая область для терапии моноклональными антителами. Патогенез этих болезней включает большое количество собственных белковых молекул пациента со специальной функцией, на которые мы можем воздействовать.
Системная красная волчанка
Белимумаб, применяемый при системной красной волчанке (СКВ) [23], способен связываться с фактором, активирующим В-клетки (B-cell activating factor, BAFF) [24]. BAFF — это цитокин, избирательно повышающий активность B-лимфоцитов и позволяющий им превращаться в плазматические клетки [25]. Для этого цитокину нужно связаться с рецепторами на поверхности клетки. Это событие запустит цепочку сигналов, срабатывание которой приведет к увеличению выработки антител. Для СКВ выработка антител — это ключевой компонент патогенеза. Если антитела перестанут вырабатываться или будут производиться в меньшем количестве, это положительно скажется на течении заболевания. Например, может уменьшиться поражение почек, часто встречающееся при СКВ. Белимумаб связывается с циркулирующим в крови BAFF, не давая ему прицепляться к рецепторам на B-лимфоцитах. Из-за отсутствия этого стимула B-лимфоциты не производят аутоантитела и не превращаются в плазматические клетки. Кроме этого, страдает производство не только антител против собственных тканей, но и против патогенной микрофлоры. По этой причине осложнением при использовании моноклональных антител могут стать инфекционные заболевания. Впрочем, это родовое проклятие всех иммуносупрессантов, в том числе давно используемого и хорошо изученного преднизолона.
Ревматоидный и псориатический артриты
Антитела нашли применение [26] и в лечении ревматоидного артрита (РА) — заболевания, поражающего крупные и мелкие суставы и приводящего к потере способности самостоятельно передвигаться [12]. Инфликсимаб и другие моноклональные антитела активно вмешиваются в воспалительное звено патогенеза РА. Большинство терапевтических антител, используемых при РА, бьют по фактору некрозу опухоли (ФНО или TNF). Тоцилизумаб связывается со свободным и расположенным на мембране интерлейкином-6 (ИЛ-6). Отдельно от этих препаратов стоят этанерцепт и абатацепт. Это гибридные белки, или фьюжн-белки. Они представляют собой два белка, которые кодируются разными генами, но сшиваются в одну молекулу. Этанерцепт — это комбинация рецептора к ФНО и Fc-участка IgG. Этот гибридный белок блокирует избыток ФНО, не позволяя поддерживать воспалительную реакцию при аутоиммунных заболеваниях. Абатацепт представляет собой домен молекулы CTLA-4, соединенный с Fc-участком IgG. Такой фьюжн-белок связывается с рецепторами CD80 и CD86 на поверхности T-лимфоцитов и не дает им полностью активироваться и вести разрушительную деятельность в хрящевой ткани суставов. Инфликсимаб также эффективен при другом заболевании, поражающем суставы — при анкилозирующем спондилите (болезни Бехтерева).
Другой мишенью для терапии моноклональными антителами стало поражение суставов при псориазе — псориатический артрит (ПА). Этанерцепт, адалимумаб и инфликсимаб, как и при РА, мешают ФНО выполнять свою работу. Три препарата сравнивали в отдельном исследовании, где показали бóльшую безопасность адалимумаба по сравнению с двумя остальными молекулами [27].
«Лотесса» против «Ремикейда»
Оригинальный инфликсимаб («Ремикейд») сравнивали по эффективности и безопасности с инфликсимабом компании BIOCAD («Лотесса»). Данное исследование, включившее почти 200 человек, установило, что «Ремикейд» и «Лотесса» сравнимы по этим параметрам. Результаты клинического испытания были опубликованы летом 2018 года в журнале Annals of the Rheumatic Disease [28]. Кроме того, BIOCAD создал оригинальный моноклональный препарат левилимаб, мишенью которого также стал ИЛ6.
Антитела для суставов
Адалимумаб от BIOCAD ждет выхода на рынок и сейчас проходит дополнительные исследования безопасности и эффективности, где его сравнивают с оригинальной «Хумирой». Предварительные результаты исследований будут известны позже. Мишенью другого — уже оригинального — препарата от BIOCAD, нетакимаба, стал ИЛ17. Сейчас препарат тестируют в отношении псориаза и анкилозирующего спондилита (болезни Бехтерева).
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD
Кроме этих заболеваний с иммунным компонентом моноклональные антитела оказались полезны при язвенном колите и болезни Крона — воспалительных заболеваниях, поражающих желудочно-кишечный тракт. Ведолизумаб используется при обеих патологиях. Он препятствует миграции Т-хелперов из кровеносных сосудов в стенку кишечника. Ведолизумаб способен избирательно связываться с белком α4β7-интегрином, расположенным на клетках кишечника. Его блокировка нарушает процесс соединения молекул клеточной адгезии слизистой оболочки с адрессином-1 (MAdCAM-1) на Т-лимфоцитах. Соответственно, Т-лимфоциты не могут закрепиться на клетках кишечника, и иммунная реакция не запускается.
Реакция отторжения трансплантата
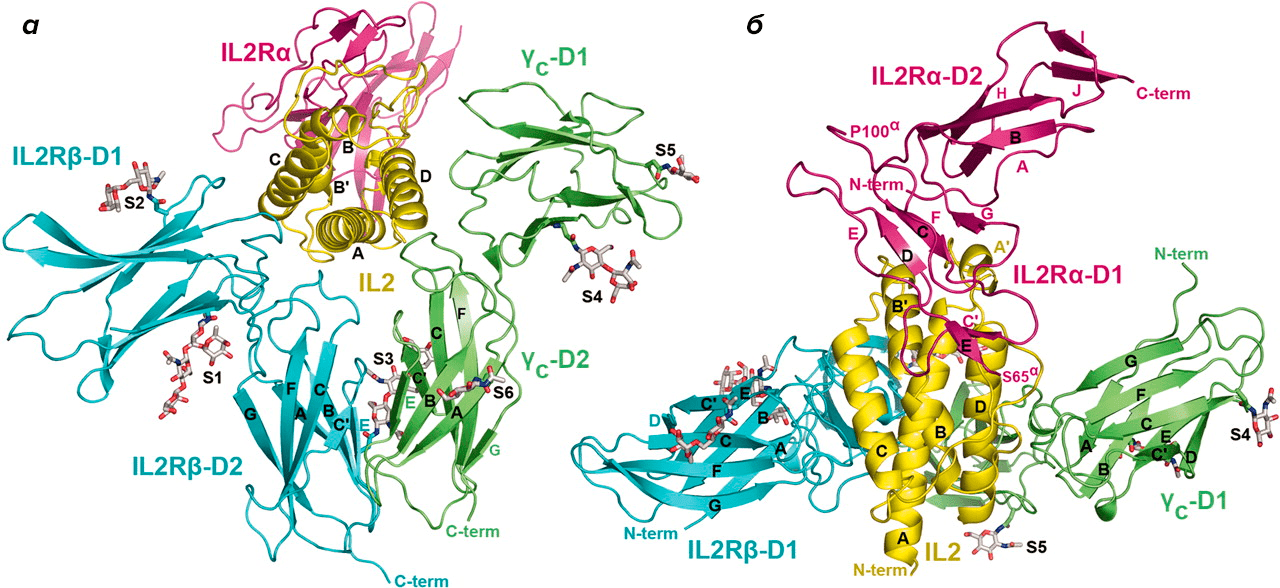
Антитела могут оказаться полезными при лечении иммунных осложнений — реакции отторжения пересаженного органа. Оба препарата, одобренных для борьбы с отторжением трансплантата почки (басиликсимаб и даклизумаб), препятствуют связыванию интерлейкина-2 (ИЛ2) со специфическим рецептором. Это происходит благодаря блокированию α-субъединицы рецептора (рис. 4) [29]. В отличие от всех случаев, описанных выше, антитело связывается с рецептором, а не с молекулой, которая его активирует. При таком взаимодействии всегда есть опасность, что вместо ингибирования реакции вещество запустит ее. В ходе длительных работ по отбору антител были получены такие молекулы, которые лишены способности стимулировать рецепторы и запускать иммунную реакцию.
Рисунок 4. Строение рецептора к ИЛ2. а — Вид сбоку. б — Вид сверху. Мишень для моноклональных антител (α-субъединица рецептора) нарисована красным.
Пароксизмальная ночная гемоглобинурия
Болезнь Альцгеймера
Болезнь Альцгеймера — это не такое редкое заболевание, как пароксизмальная ночная гемоглобинурия [32]. Широта его распространения и неудовлетворенность существующими методами лечения заставляет ученых искать новые методы лечения. Сейчас мы знаем, что в патогенезе болезни Альцгеймера важную роль играет накопление β-амилоида (в соответствии с амилоидной гипотезой). Сам β-амилоид при этом, видимо, является частью системы врожденного иммунитета [33], значит, у антител есть потенциальная возможность воздействовать на этот процесс.
Надежды пока не оправдываются. Компания Pfizer уже прекратила клинические исследования двух моноклональных антител против β-амилоида [34]. Бапинеузумаб и его модифицированная версия оказались неэффективны против накопления белковых отложений в нейронах. Адуканумаб показывает более убедительные результаты, и в настоящее время идут испытания третьей фазы. Разница в эффективности антител может быть связана с различиями в принципе их действия. Бапинеузумаб задумывался как препарат, способный усилить очищение нервной ткани от β-амилоида, в том числе путем его захвата микроглией. Получилось антитело-метка для собственной иммунной системы мозга. Он связывается с мономерами и полимерами β-амилоида. Адуканумаб селективно связывается с β-амилоидными полимерами, которые токсически воздействуют на нейроны [35]. В этих условиях иммунным клеткам не приходится тратить ресурсы на борьбу с безопасным вариантом β-амилоида, и они сосредоточиваются на борьбе с полимерной версией.
По данным предварительных исследований, еще один препарат на основе моноклональных антител показывает хорошую эффективность и переносимость [36]. Это соланезумаб. Эти антитела связываются с растворимыми частицами β-амилоида, которые еще не упакованы в полимеры. Впоследствии β-амилоид выводится из нервной ткани и не оказывает токсического влияния на синапсы. Несмотря на это, пока не существует одобренного способа лечения болезни Альцгеймера при помощи антител. Человечество ждет результатов клинических исследований.
Онкологические заболевания
В борьбе со злокачественными новообразованичми антитела используют четыре механизма [37]:
Лекарства против рака
Компания BIOCAD предлагает несколько препаратов против онкологических заболеваний. Собственный ритуксимаб («Ацеллбия») компании BIOCAD оказался эффективен при неходжкинской лимфоме. Препаратом сравнения выступала оригинальная «МабТера», и «Ацеллбия» не оказалась хуже зарубежного лекарства от топового игрока фармрынка. Препарат, используемый для лечения рака молочной железы, трастузумаб, блокирует рецептор HER2 и не дает эпидермальным факторам роста стимулировать рост опухолевых клеток. Компания BIOCAD выпускает собственный трастузумаб («Гертикад»), который не уступает оригинальному препарату по своей клинической эффективности. Терапия собственным бевацизумабом («Авегра БИОКАД») при немелкоклеточном раке легких в сочетании с карбоплатином и паклитакселом показала схожую эффективность и безопасность терапии оригинальным препаратом («Авастин»), дополненную теми же веществами.
BIOCAD разработала и исследует препараты из класса чекпоинт-ингибиторов, о которых мы рассказали выше. Первое исследование препарата под названием «пролголимаб» было посвящено изучению нового чекпоинт-ингибитора при меланоме, раке легкого и почечной карциноме. Завершенные в настоящее время клинические испытания препарата показали его эффективность в отношении меланомы. Теперь осталось дождаться выхода нового лекарства на рынок.
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD
Заключение
Департамент вычислительной биологии компании BIOCAD — спонсор спецпроекта
BIOCAD — международная биотехнологическая компания, которая создала умную технологическую платформу, объединившую в себе компьютерное моделирование и современные принципы синтеза генов de novo.
В компании реализован полный цикл выпуска лекарственных препаратов: от поиска лекарственной молекулы до массового производства и маркетинговой поддержки.
Компания ведет два масштабных проекта:
Для разработки лекарственных препаратов BIOCAD применяет технологию structure-based drug design, использующую методы компьютерного моделирования. Это позволяет сделать поиск молекул направленным. С помощью математического моделирования отобранная молекула оптимизируется под конкретную мишень, а затем воспроизводится в реальной лаборатории.
В основе большинства разработок компании лежит математическое моделирование. То, что раньше было возможно осуществить исключительно in vitro в стенах лабораторий, по мнению исследователей BIOCAD, сегодня может быть воплощено in silico силой чистого разума.
Здесь собрали одну из лучших команд биоинформатиков в стране, которая занимается научными исследованиями, разрабатывает и внедряет новейшие методы интеллектуального анализа данных. В ее распоряжении один из мощнейших вычислительных кластеров, и если еще 2–3 года назад можно было только мечтать о решении задач направленного дизайна белковых молекул, то сейчас это одно из направлений работ Департамента вычислительной биологии.
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD