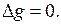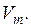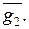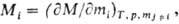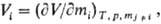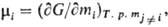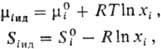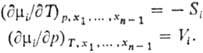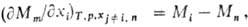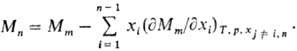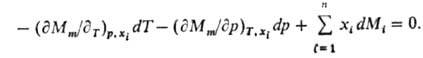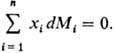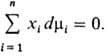Может ли парциальный мольный объем быть отрицательным что это означает
Парциальные молярные величины
Введение
Тема 6. Растворы
Исследование растворов – важная область физической химии, поскольку как в природе, так и в технике нам постоянно приходиться иметь дело с растворами, а не с чистыми веществами. Например, получаемые в современной технике методами вакуумной и зонной плавок чистейшие металлы все же содержат ничтожные количества (10 –6 %) примесей, главным образом металлоидов, и по существу являются растворами.
Большая часть процессов, протекающих в природе, а также лежащих в основе различных технологических процессов, протекают в жидкой фазе. Так химические реакции при выплавке чугуна и стали происходят преимущественно в растворах. Жидкие чугун и сталь представляют собой растворы различных элементов в железе. В доменных и сталеплавильных печах они взаимодействуют с жидким шлаком – раствором оксидов.
Водные растворы солей, кислот и оснований широко используются в гидрометаллургии при извлечении цветных металлов из руд.
Раствором называется однородная, гомогенная система переменного состава, состоящая из двух или более компонентов. Растворы могут существовать в любом агрегатном состоянии – твердом, жидком или газообразном. Общим признаком их является однофазность.
Растворы весьма разнообразны по своей природе и по характеру взаимодействия между частицами их компонентов. Так, например, раствор серной кислоты в воде, образующийся с выделением большого количества тепла, характеризуется отчетливо выраженным химическим взаимодействием, а в растворе сжиженных благородных газов – аргона и неона – действуют физические силы. Во многих реальных растворах природа взаимодействия между частицами настолько сложна, что невозможно отделить ее химическую и физическую стороны.
Компонентами раствора являются растворитель (среда) и растворенное вещество (или несколько веществ), равномерно распределенных в растворителе в виде молекул, атомов или ионов. Под растворителем обычно понимают то вещество, которое находится в таком же агрегатном состоянии, что и раствор в целом. Если агрегатное состояние веществ, составляющих раствор, одинаковое, то растворителем называют то из них, которое преобладает в данной системе. Например, в 5%-ном растворе сахара в воде последняя является растворителем, а сахар – растворенным веществом. В целом понятия «растворитель» и «растворенное вещество» имеют до некоторой степени условный характер. Например, в концентрированных растворах различие между растворенным веществом и растворителем менее очевидно. Для 50%-ного раствора этилового спирта и воды понятия равноправны, а для раствора, в котором содержится 95 % спирта и 5 % воды, последняя является растворенным веществом. Поэтому понятия «растворитель» и «растворенное вещество» целесообразно использовать в применении к разбавленным (неконцентрированным) растворам. Для растворов электролитов вода всегда является растворителем, даже если ее и очень мало.
Состав раствора или его концентрацию выражают различными способами. Наиболее удобно выражать концентрацию раствора в мольных долях.
Молярная доля Ni – отношение числа молей i-го вещества (ni) к общему числу молей всех компонентов в данном количестве раствора Σni:
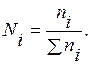
В случае водных растворов концентрацию обычно выражают числом число молей растворенного вещества в 1 л раствора – молярная концентрация (См):
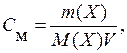
Однако, использование молярной концентрации не всегда удобно, так как концентрация раствора вследствие термического расширения зависит от температуры. В связи с этим часто также пользуются моляльностью. Моляльность (Cm) – число молей растворенного вещества в 1000 г растворителя:
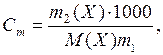
где m2(X) – масса растворенного вещества, г; М(X) – молярная масса растворенного вещества, г/моль; m1 – масса растворителя, г.
Между молярной долей и моляльностью в водных растворах существует соотношение
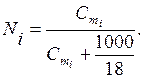
Вещество, переходя в раствор, становится компонентом раствора, теряет свою индивидуальность.
Свойства раствора могут быть охарактеризованы термодинамическими величинами V, H, U, F, G и т.д. Вследствие взаимодействия между молекулами компонентов раствора термодинамические характеристики имеет смысл относить к раствору как к целому, а не к составляющим его веществам. Так, раствор характеризуется вполне определенным, поддающимся простому измерению объемом, однако нельзя определить, какие объемы занимают в нем отдельные компоненты.
В каком либо растворе, например растворе серной кислоты в воде, наряду с энергией молекул серной кислоты и воды имеет место энергия взаимодействия между этими веществами, которая характеризует раствор и не может быть отнесена к какому-либо из компонентов. Однако все же важно охарактеризовать, какую долю вносит данный компонент в то или иное свойство раствора. Такая характеристика называется парциальной величиной.
Г. Льюис назвал парциальной молярной величиной компонента частную производную от какой-либо экстенсивной величины g по числу молей 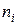
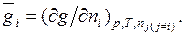
Соблюдение условий, требуемых этим определением, может быть достигнуто, если, например, к весьма большому объему раствора данной концентрации при постоянных 
Например, парциальный молярный объем определяется уравнением

Если раствор образуется из компонентов без изменения объема, то очевидно, что парциальный молярный объем равен его молярному объему, т. е. 
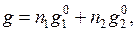
где 
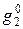
Очевидно, в этом случае при образовании раствора
Если, например, при образовании раствора энтальпия аддитивна, то 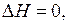
Среди парциальных молярных величин особое значение имеет парциальная молярная свободная энергия

которая называется также часто химическим потенциалом и обозначается
Химический потенциал наряду с температурой и давлением является интенсивной величиной. Таким образом, равенство температур давлений и химических потенциалов всех компонентов в различных частях системы выражает условия термического, механического и химического равновесий (см.раздел 2.12).
Величина 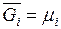
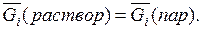
Если бы, например, химический потенциал вещества в растворе был больше, чем в газовой фазе, то происходило бы испарение этого вещества, при котором 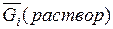
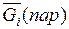
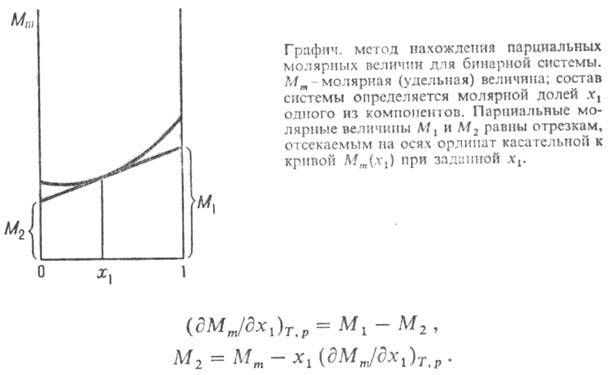
Парциальные молярные величины характеризуют свойства растворов. Они играют такую же роль в термодинамических расчетах равновесий в растворах, как соответствующие функции (U, H, F, G, S и т. д.) при расчетах, относящихся к реакциям между чистыми веществами. В связи с этим целесообразно составление таблиц парциальных молярных величин. Чтобы определить парциальную молярную величину данного компонента, необходимо найти зависимость соответствующего экстенсивного свойства от состава раствора при постоянных робщ, T и числах молей остальных компонентов и произвести дифференцирование по числу молей этого компонента. Для бинарных растворов такое определение обычно производится графически при помощи метода отрезков. Для этого вычисляют свойство одного моля раствора.
Молем раствора называется такое его количество, при котором число молей каждого компонента равное его мольной доле. Например, один моль раствора углерода в жидком железе, в котором 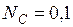
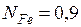
Свойство раствора g, относящееся к одному молю, обозначается индексом 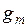
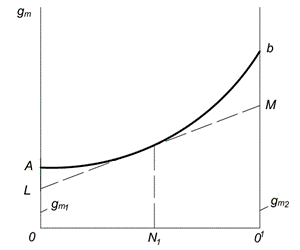
Графический метод определения парциальных молярных величин представлен на рис. 6.1. По оси абсцисс откладывают молярные доли первого и второго компонентов (N1 и N2). Точка О соответствует первому чистому компоненту; в этой точке N1 = 1 и N2 = 0. Точка О 1 соответствует второму чистому компоненту; в этой точке N1 = 0 и N2 = 1. Каждая точка на прямой ОО 1 соответствует раствору определенного состава.
Величина какого-либо свойства одного моля раствора 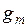
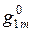
Рис. 6.1. Графический метод определения парциальных молярных величин
Для нахождения парциальных молярных величин компонентов в растворе данной концентрации, например 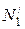
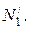
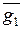
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ВЕЛИЧИНЫ
т.е. равна производной от величины M по числу молей m i компонента i при постоянных т-ре T, давлении p и числах молей 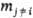
где G-энергия Гиббса системы.
Зависимость парциальных молярных величин от Т и р определяется теми же термодинамич. соотношениями, что и для соответствующих экстенсивных св-в. Так, для хим. потенциала m i выполняются соотношения, аналогичные тем, к-рые справедливы для энергии Гиббса, а именно:
Для приближенного определения используют графич. метод (см. рис.). В случае бинарной системы
Изменения парциальных молярных величин при изменении состояния системы связаны между собой Гиббса-Дюгема уравнением, к-рое в обобщенном виде записывается след. образом:
При Т, p = const (изотермо-изобарные условия)
Согласно этому ур-нию, в бинарной системе парциальные молярные величины M 1 и M 2 при изменении состава изменяются в противоположных направлениях. Экстремумы на кривых M 1 (x 1 ) и M 2 (x 1 ), если таковые имеются, наблюдаются при одном и том же составе и противоположны по типу. Напр., для хим. потенциалов
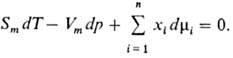
Это соотношение служит для расчета хим. потенциала компонента р-ра на основании концентрац. зависимости хим. потенциалов остальных компонентов, а также используется для проверки на термодинамич. согласованность эксперим. данных о зависимостях хим. потенциалов от состава, т-ры и т.п.
Понятие парциальных молярных величин широко используют при рассмотрении хим. и фазовых равновесий.
Лит.: Карапетьянц M. X., Химическая термодинамика, 3 изд., M., 1975; Физическая химия, под ред. Б. П. Никольского, 2 изд., Л., 1987. H. А. Смирнова.
СОДЕРЖАНИЕ
Определение
Под парциальным молярным объемом в целом понимается вклад, который компонент смеси вносит в общий объем раствора. Однако это еще не все:
Обычно парциальный молярный объем вещества X в смеси представляет собой изменение объема на моль X, добавленного к смеси.
Парциальные молярные объемы компонентов смеси меняются в зависимости от состава смеси, поскольку окружение молекул в смеси изменяется вместе с составом. Именно изменение молекулярного окружения (и последующее изменение взаимодействий между молекулами) приводит к изменению термодинамических свойств смеси по мере изменения ее состава.
Приложения
Частичные молярные свойства полезны, потому что химические смеси часто поддерживаются при постоянной температуре и давлении, и в этих условиях значение любого экстенсивного свойства может быть получено из его парциальных молярных свойств. Они особенно полезны при рассмотрении конкретных свойств из чистых веществ (то есть, свойство одного моля чистого вещества) и свойство перемешивания (например, теплота смешения или энтропии смешения ). По определению, свойства смешивания связаны со свойствами чистых веществ:
Таким образом, зная частичные молярные свойства, можно рассчитать отклонение свойств смешивания от отдельных компонентов.
Связь с термодинамическими потенциалами
Дифференциальная форма термодинамических потенциалов
Термодинамические потенциалы также удовлетворяют
Измерение частичных молярных свойств
Отношение к кажущимся молярным количествам
Связь между частичными молярными свойствами и кажущимися свойствами может быть выведена из определения кажущихся величин и моляльности.
V 1 ¯ знак равно ϕ V
Соотношение справедливо и для многокомпонентных смесей, только в этом случае требуется индекс i.