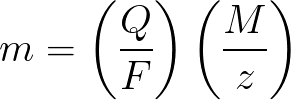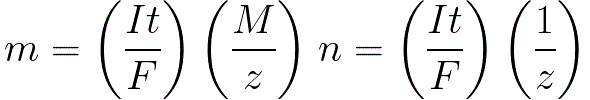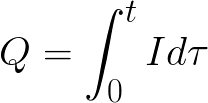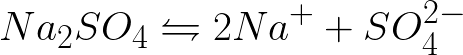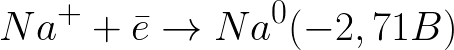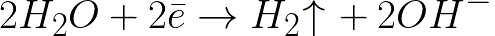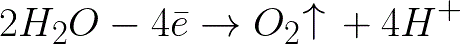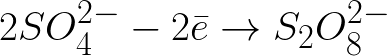Можно ли на основании законов фарадея сделать заключение что для электролитического выделения
Можно ли на основании законов фарадея сделать заключение что для электролитического выделения
Масса выделяющегося вещества зависит только от величины протекающего заряда, а величина энергии зависит, кроме этого, и от разности потенциалов.
. 2 г меди. Сколько граммов меди отложится на катодах остальных ванн, если все они соединены последовательно?
По 2 г в каждой ванне.
На электроде С наибольшее, так как при прочих равных условиях сила тока здесь наибольшая.
Одинаковые, так как ток во всех ваннах одинаков, а ионы хлора всегда одновалентны.
Из растворов на катоде будет выделяться не натрий, а водород.
Вращение ванны способствует равномерному покрытию деталей и позволяет применять большие плотности тока, что значительно ускоряет процесс электролиза.
В обычных условиях воздух не является проводником тока.
Надо провести заряженный изолятор сквозь раскаленные газы вблизи горелки: раскаленные газы содержат достаточное количество отрицательно заряженных ионов, нейтрализующих заряд стеклянной палочки.
Светящуюся часть пламени свечи создают не раскаленные газы, а несгоревшие мельчайшие раскаленные частицы углерода. При высокой температуре раскаленный уголь, как и металлы, излучает электроны, в результате чего сам заряжается положительно, поэтому пламя будет отклоняться в сторону отрицательного полюса электрофорной машины.
Воздух под действием космического излучения и радиоактивного излучения Земли всегда поддерживается в ионизированном состоянии.
Для свечения газа в неоновой лампе нужно создать в ней электрическое поле. В результате трения о стекло неоновой лампы возникают электрические заряды, поле которых достаточно для кратковременного свечения лампы.
Положительные ионы воздуха бомбардируют и разрушают нить.
Положительный столб укорачивается.
Проходит в виде тихого разряда, но не ощущается птицами вследствие крайне незначительной величины разрядного тока.
Поверхность шара не идеально гладкая. Около отдельных микрошероховатостей, имеющих очень малый радиус кривизны и большую напряженность электрического поля, начинается тихий разряд. Поэтому заряды с шара стекают раньше, чем это следует из расчета для всей поверхности шара.
На иголке наводится заряд противоположного знака, который нейтрализует заряд, находящийся на листочках.
Можно ли на основании законов фарадея сделать заключение что для электролитического выделения
. энергия сторонних сил? Что происходит с энергией конденсатора?
Работа сторонних сил увеличивает энергию аккумулятора. Поскольку пластины конденсатора все время остаются присоединенными к клеммам аккумулятора, разность потенциалов, приложенная к ним, остается постоянной. Так как при раздвижении пластин емкость конденсатора уменьшается, то заряд на них должен уменьшаться, происходит частичный разряд конденсатора, и в цепи протекает ток, вследствие чего аккумулятор заряжается.
Нет, потому что диссоциирующая молекула состоит из ионов разных знаков.
Потому что в каждой единице объема электролита находится столько же положительных зарядов, сколько и отрицательных, их поля вне электролита взаимно компенсируются, поэтому в целом электролит ведет себя как незаряженное тело.
Влага на руках всегда содержит раствор различных солей и является электролитом. Поэтому она создает хороший контакт между проводами и кожей.
Влажный воздух не проводит электричество, но твердые изоляторы, на поверхности которых оседает влага, становятся проводниками. Если изоляторы высушить, то они будут удерживать заряд и во влажном воздухе.
Ионы, содержащиеся в воде, обеспечивают хорошую электропроводность почвы.
Потому что влага на проводах представляет собой электролит и является проводником, а это может привести к короткому замыканию и пожару.
Подумайте, как начать выполнение этого опыта, чтобы не пережечь ее.
б) Сколькими способами можно прекратить накал лампочки, не вынимая электродов А и Б из раствора соли?
в) Меняется ли величина тока в цепи при опускании в раствор электродов, присоединенных к лампочке?
а) Опустить электроды, идущие от лампы и прижатые один к другому, в раствор поваренной соли, а затем медленно раздвинуть их;
б) можно или сблизить электроды, соединенные с лампой, или расположить их в плоскости, перпендикулярной линиям тока;
в) ток увеличивается, так как уменьшается сопротивление жидкого проводника между электродами.
. ток пойдет то по направлению течения жидкости, то против него, то под углом к нему?
Нет.
Электродинамика (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
а) Известно, что если в стакан с питьевой водой опустить два электрода и к ним подвести достаточное напряжение, то вода закипит. Объясните это явление.
б) Можно ли на основании законов Фарадея сделать заключение, что для электролитического выделения одинаковых масс данного вещества требуется затратить одинаковое количество энергии тока?
2. Практический блок.
1. Отчет по самостоятельному изучению материала
2. Решение задач в аудитории
3. Решение задач домашнего задания
Цель: 1. Повторение теоретического материала темы занятий.
2. Практическое применение теоретического материала при решении задач.
3. Контроль за самостоятельным изучением теоретического материала.
Рассматриваемые вопросы
1. Магнитное поле электрического тока.
2. Индукция и напряженность магнитного поля.
3. Закон Био-Савара-Лапласа.
Силы, действующие на токи и заряды в магнитном поле. Циркуляция вектора напряженности магнитного поля.
I. Подготовка к занятию
1. Повторить теоретический материал:
- Дать определение: магнитного поля, магнитной индукции, напряженности магнитного поля, закона Био-Савара-Лапласа, силы Ампера, единицы силы тока, силы Лоренца, соленойда, закон полного тока.
2. Записать формулы: принципа суперпозиции магнитных полей, связь В и Н, закона Био-Савара-Лапласа, силы Ампера, силы взаимодействия двух проводников, обобщенной силы Лоренца, индукции поля прямого проводника с током, индукции поля кругового тока, индукции поля соленоидального тока, закона полного тока
2. Законспектировать материал, выносимый на самостоятельное изучение: «Определение удельного заряда электрона».
II. Работа в аудитории
1. Вопросы, выносимые на обсуждение:
а) Вдоль длинного прямолинейного магнита расположен гибкий свободный проводник. Какое положение он займет, если по нему пропустить ток?
б) Если заряженная частица, пролетая некоторую область пространства, не откланяется от первоначального направления движения, можно ли утверждать, что магнитное поле в этой области пространства отсутствует?
2. Практический блок.
1. Отчет по самостоятельному изучению материала
2. Решение задач в аудитории
3. Решение задач домашнего задания
Цель: 1. Повторение теоретического материала темы занятий.
2. Практическое применение теоретического материала при решении задач.
3. Контроль за самостоятельным изучением теоретического материала.
Рассматриваемые вопросы
2. Законы Фарадея и правила Ленца.
3. Само и взаимоиндукция.
6. Энергия магнитного поля.
I. Подготовка к занятию
1. Повторить теоретический материал:
1. Дать определение: электромагнитной индукции, индукционного тока, правила Ленца, самоиндукции, индуктивности (2 определения), взаимоиндукции, вихревого тока.
2. Записать формулы: магнитного потока, эдс индукции, эдс самоиндукции, теоремы взаимности, эдс взаимоиндукции, энергии магнитного поля, плотности энергии магнитного поля
2. Законспектировать материал, выносимый на самостоятельное изучение: «Вихревые токи».
3.Выполнить письменно задание:
Покажите, что правило Ленца соответствует закону сохранения энергии для процесса электромагнитной индукции.
II. Работа в аудитории
1. Вопросы, выносимые на обсуждение:
а) Как будет вращаться магнитная стрелка, если над ней вращать медный диск?
б) Как обеспечивается малая индуктивность реостата?
2. Практический блок.
1. Отчет по самостоятельному изучению материала
2. Решение задач в аудитории
3. Решение задач домашнего задания
Цель: 1. Повторение теоретического материала темы занятий.
2. Практическое применение теоретического материала при решении задач.
3. Контроль за самостоятельным изучением теоретического материала.
Рассматриваемые вопросы
1. Электрический колебательный контур.
2. Свободные электрические колебания.
3. Вынужденные электрические колебания.
4. Электрические автоколебания.
I. Подготовка к занятию
1. Повторить теоретический материал:
1. Дать определение: колебательного контура, идеального колебательного контура, свободные незатухающих колебаний, реального колебательного контура, свободные затухающих колебаний, добротности контура, вынужденных колебаний, автоколебаний
2. Записать формулы: энергии электрического поля конденсатора, энергии магнитного поля конденсатора, периода колебаний в идеальном контуре, добротности, периода колебаний в реальном контуре.
2. Законспектировать материал, выносимый на самостоятельное изучение: «Электрические автоколебания».
II. Работа в аудитории
1. Вопросы, выносимые на обсуждение:
а) Каков энергетический смысл понятия добротности?
2. Практический блок.
1. Отчет по самостоятельному изучению материала
2. Решение задач в аудитории
3. Решение задач домашнего задания
Цель: 1. Повторение теоретического материала темы занятий.
2. Практическое применение теоретического материала при решении задач.
Рассматриваемые вопросы
1. Получение переменной эдс.
2. Закон Ома для цепей переменного тока.
3. Резонанс в цепях переменного тока.
4. Мощность переменного тока.
I. Подготовка к занятию
1. Повторить теоретический материал:
1. Дать определение: переменного тока, квазистационарного тока, амплитудного значения силы тока, амплитудного значения напряжения, действующего значения силы тока, действующего значения напряжения, индуктивного сопротивления, емкостного сопротивления, реактивного сопротивления, полного сопротивления, резонанса, резонанса силы тока, резонанса напряжения, резонансной частоты, мгновенной мощности переменного тока, коэффициента мощности.
2. Записать формулы: связь между амплитудными значениями тока и напряжения и их действующими значениями, закон Ома для цепи, содержащей активное и индуктивное сопротивления, индуктивного сопротивления, закона Ома для цепи, содержащей активное и емкостное сопротивление, закон Ома для цепи, содержащей активное, индуктивное и емкостное сопротивление, резонансной частоты, средней мощности переменного тока, коэффициента мощности
Законы электролиза Фарадея
Законы электролиза Фарадея представляют собой количественные соотношения, основанные на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1836 году.
Данные законы определяют связь между количеством веществ, выделяющихся при электролизе и количеством электричества, которое прошло при этом через электролит. Законов Фарадея два. В научной литературе и в учебниках встречаются различные формулировки данных законов.
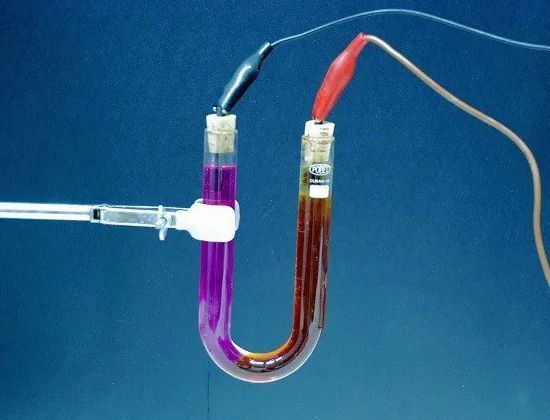
Электролиз — выделение из электролита входящих в его состав веществ при прохождении электрического тока. Так, например, при пропускании электрического тока через слегка подкисленную воду вода разлагается на составные части — газы (кислород и водород).
Количество выделившегося из электролита вещества пропорционально количеству протекшего через электролит электричества, т. е. произведению из силы тока на время, в течение которого этот ток протекал. Поэтому явление электролиза может служить для измерения силы тока и определения единицы силы тока.
Электролит — раствор и вообще сложная жидкость, проводящая электрический ток. В аккумуляторах электролитом служит раствор серной кислоты (в свинцовых) или раствор едкого калия, либо едкого натра (в железоникелевых). В гальванических элементах электролитом служат также растворы каких-либо химических соединений (нашатыря, медного купороса и т. п.).
Майкл Фарадей (1791 — 1867) — английский физик, основатель современного учения об электромагнитных явлениях. Начал свою трудовую жизнь учеником в переплетной мастерской. Получил только начальное образование, но самостоятельно изучая науки и работая лаборантом у химика Деви, стал великим ученым, одним из самых крупных физиков-экспериментаторов.
Фарардей открыл явление электромагнитной индукции, законы электролиза, разработал учение об электрических и магнитных полях и заложил основы современных представлений об электромагнитном поле. Он был первым ученым, у которого возникла мысль о колебательном, волновом характере электромагнитных явлений.
Первый закон электролиза Фарадея
Масса вещества, которое осядет на электроде при электролизе, прямо пропорциональна количеству электричества, переданного к этому электроду (прошедшего через электролит). Под количеством электричества понимается количество электрического заряда, который обычно измеряется в кулонах.
Второй закон электролиза Фарадея
Для определенного количества электричества (электрического заряда) масса химического элемента, который осядет на электроде при электролизе, прямо пропорциональна эквивалентной массе данного элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Одно и то же количество электричества приводит к выделению на электродах при электролизе эквивалентных масс различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл. Данная электрохимическая константа называется числом Фарадея.
Законы Фарадея в математической форме
m – масса вещества, осевшего на электроде ;
Q – величина полного электрического заряда в кулонах, который прошел при электролизе ;
F = 96485,33(83) Кл/моль — число Фарадея ;
M- молярная масса элемента в г/моль ;
z – валентное число ионов вещества (электронов на ион) ;
Применительно к первому закону электролиза Фарадея, M, F и z – константы, поэтому чем больше будет Q, тем больше окажется и m.
Применительно ко второму закону электролиза Фарадея, Q, F и z – константы, поэтому чем больше будет M/z, тем больше окажется m.
Для постоянного тока имеем
n – количество молей (количество вещества), выделенного на электроде: n = m/M.
t – полное время электролиза.
Пример применения законов Фарадея
Необходимо записать уравнение электрохимических процессов на катоде и аноде при электролизе водного раствора сульфата натрия при инертном аноде. Решение задачи будет таким. В растворе сульфат натрия станет диссоциировать по такой схеме:
Стандартный электродный потенциал в данной системе таков:
Это значительно более отрицательный уровень потенциала нежели для водородного электрода в нейтральной среде (-0,41 В). Поэтому на отрицательном электроде (катоде) начнет протекать электрохимическая диссоциация воды с выделением водорода и гидроксид-иона по следующей схеме:
А положительно заряженные ионы натрия, подходящие к отрицательно заряженному катоду, станут скапливаться возле катода, в прилегающей к нему части раствора.
На положительном электроде (аноде) будет протекать электрохимическое окисление воды, что приведет к выделению кислорода, по следующей схеме:
В данной системе стандартный электродный потенциал +1,23 В, что сильно ниже стандартного электродного потенциала, характерного для следующей системы:
Отрицательно заряженные сульфат-ионы, бегущие к положительно заряженному аноду, станут скапливаться в пространстве возле анода.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
Закон Фарадея для электролиза

Всего получено оценок: 176.
Всего получено оценок: 176.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.

Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.