Мрт нейродегенерация что это
Мрт нейродегенерация что это
1. Сокращения:
• Пантотенаткиназа-ассоциированная нейродегенерация (ПКАН)
• Инфантильная нейроаксональная дистрофия (ИНАД)
• Нейродегенерация с отложением железа в головном мозге (НОЖГМ)
2. Определение:
• Группа нейродегенеративных нарушений, характеризующаяся дистонией, паркинсонизмом и мышечной спастичностью:
о Вызывается мутациями в гене L-ферритина FTL1
о Все мутации приводят к аномальному накоплению Fe в базальных ганглиях
о Включает ПКАН, ИНАД, ацерулоплазминемию и т.д.:
— Тельца Леви, набухание аксонов, гиперфосфорилированные тау-белки при некоторых подтипах
1. Общие характеристики нейродегенерации с отложением железа в головном мозге (НОЖГМ):
• Лучший диагностический критерий:
о Снижение интенсивности сигнала на Т2-ВИ от бледных шаров (БШ)
• Локализация:
о ПКАН и ИНАД:
— БШ, черная субстанция (ЧС) ± зубчатые ядра (ЗЯ)
о Нейроферритинопатия и ацерулоплазминемия:
— БШ, ЧС, ЗЯ, кора, полосатое тело и таламус
2. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТс Т2-ВИ* (градиентноеэхо) или изображения, взвешенные по восприимчивости магнитного поля (SWI)
3. КТ признаки нейродегенерации с отложением железа в головном мозге (НОЖГМ):
• Бесконтрастная КТ:
о Атрофия больших полушарий и мозжечка при PANK2-негативной нейродегенерации с отложением железа в головном мозге (НОЖГМ)
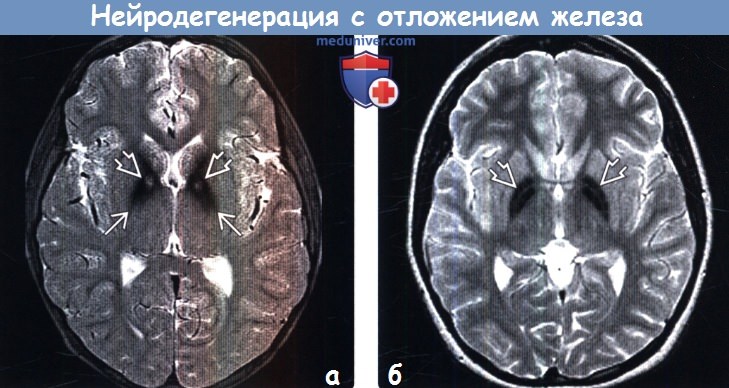
(б) МРТ, Т2-ВИ, аксиальный срез: определяется симметричное снижение интенсивности сигнала от бледных шаров. Симптом «глаза тигра» отсутствует, вследствие чего данное состояние не относится к ПКАН. Выявленные изменения характерны для нейродегенерации с отложением железа в головном мозге (НОЖГМ).
4. МРТ признаки нейродегенерации с отложением железа в головном мозге (НОЖГМ):
• Т2-ВИ:
о Гипоинтенсивные бледные шары с центральными гиперинтенсивными очагами в их медиальных отделах: симптом «глаза тигра»:
— Специфичный для классической ПКАН признак (мутации гена PANK2)
— На ранних стадиях заболевания могут наблюдаться только гиперинтенсивные на Т2-ВИ очаги
— Может также наблюдаться при нейроферритинопатии
о Снижение интенсивности сигнала на Т2-ВИ от БШ ± ЧС, ЗЯ, коры, полосатого тела и таламуса без симптома «глаза тигра» = другой вид НОЖГМ
о БШ в норме гипоинтенсивны на Т2-ВИ на аппарате с напряженностью магнитного поля ЗТ или выше
• Т2* GRE:
о Акцентирование снижения интенсивности сигнала, выявляемого на Т2-ВИ
• Изменения при диагностической визуализации не всегда коррелируют с клиническими проявлениями
в) Дифференциальная диагностика нейродегенерации с отложением железа в головном мозге (НОЖГМ):
1. Нормальные процессы отложения железа:
• Визуализируется на ЗТ
• Наблюдается при нормальном процессе старения
2. Болезни Паркинсона и Альцгеймера:
• Симптом «глаза тигра» отсутствует; пожилые пациенты
3. Рассеянный склероз (PC):
• Накопление железа в базальных ганглиях связано с PC
• Должны быть другие классические демиелинизирующие поражения
4. Поверхностный сидероз:
• Перегрузка железом вследствие переливания крови или рецидивирующих кровоизлияний в ЦНС
5. Гемохроматоз:
• Поражение печени и селезенки обычно происходит до поражения ЦНС
1. Общие характеристики нейродегенерации с отложением железа в головном мозге (НОЖГМ):
• Генетика:
о Аутосомно-рецессивные мутации генов PANK2, PLA2G6 и СР
о Аутосомно-доминантная мутация гена FTL
2. Макроскопические и хирургические особенности:
• Накопление железа, пигментация цвета ржавчины
3. Микроскопия:
• Накопление железа в БШ и ЧС, потеря нейронов, набухание аксонов (сфероиды)
• Симптом «глаза тигра» может отражать кистозную дегенерацию
• Наличие нейрофибриллярных сплетений и тел Леви предполагает схожий с болезнями Альцгеймера и Паркинсона патогенез
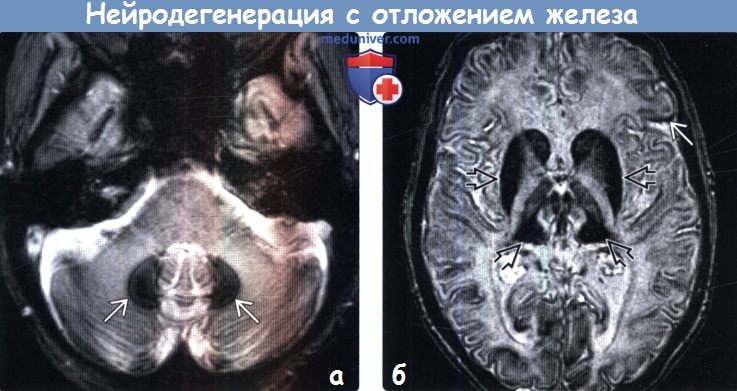
(б) МРТ, Т2*SWI, аксиальный срез: у того же пациента определяется диффузно распространенное линейное снижение интенсивности сигнала от коры с выраженным эффектом «выцветания» изображения в базальных ганглиях и таламусах, что обусловлено отложением железа. Также типично вовлечение в процесс и черной субстанции.
д) Клиническая картина:
1. Проявления нейродегенерации с отложением железа в головном мозге (НОЖГМ):
• Наиболее частые признаки/симптомы:
о Атаксия, дизартрия, дистония
о Дегенерация сетчатки и атрофия зрительных нервов
• Другие признаки/симптомы:
о Ацерулоплазминемия: дебют во взрослом возрасте с триадой, включающей диабет, дегенерацию сетчатки и двигательные нарушения
о Нейроферритинопатия: дебют во взрослом возрасте с хореей или дистонией
2. Демография:
• Возраст:
о ПКАН: классический вариант- возраст
Редактор: Искандер Милевски. Дата публикации: 25.4.2019
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму
Расписание приема МРТ:
ЦМРТ «Нарвский»
(812) 493-39-22
в четверг прием с 8-00 до 23-00
и воскресенье прием с 8-00 до 23-00
ул. Ивана Черных,29
МРТ аппарат 1,5 Тл
суббота :
ЦМРТ «Старая деревня»
(812) 493-39-22
прием 8-00 до 23-00
ул. Дибуновская,45
МРТ аппарат 1,5 Тл
Прием в “РНХИ им. проф. А.Л. Поленова” прекращен по техническим причинам и
перенесен в ЦМРТ
Нейродегенеративные заболевания и их диагностика
МРТ головного мозга. Демонстрация атрофии и нормы при цветовой обработке.
Под термином “нейродегенеративные заболевания” (НДЗ) определяется большая группа заболеваний преимущественно позднего возраста, для которых характерна медленно прогрессирующая гибель определенных групп нервных клеток и одновременно – постепенно нарастающая атрофия соответствующих отделов головного и/или спинного мозга. В основе развития этих заболеваний лежит нарушение метаболизма и изменение конформации клеточных белков с их последующим накоплением и агрегацией в определенных группах нейронов. При НДЗ страдают преимущественно нейроны и глиальные клетки базальных ганглиев и стволовых структур, вырабатывающие ацетилхолин, дофамин, серотонин.
Классификация делит НДЗ на 2 большие группы – спорадические и ирритативные.
Болезнь Альцгеймера – прогрессирующее нейродегенеративное заболевание, характеризующееся постепенным развитием деменции. Происхождение заболевания точно неизвестна. Биохимические изменения состоят в снижении активности холин-ацетил-трансферазы коры головного мозга и гиппокампов. Патологические проявления заключаются в образовании специфических амилоидных бляшек, нейрофибриллярных тяжей и реактивном глиозе. Развивается атрофия, захватывающая преимущественно кору вокруг Сильвиевых щелей и гиппокампы, с вторичным расширением желудочков, особенно височных рогов
Заболевание впервые описано Alois Alzheimer в 1907 году. Процесс напоминает естественное старение, но резко ускоренное. Начинается с нарушений памяти, затем потерянность, невозможность повседневного самообслуживания, повторяющиеся вопросы. Позже присоединяются глубокие нарушения психики, речи, потеря веса, судороги.
Частота составляет 0,51% для лиц в возрасте 70-74 лет с возрастным прогрессирующим увеличением частоты. Клинические проявления состоят в нарушении памяти, депрессии, поведенческих нарушениях и галлюцинациях. На поздних стадиях к психическим расстройствам добавляется экстрапирамидная симптоматика. Заболевание занимает 4 место по смертности. Диагноз ставится на основании клинического и нейрофизиологического обследования, а также нейровизуализации. Типичные проявления на КТ состоят в диффузной атрофии (особенно,височных долей), вторичном расширении борозд и желудочков. Чувствительность КТ (без измерения объемов) в сравнении с нормальной возрастной группой около 80%, специфичность около 70%. Измерение объемов гиппокампов при выполнении МРТ с тонкими срезами повышает точность до 85%.
МРТ головного мозга. Т2-взвешенная сагиттальная МРТ. Болезнь Пика. Цветовая обработка изображения.
МРТ головного мозга служит метода выбора оценки структурных изменений. Атрофические изменения выражены во всём медиобазальном отделе височной доли. Чувствительность и специфичность МРТ при начальной деменции около 80%. Измерение объемов гиппокампов и амигдалы повышает точность до до 85%.
МРТ головного мозга. Т1-взвешенная корональная МРТ. Диффузная атрофия при болезни Альцгеймера.
Дифференциальную диагностику при МРТ головного мозга надо проводить с болезнью Паркинсона, мультиинфарктной деменцией и лобнотеменной деменцией (болезнь Пика).
В этих же зонах отмечается гипоперфузия и снижение активации при фМРТ. Кроме МРТ при исследовании болезни Альцгеймера важное значение имеет ПЭТ с [ 18 F] флюоро-2-деоксиглюказой (FDG). Гипометаболизм хорошо коррелирует с тяжестью заболевания и предсказывает его развитие.
При деменции, связанной с болезнью Паркинсона при МРТ головного мозга отмечается снижение толщины коры в проекции парагиппокампальной части левой средней затылочно-височной извилины и уменьшение объема левого нижнего продольного пучка. Уменьшение толщины коры левой парагиппокампальной зоны связано с высоким риском депрессии. Отмечено, что дневная сонливость коррелирует с уменьшением толщины коры фузиформной зоны, определяемое при МРТ.
Для прослеживания динамики и прогнозирования также прибегают к различным измерениям при МРТ головного мозга:
Прогрессирующий надъядерный паралич проявляется в виде нарушения взора вверх, экстрапирамидной симптоматики и умственных нарушениях. Заболевание развивается у лиц около 60 лет. Этиология неизвестна, почти все случаи спорадические. Частота 1-1,5 случаев на 100 тыс. населения. Заболевание характеризуется патологическим скопление в головном мозге тау-протеина. При МРТ головного мозга наблюдается диффузная атрофия, причем на сагиттальных Т1-взвешенных МРТ отмечается характерный симптом “пингвина”. Атрофические изменения моста и среднего мозга приводят к расширению водопровода и III желудочка, контур которых напоминает очертания пингвина.
МРТ головного мозга. Т12-взвешенная сагиттальная МРТ. Прогрессирующий надъядерный паралич. Симптом “пингвина”.
Центральный понтинный миелиноз (осмотическая деменция) представляет собой приобретенное метаболическое расстройство. Чаще встречается у алкоголиков. Гипонатрийемия приводит к демиелинизации, видимой при МРТ. Центральный понтинный миелиноз часто сопровождается экстрацентральным, когда есть поражение выше ствола. Клинические проявления сводятся к заторможенности (вплоть до летаргии), спастическому тетрапарезу и поражению нижних черепных нервов.
МРТ головного мозга. Т2-взвешенная аксиальная МРТ. Центральный понтинный миелиноз,
Болезнь Бинсвангера (субкортикальная атеросклеротическая энцефалопатия, деменция мелких сосудов). Это состояние, связанное с множественными инфарктами мелких ветвей, что при МРТ головного мозга видно как лакунарные ОНМК. Заболевание постепенно прогрессирует. Вариантом болезни Бинсвангера можно считать наследуюмую семейную артериопатическую лейкоэнцефалопатию.
МРТ головного мозга. Т2-взвешенная МРТ типа FLAIR. Болезнь Бинсвангера.
Болезнь Гентингтона относится к наследуемым заболеваниям, проявляется в среднем возрасте и быстро прогрессирует. В клинической картине преобладают хореоатетоз и деменция.
МРТ головного мозга. Т1-взвешенная корональная МРТ. Болезнь Гентингтона.
Болезнь Фара очень редкое наследственное заболевание, проявляющееся в кальцификации базальных ганглиев и зубчатого ядра. На Т2-зависимых МРТ ядра резко гипоинтенсивны, что соответствует кальцинатам, хорошо видимым на КТ. Нередко в области зрительных бугров обнаруживаются мелкие гиперинтенсивные очажки.
МРТ и КТ головного мозга в аксиальной плоскости. Болезнь Фара.
Об МРТ в СПб при нейродегенераторных заболеваниях можно также читать на странице нашего другого сайта. Исследование мы выполняем в закрытом аппарате, но можно и на открытом МРТ. МРТ СПб позволяет выбирать место МРТ, но в этом случае мы рекомендуем Вам обследоваться у нас.
Нейродегенеративные заболевания
Лептин и инсулин являются ключевыми анорексигенными гормонами, продуцируемыми адипоцитами при накоплении жировых запасов и эндокринной поджелудочной железы соответственно. Грелин вырабатывается желудочно-кишечным трактом и стимулирует процесс потребления пищи. Множество и других периферических гормонов участвует в регуляции метаболизма, и большинство из них сигнализирует о своей активности гипоталамусу. Более того, гипоталамические нейроны также фиксируют изменения в питательных веществах, таких как глюкоза или жирные кислоты, и способны модифицировать метаболический гомеостаз.
Причины потери веса и аномального питания в течение клинической фазы AD остаются неизвестными ( метаболические изменения могут быть связаны с вышеупомянутыми поражениями гипоталамуса). Некоторые исследования подтверждают участие передачи сигналов лептина в изменениях энергетического гомеостаза при AD. Было обнаружено, что пептиды Aβ способны изменять реакцию нейронов NPU дугообразного ядра на лептин. В нескольких исследованиях также показано, что пациенты с болезнью Альцгеймера могут иметь резистентность к инсулину, и, следовательно, маловероятно, что изменения массы тела у пациентов с АD обусловлены увеличением анорексигенного действия инсулина. Кроме того, поражения дугообразного ядра благоприятствуют развитию AD-подобных поражений в экспериментальных моделях.
Помимо потери веса тела, убедительные доказательства на протяжении многих лет поддерживают взаимосвязи между изменениями гомеостаза глюкозы и патогенезом AD. Как указывалось выше, ожирение, резистентность к инсулину и диабет являются значимыми факторами риска развития болезни Альцгеймера. Экспериментальные исследования подтверждают связь между такими метаболическими нарушениями и AD с нарушенной амилоидной или тау-патологией, усиливающейся после развития ожирения и резистентности к инсулину в трансгенных моделях AD амилоидогенеза или тау-патологии. В некоторых исследованиях утверждается, что периферические нарушения склонны поддерживать устойчивость мозга к инсулину и сами по себе достаточны для развития развития тау-патологии и амилоидогенеза. Патологические изменения также могут быть связаны с гипотермией. Интересно отметить, что риск развития диабета был увеличен у пациентов с AD. Было показано, что мозг пациентов с болезнью Альцгеймера проявляет резистентность к инсулину, примером чего является увеличение кортикального фосфорилирования сайтов ингибирования серина IRS-1, которое коррелирует с когнитивными нарушениями. Это наблюдение согласуется с известной способностью передачи сигналов инсулина для содействия процессов пластичности и памяти, которые могут иметь отношение к изменениям в коре головного мозга или улучшение памяти, наблюдаемое у людей после введения интраназального инсулина. Потенциальное появление устойчивости к инсулину мозга при развитии нарушений гомеостаза глюкозы у пациентов с болезнью Альцгйемера также подтверждается известной ролью передачи сигналов инсулина в процессах регуляции энергетического метаболизма. Происхождение резистентности к инсулину мозга у пациентов с АD, по-видимому, связано с патологией Aβ и tau. С одной стороны, интра церебровентрикулярная инфузия олигомеров Aβ у мышей является достаточной для того, чтобы вызвать непереносимость периферической глюкозы с помощью механизма, функционирующего на основе гипоталамуса. С другой стороны, потеря функции tau, которая, как ожидается, будет сопровождаться последующим гиперфосфорилированием и агрегацией тау, снижает чувствительность к инсулину и связана с измененным гомеостазом глюкозы. Это соответствует увеличению ингибирования IRS-1 в мозге пациентов с чистыми тауопатиями. Было показано, что олигомеры Aβ способствуют интернализации инсулиновых рецепторов, а также активации путей JNK, PKR и TNFα, которые в свою очередь ингибируя функцию IRS-1. Кроме того, было предложено стимулировать функцию IRS-1, а также продукцию PIP3, способствуя передаче сигналов инсулина. Примечательно, что недавние данные показали, что ApoE4 способствует нейронной резистентности к инсулину и может синергически действовать вместе с поражениями.
Метаболические изменения, такие как потеря веса или резистентность к инсулину, были зафиксированы в большинстве случаев нейродегенеративных заболеваний. Во многих случаях эти изменения были причинно связаны с по крайней мере частью неврологического фенотипа и показали, что они способствуют прогрессированию болезни.
Нейродегенеративные заболевания
1. Что включает группа нейродегенеративных заболеваний?
Термин «нейродегенеративные заболевания» охватывает всю совокупность расстройств, обусловленных дегенеративными изменениями элементов нервной системы – мозга и проводящих нервов. Для любой патологии этого типа свойственна тесная связь органических и функциональных нарушений, причём характер последних определяется локализацией патологического процесса и степенью атрофии тканей тех или иных отделов мозга.
2. Причины нейродегенеративных заболеваний и факторы риска
3. Диагностика и клиническая картина при нейродегенеративных заболеваниях
На начальных этапах различные НДЗ могут иметь схожую клиническую картину. Диагностика должна основываться не только на сборе анамнестических данных и динамическом наблюдении, а также затрагивать генетические аспекты. Дифференцировать конкретный диагноз помогают специальные тесты. Для исключения опухолевого, травматического, сосудистого генеза начавшихся нарушений применяются инструментальные методы диагностики.
Клинические проявления нейродегенеративных заболеваний зависят от стадии и определённого вида патологии. Чаще всего симптомокомплекс включает двигательные нарушения (изменение походки, тремор, акинезию и ригидность). Часто по мере прогрессирования болезни развивается постуральная неустойчивость. Возможны гиперкинезы, самопроизвольные или насильственные движения.
В уровне интеллекта имеет место деменция, ослабление памяти, мыслительной деятельности, нарушаются контакты с окружающими. Как следствие – больной человек постепенно самоизолируется. Для постановки диагноза часто показательным является факт первичности нарушений двигательной активности или интеллекта. Сохранной остаётся мышечная активность на начальных стадиях болезни Альцгеймера, при сосудистой деменции, болезни Пика. Тогда как болезнь Паркинсона, Хорея Гентингтона изначально проявляются изменениями в походке, тремором, гиперкинезами.
4. Течение болезни и уход за больными НДЗ
Неуклонное прогрессирование заболеваний, связанных с нейродегенерацией, приводит таких больных к инвалидности. Они подвержены не только расстройствам интеллекта, памяти и мышления, но и беззащитны перед нарастающими двигательными нарушениями. Утрата здоровой координации движений нередко приводит к травмам. Вегетативная нервная система под «руководством» больного мозга начинает сбоить, приводя к расстройствам пищеварения, сухости кожи, запорам, нарушению мочеиспускания.
Дееспособность больных нейродегенеративными заболеваниями также всегда является спорным вопросом. Многие из них способны на асоциальные поступки и представляют угрозу для самих себя и окружающих.
Лечение НДЗ всегда неспецифическое и направлено на оказание симптоматической помощи, осуществление должного ухода за больным, сохранение как можно более длительно способности пациента взаимодействовать с теми, кто берёт его под свою опеку. На более тяжёлых стадиях основные задачи – кормление, гигиена, профилактика инфекций и травм, а также пролежней и иных осложнений.
Ранняя диагностика нейродегенеративных заболеваний
С.Н. Иллариошкин
доктор медицинских наук, профессор, заместитель директора по научной работе
ГУ Научный центр неврологии РАМН
К сожалению, для большинства нейродегенеративных болезней отсутствуют радикальные методы лечения, которые позволили бы полностью остановить патологический процесс и тем более обратить его вспять. Возможности симптоматической помощи таким пациентам ограничены, причем в поздних стадиях лечение особенно затруднено и нередко сопровождается многочисленными осложнениями, которые нередко могут быть даже «хуже» самой болезни. Например, применение в поздней стадии болезни Паркинсона лекарств, восполняющих дефицит двигательных импульсов в мозгу, может из-за патологической реактивности нервных клеток привести к превращению малоподвижного пациента в «танцующего маньяка», не способного ни на минуту остановиться (это чревато полным истощением, падениями, травмами и т.п.).
Где же выход? Как общество может эффективно противостоять этим, в буквальном смысле слова, «болезням века»?
Выявление у человека из группы риска одного или нескольких вышеуказанных маркеров нейродегенеративного процесса позволяет с высокой степенью вероятности (которую можно даже рассчитать специальными методами) диагностировать наличие латентной стадии болезни и поставить вопрос о проведении ранней терапии, направленной на предотвращение прогрессирования (нейропротекция). По существующим прогнозам, новые препараты с доказанным нейропротективным действием могут появиться в арсенале врачей-неврологов уже в самые ближайшие годы, и мы обязательно затронем эту проблему в будущих номерах журнала.