Мышечная дистрофия что это такое и как лечить
Что такое мышечная дистрофия
Мышечная дистрофия – это целый класс наследственных заболеваний, которые со временем приводят к ослаблению мышц тела. Сегодня болезнь неизлечима. Но некоторые физические и медицинские процедуры способны замедлить прогрессирование и улучшить состояние больного. При подозрении на наличие болезни рекомендуется обратиться к неврологу.
Формы мышечной дистрофии
Мышечная дистрофия характеризуется прогрессирующей симметричной атрофией мышц. Болезнь во всех ее формах и проявлениях протекает долго. Слабость мышц в этом случае обусловлена отсутствием важного белка – дистрофина. Он важен для человека, так как соединяет скелет мышечных волокон с внеклеточным матриксом.
Отсутствие дистрофина вызывает постоянную усталость, нарушения походки, проблемы с глотанием и координацией движений. Всего существует более 30 форм заболевания. Они отличаются характером, степенью тяжести, симптоматикой.
9 самых распространенных из них:
Примечательно, что это наследственное заболевание, которое может проявиться в любом возрасте. Чаще всего первые симптомы обнаруживаются на профилактических осмотрах у специалистов еще в раннем детстве. По статистике от патологии чаще страдают мальчики, чем девочки.
Прогноз для таких пациентов зависит от многих факторов. Кто-то живет с болезнью годами, лишь поддерживая свое состояние и замедляя прогрессирование атрофии мышц. Другие же быстро теряют способность вести привычный образ жизни, не могут самостоятельно ходить и часто нуждаются в инвалидном кресле.
Симптомы и причины мышечной дистрофии
Причины мышечной дистрофии кроются в хромосомной мутации. Поражается Х-хромосома, но каждая форма заболевания имеет свои особенности и характеризуется уникальным набором мутировавших генов. При этом все они способствуют снижению или же полному прекращению синтеза дистрофина – белка, необходимого мышцам для нормального функционирования.
Именно этот белок отвечает за их рост и восстановление, хотя его содержание очень мало – всего 0,002 % от общего количества белков в мышцах. Чем меньше количество дистрофина, тем больше прогрессирует болезнь и выражена симптоматика.
Среди основных симптомов, сопровождающих все формы патологии, стоит отметить такие признаки:
Если вы обнаружили у себя перечисленные выше симптому, записывайтесь на прием к неврологу в медицинский центр «Юнона».
Диагностика и лечение
При наличии симптоматики мышечной дистрофии больного отправляют на прием к врачу-неврологу. Специалист именно этого профиля подбирает способы и методы диагностики болезни, схему поддерживающей и восстанавливающей терапии.
Помимо личной беседы и изучения анамнеза, могут потребоваться такие диагностические мероприятия:
Кроме того, может потребоваться сдача анализа крови, мочи, аппаратное сканирование с целью исключить другие заболевания со схожей симптоматикой.
На сегодняшний день нет эффективных методов лечения этого заболевания. Невролог и другие специалисты помогут подобрать методы и процедуры, которые замедлят прогрессирования болезни, но не устранят ее полностью. Лечение подбирается симптоматическое. Оно может включать в себя:
Кроме того, могут потребоваться медицинские процедуры, в том числе операции на сердце и позвоночнике, вспомогательная вентиляция легких. А физиотерапия и ЛФК помогут укрепить мышцы конечностей, сохранить как можно дольше возможность ходить и двигаться.
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Принцип генной терапии миодистрофии Дюшенна/Беккера. Миодистрофию Дюшенна (МДД) вызывают мутации гена дистрофина (DMD), приводящие к сдвигу рамки считывания, а более мягкую миодистрофию Беккера (МДБ) — мутации без смещения рамки считывания. Лечения этой болезни пока нет. Генная терапия поможет улучшить или даже восстановить функции мышц.
Автор
Редакторы
Мышечная дистрофия Дюшенна — тяжелейшее Х-связанное заболевание, эффективного лечения которого до сих пор нет. В одном из последних номеров Science вышли целых три статьи об успешном тестировании на мышиных моделях технологии CRISPR/Cas9 для лечения этой болезни. Может быть, у этого подхода есть шанс добраться и до клиник?
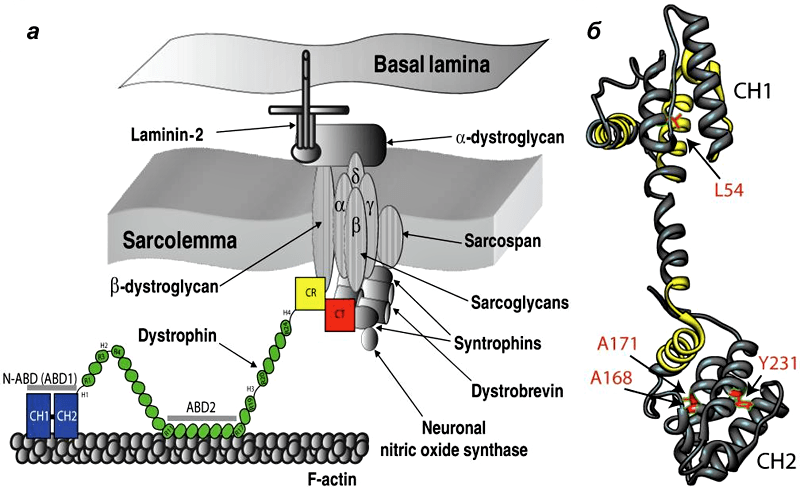
Дистрофин находится на внутриклеточной поверхности сарколеммы вдоль всей длины мышечных волокон и входит в состав дистрофин-ассоциированного гликопротеинового комплекса (ДАГК, DGC). Он связывается одним концом с F-актином цитоскелета, а другим — с β-дистрогликаном, что стабилизирует волокна во время сокращения. Ген дистрофина — один из самых длинных у человека.
Излечивать мышечную дистрофию Дюшенна пока не умеют, а сегодняшняя терапия направлена на замедление прогрессирования болезни и лечение осложнений [4], [5]. «Золотой стандарт» — это кортикостероиды, которые были предложены в качестве лечения еще несколько десятилетий назад. Однако их применение вызывает множество побочных эффектов.
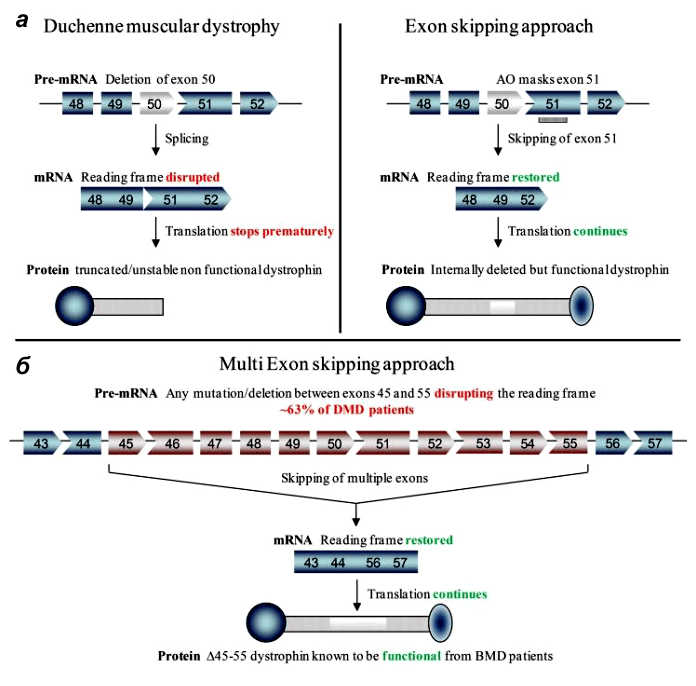
Неудивительно, что многие группы генетиков и молекулярщиков занимаются разработкой пре- и постнатального лечения миодистрофии Дюшенна. Болезнь в основном изучают на различных линиях мышей. В одном из последних номеров Science опубликовали сразу три независимых работы по методам лечения мышечной дистрофии Дюшенна [6–8]. Исследовательские группы возглавили Эрик Олсон (Eric Olson) из Техасского университета, Эми Уаджерс (Amy Wagers) из Гарвардского университета и Чарльз Герсбах (Charles Gersbach) из Университета Дьюка. Все группы для восстановления функции мышц использовали методику пропуска экзонов, при которой один или несколько экзонов удаляются из мРНК (рис. 2). В таком случае белок получается короче, но всё же может выполнять свою поддерживающую и заякоривающую функции в мышечном волокне, а «досадное обстоятельство» — лишний стоп-кодон — тоже оказывается «пропущенным».
Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD присутствуют мутации, нарушающие рамку считывания при синтезе белка. Например, при делеции экзона 50 появляется «внерамочная» мРНК, что приводит к синтезу усеченного нефункционального или нестабильного дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б — Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов 45–55, мутации которых встречаются примерно у 63% пациентов, то образовавшийся короткий дистрофин приведёт к трансформации стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип.
У стратегии удаления экзонов есть даже преимущества перед воссозданием полной длины гена: ее проще разработать, чем восстановить индивидуальные делеции каждого пациента [7].
Для вырезания «лишних» нуклеотидных последовательностей исследователи воспользовались технологией редактирования генома CRISPR (clustered regularly interspaced short palindromic repeats) / Cas9 (CRISPR-associated protein 9) [9], которую, между прочим, только что разрешили применить в опытах на эмбрионах одному лондонскому институту [10].
Конкурирующие лаборатории: кто первым воплотит технологию в терапию для человека?
Ученые трех лабораторий успешно применили технологию пропуска экзонов in vivo на стандартном объекте — мышах — и показали, что их метод помогает восстановить рамку считывания и частично восстановить синтез дистрофина. Поскольку даже невысокий его уровень (3–15% от нормального) приносит терапевтическую пользу, результаты работ можно назвать успешными.
Группа Эрика Олсона уже не в первый раз использует метод CRISPR/Cas9 в своих работах по мышечной дистрофии Дюшенна. В 2014 году ученые исправили мутацию в зародышевой линии мышей и предотвратили развитие болезни. Однако, поскольку пренатальное редактирование генома на человеческих эмбрионах (пока?) запрещено, исследователям пришлось придумать способ постнатального применения технологии.
В их последней работе для доставки необходимых для редактирования компонентов в ткани использовался аденоассоциированный вирус-9 (AAV9, adeno-associated virus-9) [6]. Исследователи испытали несколько способов введения AAV9 в различные дни после рождения мышат. Во всех случаях экспрессия гена дистрофина в сердечной и скелетных мышцах восстановилась, но в разной степени. Более того, продукция белка увеличивалась с 3 до 12 недель после инъекций, а через 4 недели после инъекций улучшилась функция скелетных мышц. «Сейчас задача для исследователей из центра Уэллстоун заключается в том, чтобы перенести открытия с мышиной модели на пациентов с миодистрофией», — говорит Прадип Маммен (Pradeep Mammen), содиректор центра Уэллстоун.
Группа Эми Уаджерс провела во многом похожий эксперимент [8]. После множества подготовительных этапов работы по редактированию генома и пропуску экзона на клетках и животных их опыт тоже увенчался успехом: программируемые CRISPR-комплексы в составе аденоассоциированного вируса (AAV) были доставлены с помощью локального и системного введения к дифференцированным скелетным волокнам, кардиомиоцитам и сателлитным мышечным клеткам новорожденных и взрослых мышей. Если редактирование направлено только на мышечные волокна, то эффект со временем может сойти на нет. Однако, как отмечает Уаджерс, редактирование генов в сателлитных клетках может обеспечить гораздо более длительный результат. Оно способно привести к созданию пула регенеративных клеток, несущих отредактированный ген дистрофина, и в результате обычной репарации мышц отредактированный ген окажется и в мышечных волокнах.
Наконец, как все уже догадались, ученые под руководством Чарльза Герсбаха тоже обнаружили терапевтический эффект применения AAV-CRISPR/Cas9 в мышиной модели [7]. Внутрибрюшинное введение вирусного вектора новорожденным мышам привело к восстановлению синтеза дистрофина в абдоминальных мышцах (мышцах живота), диафрагме и сердце через семь недель после инъекции. Как отмечают авторы, терапия сердечной и легочной мышц крайне важна, поскольку именно их отказ зачастую приводит к смерти пациентов с болезнью Дюшенна. Внутривенное введение AAV-векторов шестинедельным мышам тоже привело к значительному восстановлению продукции дистрофина в сердечной мышце. «Остается еще много работы по переделке [технологии] в терапию для человека и подтверждения ее безопасности, — говорит Герсбах. — Но результаты наших первых экспериментов уже весьма воодушевляющие». Группа собирается оптимизировать систему доставки и оценивать эффективность и безопасность стратегии на более крупных животных (рис. 3). Какая же из трех лабораторий обгонит других и первой сможет провести испытания на человеке?
Терапия миодистрофии Дюшенна: старые и новые подходы
По словам Олсона, главное отличие новой стратегии с использованием вектора, вмещающего в себя компоненты для редактирования генома, от других терапевтических методов в том, что она устраняет причину болезни. А какие еще подходы разрабатывают ученые?
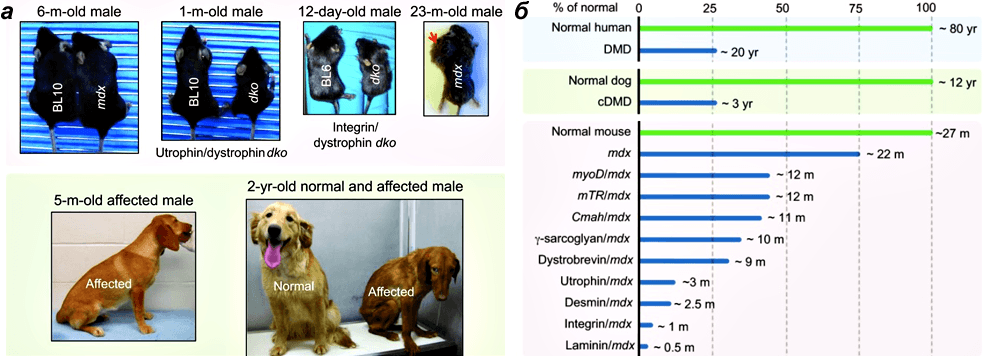
Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху: у мышей mdx симптомы проявляются только в старости, и они склонны к образованию рабдомиосарком — опухолей мышечного происхождения. Размер мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей.
Один из многообещающих подходов — это клеточная терапия. Хотя опыты с внутримышечной инъекцией миобластов от здоровых доноров провалились, технологии с использованием стволовых клеток и индуцированных плюрипотентных стволовых клеток (ИПСК) пока успешно испытываются на моделях не только миодистрофии Дюшенна, но и болезни Альцгеймера, Паркинсона, Хантингтона, спинальной мышечной атрофии, бокового амиотрофического склероза, аутизма и шизофрении [14–16]. Например, в 2013 году исследователи из Бостонской детской больницы (Boston Children’s Hospital’s Stem Cell Program) с помощью смеси трех малых молекул (форсколина, основного фактора роста фибробластов bFGF и ингибитора гликогенсинтазы киназы-3) перепрограммировали ИПСК из кожи пациентов с миодистрофией Дюшенна в мышечные клетки, которые затем успешно прижились у мышей. Сейчас из ИПСК получены кардиомиобласты и нейроны [2].
Другие исследования показывают, что восстановление нормального уровня синтеза оксида азота (NO), который снижается у больных из-за нарушения активности NO-синтазы (nNOS), ослабляет воспаление, повышает активность собственных стволовых клеток и реконструирует морфологию и функции скелетных мышц [3].
Уже в фазе II клинических испытаний находится препарат Givinostat — ингибитор гистондеацетилаз, который замедляет прогрессирование болезни в мышиной модели.
Миопатия
Миопатия — хронические прогрессирующие нервно-мышечные заболевания, характеризующиеся первичным поражением мышц. Это группа мышечных заболеваний, которые не связаны с нарушением нервной проводимости или нервно-мышечных соединений. Почему развивается миопатия, каким образом ее диагностировать и лечить?
Классификация миопатий
Миопатии разделяют на две большие подгруппы — первичные и приобретенные.
Дефектный ген может наследоваться рецессивно или доминантно, иногда он наследуется сцеплено с Х-хромосомой.
Приобретенные миопатии разделяют на воспалительные (дерматомиозит, полимиозит), инфекционные, метаболическое, эндокринные, лекарственные, токсические. Они развиваются на фоне сопутствующих заболеваний и патологических состояний, например:
Причины заболевания
Заболевание, в зависимости от типа, имеет различные причины.
Инфекционными причинами могут становиться вирусы, бактерии и другие возбудители, например:
Лекарственные миопатии могут развиваться на фоне приема ряда препаратов:
Как проявляется болезнь?
При первичных формах первые признаки заболевания проявляются обычно в детском или юношеском возрасте. Типичный симптом, по которому можно заподозрить заболевание у ребенка, — мышечная слабость. Этот признак характерен для всех форм. Обычно слабость носит симметричный характер, то есть наблюдается в симметричных мышцах. На начальных стадиях слабость может быть незначительной, но постепенно ее выраженность увеличивается.
Отдельные виды миопатий: клиническая картина и особенности
Дистальная миопатия Миоши — самая распространенная дистальная форма, хотя точное число больных пока установить невозможно. Имеет аутосомный тип наследования. Основные клинические признаки — прогрессирующая мышечная слабость, атрофия отдельных мышц. Чаще заболевание проявляется в подростковом возрасте, изредка — после 40 лет. В первую очередь поражаются стопы, голени.
Как диагностировать миопатию?
Чтобы установить диагноз, одной клинической картины недостаточно, однако появление характерных признаков заболевания должно стать поводом для глубокого обследования пациента.
Кроме того, обследование включает 3 :
Лечение миопатий
Немедикаментозное лечение включает целый ряд терапевтических методик, направленных на улучшение качества жизни, социализации. К ним относится лечебная физкультура, физиотерапия, психологическая реабилитация, массаж, другие.
Прогноз наследственных миопатий может быть различным. Крайне важна своевременная диагностика.
Миопатия. Амиотрофия. Мышечная дистрофия. Миодистрофия.
Миопатии (миодистрофия, мышечная дистрофия) и амиотрофии (спинальная, невральная) – группа наследственных болезней, проявляющихся постепенной атрофией и дегенерацией мышц. Известно несколько форм болезни: Дюшенна, Беккера, Эрба (тазо-плечевая), Ландузи-Дежерина (плече-лопаточно-лицевая), Кугельберга-Веландер, Шарко-Мари, Арана-Дюшенна и другие.
Диагноз – миопатия (амиотрофия). Что делать?
Сегодня панацеи от наследственных мышечных дистрофий не существует. Однако правильное лечение позволяет ощутимо затормозить атрофию мышц и увеличить регенерацию и рост новой мышечной ткани, и даже вернуть некоторые утраченные возможности. Лечение миопатии и амиотрофии требует повседневного выполнения ряда медицинских процедур, поэтому мы не только оказываем лечебную помощь, но и обучаем родственников пациентов и/или самих пациентов самостоятельному выполнению необходимых процедур.
Лечение в нашей клинике включает в себя следующее:
По каждому из перечисленных пунктов проводится подробное обучение. Мы настаиваем на обучении самостоятельному выполнению процедур, т.к. стремимся сделать регулярное и достаточное по объему лечение еще и доступным и дешевым.
Лечение миопатии и амиотрофии – лекарства
Лекарства не излечивают дистрофию мышц, при этом они способны стимулировать регенерацию и рост мышечной ткани. В основном лекарственные препараты дают три эффекта:
Цели медикаментозного лечения:
Универсального рецепта медикаментозного лечения при миопатии и амиотрофии не существует. Лечение приходится подбирать исходя из возраста, пола, типа миопатии, наличия сопутствующих заболеваний. Продолжительность курса – не менее трех месяцев.
Питание при атрофии мышц
Миопатия и амиотрофия приводят к потере мышечной ткани. Задача пациента и доктора – успевать эту потерю восстанавливать. Известно, что для роста мышц требуется белок, но не все знают какой, в каком количестве и режиме. Мы рекомендуем принимать питательные смеси в виде аминокислот, с добавлением витаминов и L-карнитина. Дозы рассчитываем с учетом веса, возраста пациента и состояния желудочно-кишечного тракта.
Нередко белки по какой-то причине не усваиваются из желудочно-кишечного тракта и прием белкового питания не приводит ни к чему, кроме проблем с пищеварением. Информацию о качестве усвоения белков можно получить в результате копрологического исследования кала. Поскольку питание – важная составляющая лечения миопатии, мы в этих случаях обязательно лечим причину нарушения усвоения белков (снижение экскреторной функции поджелудочной железы, воспаление слизистой кишечника и т.п.).
Физиотерапия
В результате длительного течения болезни на месте погибших мышечных волокон образуются включения жировой и фиброзной (рубцовой) ткани, которые препятствуют работе мышц и даже могут вызывать мышечную боль. Для рассасывания этих включений и применяется физиотерапия.
Кроме того, при болезнях мышц могут формироваться контрактуры – снижение объема движений в суставах и мышцах. Здесь физиотерапия – так же один из основных методов лечения.
В нашей клинике применяются, в основном, 2 метода физиотерапии: обертывания и электрофорез с ферментными (протеолитическими) препаратами. Протеолитики оказывают мощное рассасывающее действие на фиброзную и поврежденную ткань, не затрагивая здоровых мышечных волокон. Для обертываний используется состав на основе натуральной желчи, а для электрофореза – на основе папаина.
Электростимуляция мышц применяется лишь в некоторых случаях, когда отдельные мышцы настолько слабы, что невозможно выполнение даже элементарных движений. Электростимулятор заставляет мышцы сокращаться независимо от наличия/отсутствия произвольного усилия пациента.
Мы выполняем физиолечение в клинике и обучаем пациентов самостоятельному выполнению физиопроцедур в домашних условиях. Стоимость простого аппарата для электрофореза в магазинах медтехники 3700-4000 рублей, а электромиостимулятора от 3000 рублей.
Массаж при миопатии и амиотрофии
Стандартные методики массажа не вполне подходят для лечения миопатии и амиотрофии. Кроме того, эффект массажа напрямую зависит от правильности его выполнения. К сожалению, нам регулярно приходится видеть пациентов после курса массажа с абсолютно непроработанными при массаже проблемными мышцами.
Правильный массаж начинается с определения неэластичных, уплотненных, ослабленных участков мышц. Именно на эти участки и должны быть направлены основные усилия при массаже. Причем требуется сочетание тонизирующего массажа на ослабленные участки с расслабляющим, растягивающим и рассасывающим на уплотненные участки мышц.
Если имеется слабость дыхательной мускулатуры, выполняется массаж грудной клетки для облегчения дыхательных движений.
Мы выполняем массаж в клинике и обучаем родственников пациентов самостоятельному выполнению массажа в домашних условиях. Если пациент находится на лечении без сопровождающих, обучаем самомассажу.
Гимнастика при миопатии и амиотрофии
Гимнастика при нервно-мышечных болезнях имеет свои особенности. Дело в том, что при слабости той или иной мышцы, вместо нее в движение могут включаться другие (мышцы синергисты и др.). В результате возникает неправильный паттерн движения, который не только не приводит к желаемому эффекту, но и может повредить другие мышцы, суставы или межпозвонковые диски. По этой причине гимнастика при миопатии и амиотрофии основана на изолированном включении отдельных мышц.
До сих пор не удалось создать единую систему гимнастики для миопатов, т.к. тонусно-силовой дисбаланс мышц у каждого пациента различен. Упражнения приходится подбирать и дозировать индивидуально каждому пациенту.
В дальнейшем гимнастика выполняется в домашних условиях в паре с помощником или самостоятельно. Мы обучаем выполнению гимнастики в ходе лечения.
Психотерапия
Начало клинических проявлений и последующие ухудшения, как правило, провоцируются психическим стрессом. Более того, тяжелое заболевание мышц, само по себе, серьезный психический стресс. На фоне болезни часто развиваются вторичные депрессии с апатией и нежеланием заниматься своим здоровьем. А это ведет к прогрессированию болезни и возможной гибели пациента.
Если это нужно, мы проводим нашим пациентам курс психотерапевтического лечения. Наши пациенты становятся более устойчивыми к психическим раздражителям, становятся активнее, позитивно относятся к лечению, и это незамедлительно сказывается на работе мышц.
Кроме того, мы обучаем пациентов специальным психотехникам для работы с собственными мышцами.
При наличии признаков депрессии возможно назначение современных антидепрессантов (селективные ингибиторы обратного захвата серотонина, такие как Ципралекс, Флуоксетин и др.). Эти антидепрессанты не снижают, а повышают активность пациента и настроение, не вызывают мышечной слабости.
Сопутствующие заболевания
Болезни мышц могут прогрессировать очень быстро, если их течение осложняют другие заболевания, уменьшающие подвижность. Поэтому мы обязательно лечим сопутствующие заболевания.
Основные заболевания, способные ухудшать самочувствие:
Нейропсихологическое развитие детей с нервно-мышечной патологией
В мышцах располагается огромное количество рецепторов, передающих в мозг информацию о работе мышц. Поток импульсов из этих рецепторов поступает в мозг и участвует в формировании высших корковых функций, таких как письмо, чтение, счет, логика. При миопатии и амиотрофии эти рецепторы не обеспечивают правильной импульсации, что снижает темп развития интеллекта ребенка.
Поэтому в нашей клинике уделяется большое внимание упражнениям для развития интеллекта. Требуются регулярные занятия в течение длительного времени, поэтому детский психолог обучает родителей наших маленьких пациентов самостоятельному проведению развивающих занятий.
Лечение миопатии и амиотрофии – наша работа. Клиника “Эхинацея”
Мы предлагаем Вам пройти лечение и обучение самостоятельному выполнению восстановительных процедур. Клиника “Эхинацея” принимает пациентов из любой точки России и мира.
Как проходит лечение и обучение:
По окончании курса Вы будете уметь самостоятельно выполнять необходимые для поддержания своего здоровья процедуры. В ходе лечения улучшается общее самочувствие, повышается сила мышц, начинают возвращаться утраченные двигательные навыки. Вам будут даны подробные инструкции и план лечения на ближайшие 6-12 месяцев, для выполнения его по месту жительства. При необходимости мы примем Вас на повторное лечение через полгода, год или больший промежуток времени.
Если Вы едете к нам из другого города, рекомендуем приезжать на период 5 дней – с понедельника по пятницу. Если Вы не располагаете этим временем, курс можно уложить в 3 дня, хотя и с некоторыми потерями.
Как попасть в клинику? Сколько стоит лечение?
По поводу записи на консультацию, лечение и обучение, связывайтесь с администратором клиники по телефону; Вам подберут удобный для Вас день и час визита к врачу. Клиника работает ежедневно.
Объем и стоимость стандартного курса лечения и обучения: