На чем культивируют вирусы
КУЛЬТИВИРОВАНИЕ ВИРУСОВ
Культивирование вирусов — выращивание вирусов в искусственных условиях путем заражения животных, культур клеток и тканей. Культивирование вирусов производят в диагностических целях (выделение от больных и носителей), при экспериментальной работе (изучение вирусов), для производства вирусных вакцин и диагностикумов.
Гальтье (V. Galtier) впервые осуществил в 1879 г. культивирование вируса бешенства, заразив кролика мозгом больной собаки. Левенштейн (A. Lowenstein, 1919) первый опубликовал данные об успешной передаче вируса герпеса от человека кролику. Грютер (W. Gruter, 1920) доказал возможность культивирования вируса герпеса на кроликах. Способность вируса вакцины (коровьей оспы) репродуцироваться в тканевой культуре была доказана Паркером и Наем (F. Parker, В. N. Nye) в 1925 г. В 1931 г. Вудрафф (А. М. Woodruff) и Э. Гудпасчер показали возможность К. в. на хорион-аллантоисной оболочке эмбрионов кур (вирус оспы птиц).
Вирусы репродуцируются только в живых клетках, поэтому для их накопления заражают вирусами животных или культуры клеток и тканей. При этом происходит адаптация вируса, полученного из организма больного или носителя, к новым условиям. Чем меньше отличается искусственная система от естественной, тем легче осуществляется адаптация вируса.
Для оптимальной репродукции вируса необходимо использовать наиболее чувствительную систему и проводить заражение сильно разведенным свежим материалом, поскольку инактивированные вирусные частицы могут тормозить размножение инфекционных вирионов. Система, в к-рой вирус проходит полный цикл репродукции, носит название пермиссивной (разрешающей). В непермиссивной (неразрешающей) системе происходит неполный цикл репродукции вируса либо он вообще не репродуцируется. Пермиссивная для данного вируса система может стать для него непермиссивной при изменении условий культивирования, напр, при изменении температуры.
На животных культивируют те вирусы, которые вызывают у них четкую клиническую или патологоанатомическую картину (напр., развитие у мышей параличей при заражении вирусом бешенства или пневмонии при гриппозной инфекции). Многие вирусы лучше растут в мало-дифференцированных тканях эмбрионов птиц и новорожденных млекопитающих, чем в организме взрослых особей.
Для Культивирования вирусов используют мышей, крыс, морских свинок, кроликов, сирийских хомячков, африканских хорьков, обезьян, кур и др. На взрослых мышах культивируют вирусы гриппа, бешенства, многие тогавирусы; мыши-сосунки незаменимы при выращивании ряда вирусов Коксаки и тогавирусов ряда ареновирусов — возбудителей вирусных геморрагических лихорадок.
Сосунков белых крыс и сирийских хомячков часто используют для культивирования онкогенных вирусов. Морские свинки служат для выращивания вирусов ящура, марбургской болезни и др. Из обезьян наиболее часто используют зеленых африканских мартышек и разные виды макаки. Так, изучение вирусов полиомиелита и желтой лихорадки стало возможным после их адаптации к организму макак. Культивирование возбудителей некоторых медленных инфекций (куру, болезни Крейтцфельдта—Якоба), а также вирусов гепатитов А и В впервые удалось при заражении шимпанзе. Чувствительными к вирусу гепатита А также оказались южноамериканские обезьяны мармозеты.
Для получения стандартных результатов животные, используемые для работы с вирусами, должны быть генетически однородными. Этой цели служит инбредное скрещивание лаб. животных — братьев и сестер или родителей и детей, чем достигается возрастающая степень гомозиготности.
Для успешного К. в., помимо вида и возраста животных, имеет значение путь введения материала, что обусловлено тропностью вируса. Поэтому в большинстве случаев для размножения вируса в организме животного необходима его инокуляция в чувствительную ткань. Лишь некоторые вирусы патогенны для животных при любых способах инокуляции (напр., вирус венесуэльского энцефалита лошадей для мышей).
Большинство нейротропных вирусов культивируют путем введения их в полушария головного мозга животных. Этим путем заражают мышей различными тогавирусами, буньявирусами и другими арбовирусами. Вирус бешенства вводят таким же образом мышам, кроликам, овцам и собакам, вирус лимфоцитарного хориоменингита — мышам и морским свинкам. При культивировании вируса полиомиелита на обезьянках его инокулируют в спинной мозг или таламус головного мозга. Часто при культивировании нейротропных вирусов их вводят животным в брюшную полость, однако этот путь инокуляции уступает по чувствительности внутримозговому. Респираторные вирусы культивируют обычно путем интраназального заражения — их закапывают в нос наркотизированным животным или вводят в виде аэрозоля в специальной камере.
Аденовирусы инокулируют сирийским хомячкам подкожно или в слизистую оболочку защечных мешков, вирус герпеса обезьян — кроликам внутрикожно, а оспенные вирусы — на скарифицированную кожу (кроликам, телятам, курам). Вирусы оспы и герпеса можно культивировать на скарифицированной роговице кролика. Введение вирусов в мышцу, внутривенно, через рот и per rectum применяют редко. Внутривенное заражение морских свинок, хомячков и хорьков технически сложно, вместо этого материал чаще вводят в полость сердца.
Культивирование вирусов на животных очень затрудняется наличием в их организме различных бактерий, микоплазм и вирусов, которые могут загрязнить культивируемый вирус. Иногда вирус, находящийся в организме животного, создает иммунитет к культивируемому вирусу, напр, возбудитель эктромелии у мышей к вирусу вакцины.
Для уменьшения риска загрязнения культивируемых вирусов посторонними возбудителями все чаще используют животных, выращенных в условиях изоляции. С этой целью получают животных, свободных от специфических для данного вида патогенных агентов,— SPF (specific pathogen free). У их матерей не должно быть инфекций, передающихся через плаценту. Детенышей извлекают при помощи кесарева сечения, вводят им в кишечник апатогенные бактерии, напр, молочнокислые, после чего они вскармливаются SPF самками. В дальнейшем эти животные размножаются обычным путем. Содержат их в закрытых помещениях, куда подается стерильный воздух, пища, вода и пр.
Животных, свободных от всяких возбудителей, содержат в специальных боксах в условиях еще более строгой изоляции (см. Стерильные животные).
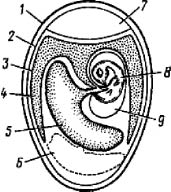
Эмбрионы птиц с их малодифференцированными тканями пригодны для культивирования очень многих вирусов. Для получения оптимальных результатов имеет значение вид и возраст эмбрионов, путь заражения, введенная доза и температура инкубации. Чаще всего используют эмбрионы кур. Они наиболее чувствительны до 13-го дня инкубации. Инокулируют вирусы обычно на хорион-аллантоисную оболочку, в желточный мешок, аллантоисную и амниотическую полость; в мозг эмбрионов и внутривенно (в сосуды оболочек) вирусы вводят редко. В желточном мешке культивируют многие тогавирусы; вирусы гриппа и инфекционного паротита хорошо культивируются в амниотической полости 10 —11-дневных эмбрионов, при этом вирус гриппа размножается не только в клетках амниона, но также в трахее и легких эмбриона. Вирусы оспенной группы и др. культивируют на хорион-аллантоисной оболочке, заражая 10—13-дневные эмбрионы через естественный воздушный мешок или через отверстие на боковой поверхности яйца после создания искусственного воздушного мешка. При заражении любым путем эмбрионы могут быть травмированы, поэтому их гибель в первые 24 часа расценивается как неспецифическая. Оптимальное количество вируса при заражении — 1000 — 10 000 инфекционных доз. К. в. в эмбрионах обычно происходит при t° 36—37°. Некоторые вирусы, напр, вирус вакцины, могут размножаться при температуре выше 40°, в то время как возбудитель натуральной оспы необходимо культивировать при температуре не выше 38,5°. Температурно-чувствительные мутанты вирусов, обладающие, как правило, сниженной патогенностью, культивируют при t° 25—28°.
При размножении в эмбрионах вирусы могут вызвать их гибель (многие арбовирусы, вирус энцефаломиокардита и др.), появление изменений на хорион-аллантоисной оболочке (оспенные вирусы) или в теле эмбриона, накопление в эмбриональных жидкостях гемагглютининов (вирусы гриппа, паротита) и комплементсвязывающего вирусного антигена.
Большинство известных вирусов можно выращивать в культурах клеток и тканей (см.). Чаще всего используют однослойные первичные или перевиваемые клеточные культуры на стекле, реже применяют суспензионные культуры. К первичным культурам клеток вирусы адаптируются легче, чем к перевиваемым. Вирусы человека лучше всего размножаются в культурах человеческих клеток и почечных клеток обезьян.
Оптимальная доза вируса при заражении — 0,1—0,001 50% тканевой цитопатической дозы вируса на клетку. Объем инокулята должен быть небольшим. Адсорбцию вируса проводят в течение 1—2 час. при t° 37°, после чего инокулят удаляют, если он токсичен для клеток. Питательная среда должна иметь pH 6,9 — 7,2. Если к ней прибавлена сыворотка, последняя не должна содержать антител или неспецифических ингибиторов по отношению к культивируемому вирусу. Наиболее интенсивная репродукция большинства вирусов происходит при t 36 — 37°; при более низкой температуре (33°) культивируют риновирусы.
При К. в. с целью их выделения из инфицированных органов весьма эффективно культивирование клеток самой исследуемой ткани после ее трипсинизации (напр., ткани миндалин для выделения аденовирусов).
Размножение большинства вирусов сопровождается цитопатическими изменениями. Максимальное количество вируса в культуре обычно наблюдается при дегенерации 75% клеток. Размножение вирусов, не обладающих цитопатической активностью, можно установить с помощью реакции гемадсорбции (многие миксо- и тогавирусы), методом иммунофлюоресценции, путем исследования культуральной жидкости на наличие гемагглютининов (напр., миксовирусы) или комплементсвязывающего вирусного антигена, а также в опытах на животных (вирус бешенства). Некоторые вирусы можно выявить по их способности подавлять размножение цитопатогенного вируса, т. е. по феномену интерференции (напр., в культурах клеток эмбрионов кур, инфицированных вирусами лейкоза птиц, не размножается вирус саркомы Рауса). Некоторые вирусы образуют в клетках включения.
Большинство вирусов после размножения в клетках выходит в культуральную среду, ряд других остается связанным с клетками (вирусы оспы, аденовирусы), некоторые герпетические вирусы необходимо пересевать вместе с неповрежденными клетками, поскольку при разрушении клеток они инактивируются. Иногда при взаимодействии вируса и клетки развивается хроническая инфекция. Напр., инфицированные вирусом лимфоцитарного хориоменингита перевиваемые человеческие клетки могут продуцировать инф. вирус в продолжение многих поколений.
Для выращивания коронавирусов человека и некоторых других используют тканевые культуры, т. е. культивируемые вне организма тканевые фрагменты. Чаще всего используют ткань трахеи кролика. О размножении вируса в этом случае судят по прекращению движения ресничек культуры ткани.
Следует учитывать возможность присутствия в культурах клеток и тканей различных вирусов и микоплазм. Они могут быть внесены вместе с клетками, если последние взяты из инфицированного организма, попасть из трипсина или используемой в качестве ингредиента питательной среды сыворотки.
Адаптация вируса к искусственным условиям размножения требует проведения нескольких пассажей, быстро следующих друг за другом при заражении небольшой дозой вируса. Обычно интенсивность репродукции вируса при этом значительно возрастает. Иногда вирус после адаптации к одной системе приобретает способность размножаться также в других системах. Свежевыделенные вирусы более пластичны, чем долго культивировавшиеся в каких-либо одних условиях. К. в. в искусственных условиях нередко приводит к снижению их патогенности для естественных хозяев, чем пользуются для получения вакцинных штаммов. В неблагоприятных условиях культивирования (малочувствительных системах или при заражении слишком большой дозой) могут формироваться дефектные вирусные частицы, содержащие лишь часть генома или не имеющие нуклеиновой к-ты. Некоторые вирусы вообще не удается культивировать в искусственных условиях или их репродукция прекращается после нескольких пассажей.
Сохранять вирусы в течение нескольких дней можно при t° 4° в среде с pH ок. 7,0. Устойчивость их возрастает при удалении клеточных фрагментов и прибавлении сыворотки (10%), глицерина (50%) или обезжиренного молока (50%). Все вирусы хорошо сохраняются при t° —70° и ниже в герметически закрытых сосудах; многие остаются жизнеспособными месяцы и даже годы. Оспенные вирусы и энтеровирусы хорошо сохраняются при t° —20°. Замораживание вируса должно происходить быстро. Для повышения устойчивости вируса прибавляют к среде сывороточный белок, куриный желток, пептон, сахарозу или глюкозу. Влияние стабилизаторов на разные вирусы неодинаково. Вирусы могут оставаться жизнеспособными длительное время и после лиофилизации. В качестве стабилизаторов при этом используют пептон (10%), молоко (50%), сахарозу с желатиной или куриным желтком (по 10 %). Лиофилизированный вирус должен сохраняться в вакууме или нейтральном газе (напр., азоте) при t° 4° или —15°.
Библиография: Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., М., 1974; Соколов М. И., Синицкий А. А. и Ремезов П. И. Вирусологические и серологические исследования при вирусных инфекциях, Л., 1972; Штарке Г. и др. Практическая вирусология, пер. с нем., М., 1970, библиогр.; Comparative diagnosis of viral diseases, ed. by E. Kurstak a. C. Kurstak, v. 1—2, N. Y. a. o., 1977.
Научная электронная библиотека
Перетрухина А. Т., Блинова Е. И.,
Глава 3. МЕТОДЫ КУЛЬТИВИРОВАНИЯ МИКРОБОВ
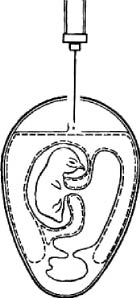
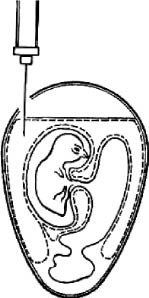
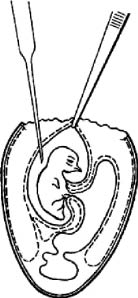
Рис. 2. Заражение куриного эмбриона на ХАО через естественную воздушную камеру
(по Николау)
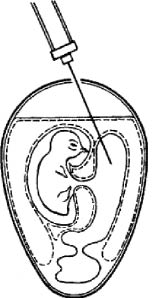
Рис. 3. Заражение куриного эмбриона в аллантоисную полость (по Николау)
Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса. Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2-0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 4, а). В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 4, б).
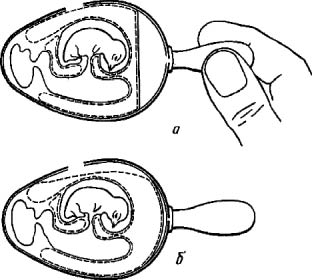
Рис. 4. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Через боковое отверстие на поверхность ХАО наносят инфекционную жидкость и отверстие закрывают кусочком лейкопластыря. Закрывать первое отверстие нет необходимости, так как внутренний листок подскорлупной оболочки при этом методе заражения не нарушается и продолжает выполнять роль барьера для микрофлоры окружающей среды.
Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальном положении боковым отверстием вверх.
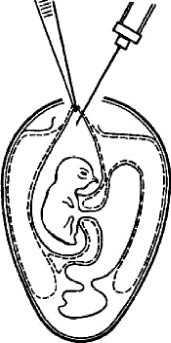
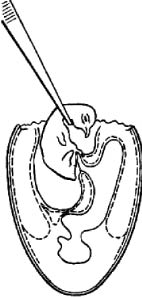
Заражение в желточный мешок. Большей частью им пользуются для размножения хламидий, а также вирусов болезни Марека, ринопневмонии лошадей, катаральной лихорадки овец и др. Заражают эмбрионы 5-7-дневного, а иногда и 2-3-дневного возраста (вирус лихорадки долины РИФ). Используют два варианта заражения (рис. 6).
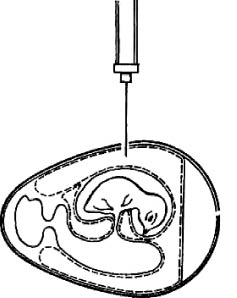
Рис. 5. Заражение куриного эмбриона в амниотическую полость (по Николау и др.)
Рис. 6. Заражение куриного эмбриона в желточный мешок (по Николау и др.)
Рис. 7. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)
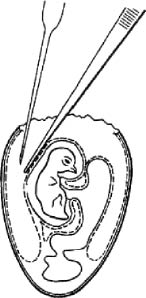
Рис. 8. Отсасывание аллантоисной жидкости (по Николау)
Рис. 9. Отсасывание амниотической жидкости (по Николау и др.)