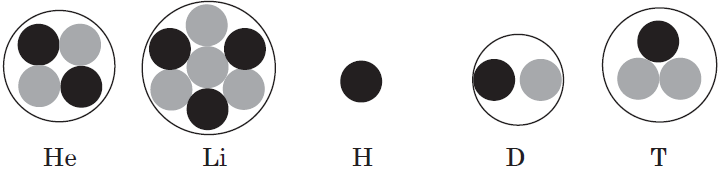
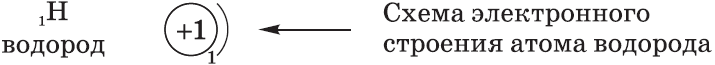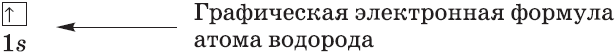На чем находятся электроны
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
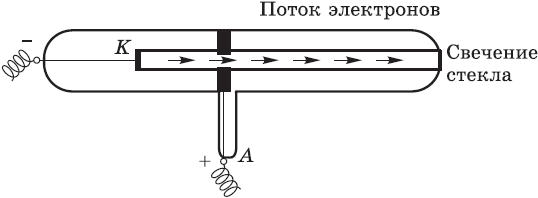
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
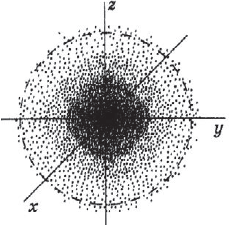
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
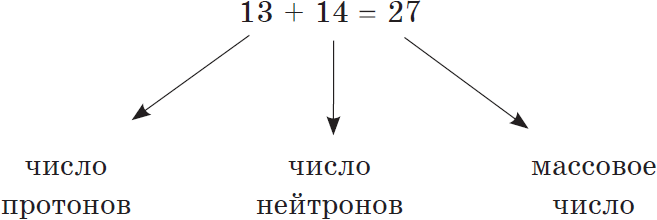
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 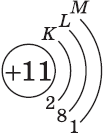 | $1s^2<2>s^2<2>p^6<3>s^1$ | 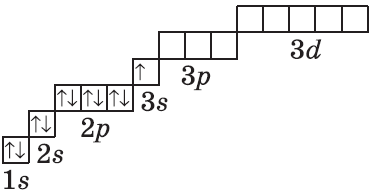 |
| $↙<13> | 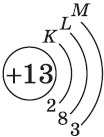 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 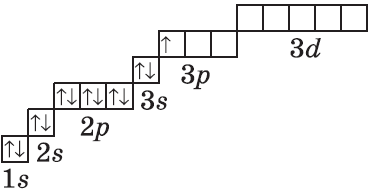 |
| $↙<18> | 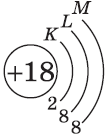 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 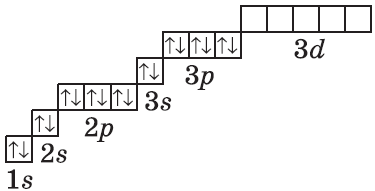 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
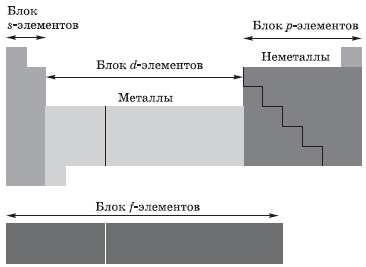
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
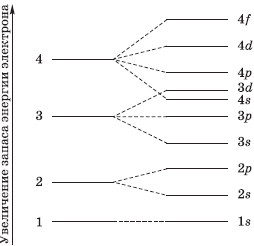
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
На чем находятся электроны
§2.5. Электронное строение атома.
В этом и в следующем параграфах рассказывается о моделях электронной оболочки атома. Важно понимать, что речь идет именно о моделях. Реальные атомы, конечно, более сложны и мы пока знаем о них далеко не все. Однако современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках.
Для начала рассмотрим более подробно «планетарную» модель, которую предложил Н. Бор (рис. 2-3 в).
Рис. 2-3 в. «Планетарная» модель Бора.
Как уже рассказывалось в этой главе, датский физик Н. Бор в 1913 году предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты (подробнее об этом рассказывается в параграфе 2.7).
Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Для описания электронного строения атома водорода достаточно одних только уровней. Но в более сложных атомах, как выяснилось, уровни состоят из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d), как показано на рис. 2-6. Четвертый уровень (он не поместился на рисунке) состоит из подуровней 4s, 4p, 4d, 4f. В параграфе 2.7 мы расскажем, откуда взялись именно такие названия подуровней и о физических опытах, которые позволили «увидеть» электронные уровни и подуровни в атомах.
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов.
В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра.
Рис. 2-7. Примерно такую форму в волновой модели атома имеют «области вероятности» существования электронов: s- и p-орбитали (d-орбитали имеют более сложную форму).
В классической механике предполагается, что человек может наблюдать явление, не нарушая его естественного хода. Например, можно наблюдать движение небесных тел в телескоп, и это никак не отразится на их движении. Астроном может произвести измерения и составить точное математическое описание движения объекта. Используя полученные формулы, можно предсказать, куда движется данный объект и где он будет находиться в любой момент времени.
В микромире дело обстоит иначе. Например, исследуя движение электрона с помощью микроскопа (если бы такое было возможно), мы бы наблюдали отраженные от электрона волны света, энергия которых по величине сопоставима с энергией самих исследуемых частиц. Поэтому при выполнении измерений нами неизбежно вносились бы изменения в состояние электрона (местоположение, скорость, направление движения и т.д.). Значит, на основании наших измерений бессмысленно говорить о точном местоположении электрона в каждый момент времени.
Принцип неопределенности говорит о том, что не следует пытаться вычислить точную траекторию электрона вокруг ядра. Можно лишь указать вероятность нахождения электрона в том или ином участке пространства около ядра в любой момент времени. Эта вероятность поддается вычислению с помощью математических методов.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
Таблица 2-4. Наибольшее возможное число электронов на первых 4-х электронных уровнях.
Сколько может разместиться электронов на данном уровне (2n 2 )
Эти сведения нам нужны для того, чтобы научиться “расселять” электроны по уровням в атоме любого элемента. А химические свойства элемента, как мы увидим чуть позже, определяются электронами самого последнего (наиболее удаленного от ядра) заселенного уровня.
На чем находятся электроны
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (
90%), называется орбиталью.
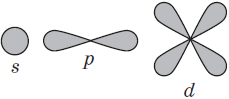
Виды электронных орбиталей
Форма орбитали в пространстве
Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
(электронное облако s – электрона)
Электронное облако такой формы может занимать в атоме одно положение
(электронное облако p – электрона)
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(электронное облако d – электрона)
(электронное облако f – электрона)
Электронное облако такой формы может занимать в атоме семь положений.
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s 2 ); на p – орбитали максимально может разместиться шесть электронов (p 6 ) на d – орбитали максимально может разместиться десять электронов (d 10 ); f – четырнадцать электронов (f 14 ).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.
Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s 1
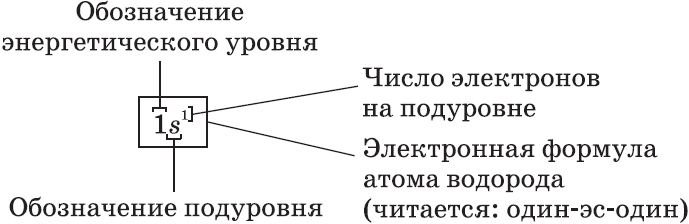
– электронная формула, отображает число электронов по орбиталям.
— электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
Порядок заполнения электронами атомных орбиталей определяется :
Принципом наименьшей энергии
Шкала энергий:
1s внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III—VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.
В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).
«Проскок» или «провал» электрона
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
в) заряду ядра атома;
3. Число нейтронов в атоме цинка равно
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
6. Электронная формула строения атома меди, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 ;
в) 1s 2 2s 2 2p 6 3s 1 3p 6 4s 2 3d 10 ;
7. Заряд ядра атома кальция равен
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
в) порядковому номеру элемента;
9. Число нейтронов в атоме железа равно
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
12. Электронная формула строения атома мышьяка, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 11 4p 3 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 4p 4 ;
в) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 4p 4 ;