На что делится молекула
Из чего состоит все вокруг или что такое молекула?
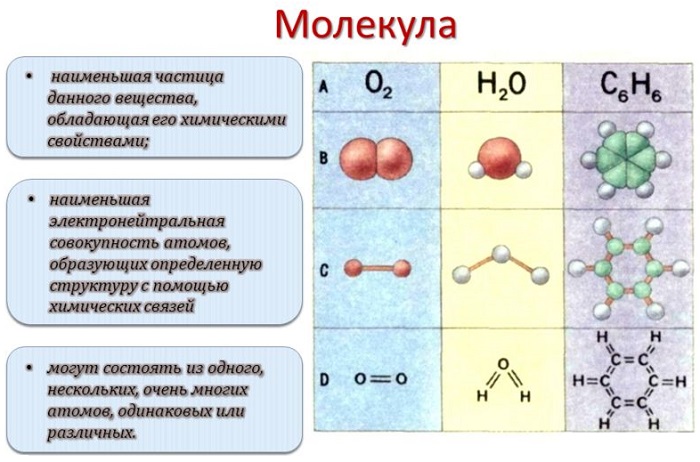
Каждый раз, когда два атома соединяются вместе, они образуют молекулу. На самом деле все, что нас окружает – да и мы сами – состоит из триллионов различных типов молекул. Понятие молекулы было принято в 1860 году на международном съезде химиков в Карлсруэ. Согласно принятому определению молекула – это наименьшая частица химического вещества, которая обладает всеми его химическими свойствами (растворимость, вкус, способность вступать в соединения и пр). Введение понятия молекулы подтолкнуло развитие физики, химии и других естественных наук. В более общем понимании молекулой называют частицу, образованную из двух или более атомов, соединенных между собой ковалентными связями.
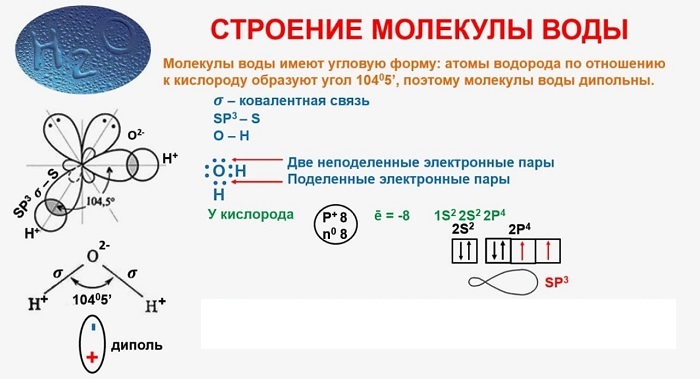
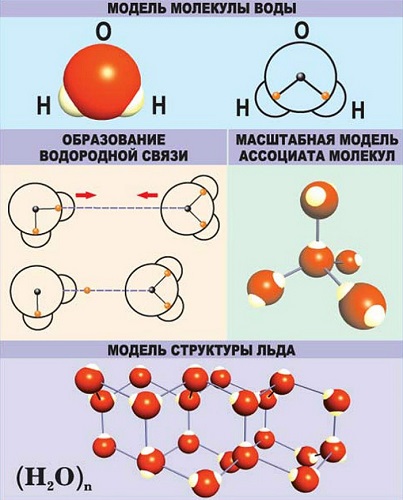
Молекула воды содержит 1 атом кислорода и 2 атома водорода
Атом – мельчайшая частица вещества, которая обладает всеми его физическими свойствами (цвет, твердость, плотность и пр.)
Когда атомы различных типов элементов соединяются вместе, они образуют молекулы, называемые соединениями. Так, вода состоит из сложных молекул, состоящих из 2 атомов водорода и 1 атома кислорода. Вот почему она называется H2O: у молекулы воды всегда будет в 2 раза больше атомов водорода, чем атомов кислорода. Существует чуть более 100 типов атомов, но типов различных веществ миллионы. Причина такого неравенства кроется в том, что они состоят из различных типов молекул.
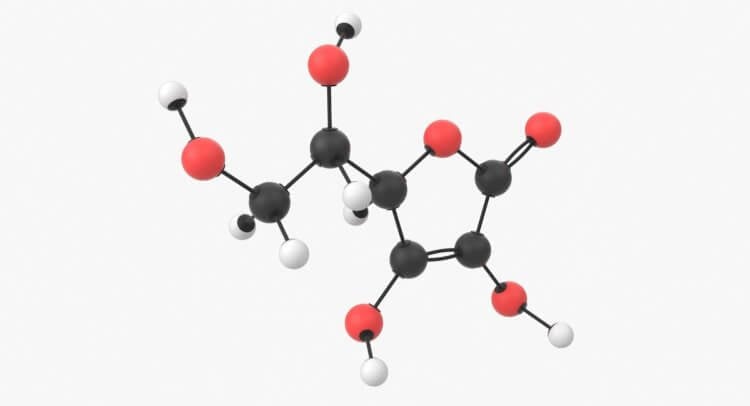
Важно понимать, что молекулы состоят не только из различных типов атомов, но и из различных соотношений. Как и в приведенном выше примере с водой, молекула воды состоит из двух атома водорода и одного атома кислорода, что записывается как H2O. Другими примерами являются углекислый газ (C02), аммиак (NH3) и сахар или глюкоза (C6H12O6). Некоторые молекулярные формулы могут получиться довольно длинными и сложными. Давайте посмотрим на молекулу сахара:
Чтобы она получилась, нужны определенные атомы в определенном количестве. Но молекулы могут быть гораздо больше. Одна молекула витамина С состоит из 20 атомов (6 атомов углерода, 8 атомов водорода и 6 атомов кислорода – C6H8O6). Если взять эти 20 атомов витамина С и смешать, соединяя их вместе в другом порядке, то получится совершенно другая молекула, которая не только выглядит по-другому, но и действует иначе.
Молекула витамина С выглядит так
Некоторые молекулы, особенно некоторые белки, содержат сотни или даже тысячи атомов, которые соединяются вместе в цепи, которые могут достигать значительной длины. Жидкости, содержащие такие молекулы, иногда ведут себя странно. Например, жидкость может продолжать вытекать из колбы, из которой была вылита некоторая ее часть, даже после того, как колба будет возвращена в вертикальное положение.
Факты о молекулах
Чтобы всегда быть в курсе последних научных открытий, подписывайтесь на наш новостной канал в Telegram
Химические связи
Молекулы и соединения удерживаются вместе силами, называемыми химическими связями. Существует четыре типа химических связей, которые удерживают большинство соединений вместе: ковалентные связи, ионные связи, водородные и металлические, однако в качестве основных выделяют ковалентные и ионные, так как они связаны с электронами. Как известно, электроны вращаются вокруг атомов в оболочках. Эти оболочки хотят быть «полными» электронов. Когда они не заполнены, то будут пытаться соединиться с другими атомами, чтобы получить нужное количество электронов и заполнить их оболочки.
Ковалентные связи делят электроны между атомами. Это происходит, когда получается, что атомы делятся своими электронами, чтобы заполнить свои внешние оболочки. В свою очередь ионные связи образуются, когда один электрон передается другому. Это происходит, когда один атом отдает электрон другому, чтобы сформировать баланс и, следовательно, молекулу или соединение.
Еще больше увлекательных статей о том, как ученые дробят реальность на атомы, читайте на нашем канале в Яндекс.Дзен. Там выходят статьи, которых нет на сайте!
Знания о свойствах и строении молекул легли в основу современной науки и нашего понимания Вселенной
Немаловажным также является тот факт, что молекулы всегда находятся в движении. В твердых телах и жидкостях они находятся очень близко друг к другу, а их движение можно сравнить с быстрой вибрацией. В жидкостях молекулы могут свободно перемещаться между собой, как бы скользя. В газе плотность молекул обычно меньше, чем в жидкости или твердом теле того же химического соединения, а потому молекулы движутся даже более свободно, чем в жидкости. Для конкретного соединения в данном состоянии (твердом, жидком или газообразном) скорость молекулярного движения возрастает с увеличением абсолютной температуры.
Что важно знать о молекулах в химии — особенности строения молекул
Молекула в химии: определение
Молекула — это электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями, имеющая определенную пространственную структуру и массу, а также обладающая всеми химическими свойствами этого вещества и способная к самостоятельному существованию.
В некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь молекулярное строение — например, все инертные газы. Для инертных газов понятия атом и молекула, можно условно назвать равносильными понятиями.
Так из определения можно сказать, что молекула характеризуется качественным и количественным составом. Качественный состав показывает, из каких атомов состоит молекула.
Молекулы воды или пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает сколько атомов каждого вида содержится в молекуле. Этот параметр при записи молекулярной формулы отражается в индексах химических элементов, из которых она составлена.
Молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула углекислого газа — из одного атома углерода и двух атомов кислорода.
Особенности строения, масса молекулы
Особенности строения молекулы
Центральным положением классической теории является положение о химической связи. Природа химической связи в классической теории не рассматривается — учитываются лишь такие характеристики, как валентные углы, углы между плоскостями, образованными тройками ядер, длины связей и их энергии.
Таким образом, молекула в классической теории представляется динамической системой, в которой атомы рассматриваются как материальные точки. В данной системе атомы и связанные группы атомов могут совершать механические вращательные и колебательные движения.
Молекула состоит из атомов, а если точнее — из атомных ядер, окруженных определенным числом внутренних электронов, и из внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа его получения.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов, образуя общее электронное облако, форма которого описывается типом гибридизации. Молекула может иметь положительно и отрицательно заряженные атомы (ионы).
Состав молекулы передается химическими формулами — краткой записью, которая устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентный радиус (в случае ионной связи — ионный радиус), характеризующий размеры электронной оболочки атома (иона), образующего химическую связь в молекуле. Размер электронной оболочки молекулы является условной величиной.
Молекулы состоят из электронов и атомных ядер. Расположение последних в молекуле передает структурная формула (для передачи состава используется брутто-формула).
К веществам, сохраняющим молекулярную структуру в твердом состоянии, относятся: вода, оксид углерода (IV), многие органические вещества. Они характеризуются низкими температурами плавления и кипения. Большинство же твердых (кристаллических) неорганических веществ состоят не из молекул, а из других частиц (ионов, атомов) и существуют в виде макротел (кристалл хлорида натрия, кусок меди и т. д.).
Рис.1. Модель молекулы воды.
Масса молекулы
Масса молекулы (Mr) — относительная молекулярная (атомная) масса вещества — это отношение массы молекулы (или атомов) данного вещества к 1 / 12 массы атома углерода.
Молярная масса (M) — это масса вещества, взятого в количестве одного моля.
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Состав и виды молекул
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Макромолекулы чаще всего встречаются в биологии. Рассмотрим некоторые примеры таких молекул.
Молекула может иметь совсем другие свойства, чем атомы, из которых она состоит. Например, сахар (глюкоза или сахароза) представляет собой комбинацию атомов. В него входят кислород, углерод и водород. Углерод в отдельности может представлять собой серое твердое вещество, а кислород и водород — оба газы.
Образуя между собой ковалентные связи, эти атомы создают сладкое питательное вещество, богатое энергией, которое многим животным помогает выжить.
В биологии много других примеров макромолекул, например, РНК, ДНК, ферменты, иммуноглобулин, гемоглобин и др.
Также макромолекулами называют полимерные соединения, которые могут быть синтезированы из множества мономеров и составлять большие и длинные цепи.
Типы химических связей в молекуле
Химическая связь — это связь между атомами в молекуле, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Металлическая — это связь, образованная между ядрами атомов металлов, расположенных в узлах кристаллических решеток, объединенных общим облаком электронов.
Водородная — это вид химической связи, образованной между некоторыми молекулами, содержащими водород, и другим, более электроотрицательным атомом (кислородом, азотом, фтором, реже серой).
Ионная — имеет электрическую природу, то есть это один из видов химической связи, в основе которого лежат электростатические взаимодействия между заряженными ионами: катионом (положительно заряженным ионом) и анионом (отрицательно заряженным ионом).
Обычно ионная связь образуется между типичными металлом и неметаллом, например: поверенная соль (хлорид натрия), оксид бария и т.д.
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам, либо по обменному механизму (обобществление пары электронов), либо по донорно-акцепторному механизму (из электронов донора и свободной орбитали акцептора). Отличается наибольшей устойчивостью и энергетической емкостью.
Ковалентной связью связаны атомы в молекулах простых веществ (хлор, бром, кислород и др.), органических веществ. То есть ковалентная связь образуется между атомами неметаллов. Если неметаллы одинаковые, то образуется ковалентная неполярная связь, а если связь образуется между разными неметаллами — то это ковалентная полярная связь (Рис.2).
Рис.2. Образование ковалентной полярной связи (на примере соляной кислоты).
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.
Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.
В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Молекула
Особенности строения молекул определяют физические свойства вещества, состоящего из этих молекул.
Содержание
История становления понятия
На международном съезде химиков в г. Карлсруе (Германия) в 1860 году были приняты определения понятий молекулы и атома. Молекула — наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
Классическая теория химического строения
В классической теории химического строения молекула рассматривается как наименьшая стабильная частица вещества, обладающая всеми его химическими свойствами.
Молекула данного вещества имеет постоянный состав, то есть одинаковое количество атомов, объединённых химическими связями, при этом химическая индивидуальность молекулы определяется именно совокупностью и конфигурацией химических связей, то есть валентными взаимодействиями между входящими в её состав атомами, обеспечивающими её стабильность и основные свойства в достаточно широком диапазоне внешних условий. Невалентные взаимодействия (например, водородные связи), которые зачастую могут существенно влиять на свойства молекул и вещества, образуемого ими, в качества критерия индивидуальности молекулы не учитываются.
Центральным положением классической теории является положение о химической связи, при этом допускается наличие не только двухцентровых связей, объединяющих пары атомов, но и наличие многоцентровых (обычно трёхцентровых, иногда — четырёхцентровых) связей с «мостиковыми» атомами — как, например, мостиковых атомов водорода в боранах, природа химической связи в классической теории не рассматривается — учитываются лишь такие интегральные характеристики, как валентные углы, диэдральные углы (углы между плоскостями, образованными тройками ядер), длины связей и их энергии.
Таким образом, молекула в классической теории представляется динамической системой, в которой атомы рассматриваются как материальные точки и в которой атомы и связанные группы атомов могут совершать механические вращательные и колебательные движения относительно некоторой равновесной ядерной конфигурации, соответствующей минимуму энергии молекулы и рассматривается как система гармонических осцилляторов.
Молекула состоит из атомов, а если точнее, то из атомных ядер, окруженных определенным числом внутренних электронов, и внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа его получения.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов, образуя общее электронное облако, форма которого описывается типом гибридизации. Молекула может иметь положительно и отрицательно заряженные атомы (ионы).
Состав молекулы передается химическими формулами. Эмпирическая формула устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Геометрическая структура молекулы определяется равновесным расположением атомных ядер. Энергия взаимодействия атомов зависит от расстояния между ядрами. На очень больших расстояниях эта энергия равна нулю. Если при сближении атомов образуется химическая связь, то атомы сильно притягиваются друг к другу (слабое притяжение наблюдается и без образования химической связи), при дальнейшем сближении начинают действовать электростатические силы отталкивания атомных ядер. Препятствием к сильному сближению атомов является также невозможность совмещения их внутренних электронных оболочек.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентный радиус (в случае ионной связи — ионный радиус), который характеризует размеры электронной оболочки атома (иона) образующего химическую связь в молекуле. Размер молекулы, то есть размер её электронной оболочки, является величиной до известной степени условным. Существует вероятность (хотя и очень малая) найти электроны молекулы и на большем расстоянии от её атомного ядра. Практические размеры молекулы определяются равновесным расстоянием, на которое они могут быть сближены при плотной упаковке молекул в молекулярном кристалле и в жидкости. На больших расстояниях молекулы притягиваются друг к другу, на меньших — отталкиваются. Размеры молекулы можно найти с помощью рентгеноструктурного анализа молекулярных кристаллов. Порядок величины этих размеров может быть определен из коэффициентов диффузии, теплопроводности и вязкости газов и с плотности вещества в конденсированном состоянии. Расстояние, на которое могут сблизиться валентно не связанные атомы одного и того же или разных молекул, может быть охарактеризована средними значениями так называемых ван дер ваальсовых радиусов (Ǻ).
Радиус Ван-дер-Ваальса существенно превышает ковалентный. Зная величины ван дер ваальсовых, ковалентных и ионных радиусов, можно построить наглядные модели молекул, которые бы отражали форму и размеры их электронных оболочек.
Ковалентные химические связи в молекуле расположены под определенными углами, которые зависят от состояния гибридизации атомных орбиталей. Так, для молекул насыщенных органических соединений характерно тетраэдральное (четырехгранное) расположение связей, образуемых атомом углерода, для молекул с двойной связью (С = С) — плоское расположение атомов углерода, для молекул соединений с тройной связью (С º С) — линейное расположение связей. Таким образом, многоатомная молекула имеет определенную конфигурацию в пространстве, то есть определенную геометрию расположения связей, которая не может быть изменена без их разрыва. Молекула характеризуется той или иной симметрией расположения атомов. Если молекула не имеет плоскости и центра симметрии, то она может существовать в двух конфигурациях, которые представляют собой зеркальные отражения друг друга (зеркальные антиподы, или стереоизомеры). Все важнейшие биологические функциональные вещества в живой природе существуют в форме одного определенного стереоизомера.
Молекулы, содержащие единичные связи, или сигма-связи, могут существовать в различных конформациях, возникающих при поворотах атомных групп вокруг единичных связей. Важные особенности макромолекул синтетических и биологических полимеров определяются именно их конформационными свойствами.
Квантохимическая теория химического строения
В квантохимической теории химического строения основными параметрами, определяющими индивидуальность молекулы, является её электронная и пространственная (стереохимическая) конфигурации. При этом в качестве электронной конфигурации, определяющей свойства молекулы принимается конфигурация с наинизшей энергией, то есть основное энергетическое состояние.
Представление структуры молекул
Молекулы состоят из электронов и атомных ядер, расположение последних в молекуле передаёт структурная формула (для передачи состава используется т. н. брутто-формула). Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов. Отдельно рассматриваются макромолекулы полимеров.
Взаимодействие атомов в молекуле
Природа химических связей в молекуле оставалась загадкой до создания квантовой механики — классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были созданы в 1927 году Гайтлером и Лондоном на примере простейшей молекулы Н2. Позже, теория и методы расчетов были значительно усовершенствованы.
Химические связи в молекулах подавляющего большинства органических соединений является ковалентными. Среди неорганических соединений существуют ионные и донорно-акцепторные связи, которые реализуются в результате обобществления пары электронов атома. Энергия образования молекулы из атомов во многих рядах подобных соединений приближенно аддитивна. То есть можно считать, что энергия молекулы — это сумма энергий её связей, имеющих постоянные значения в таких рядах.
Аддитивность энергии молекулы выполняется не всегда. Примером нарушения аддитивности являются плоские молекулы органических соединений с так называемыми сопряженными связями, то есть с кратными связями, которые чередуются с единичными. В таких случаях валентные электроны, определяющие кратность связей, так называемые p-электроны, становятся общими для всей системы сопряженных связей, делокализованимы. Такая делокализация электронов приводит к стабилизации молекулы. Выравнивание электронной плотности вследствие коллективизации p-электронов по связям выражается в укорочении двойных связей и удлинение одинарных. В правильном шестиугольнике межуглеродных связей бензола все связи одинаковы и имеют длину, среднюю между длиной одинарной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах.
Современная квантовомеханическая теория химических связей учитывает частичную делокализации не только p-, но и s-электронов, которая наблюдается в любых молекулах.
В подавляющем большинстве случаев суммарный спин валентных электронов в молекуле равна нулю, то есть спины электронов попарно насыщены. Молекулы, содержащие неспаренные электроны — свободные радикалы (например, атомный водород Н, метил ·CH3), обычно неустойчивы, поскольку при их реакции друг с другом происходит значительное снижение энергии вследствие образования ковалентных связей.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами в пространстве. В зависимости от полярности молекул характер межмолекулярного взаимодействия разный. Природа последнего оставалась неясной до создания квантовой механики.
Ориентационный тип межмолекулярного взаимодействия возникает между двумя полярными молекулами, то есть, такими, которые имеют собственный дипольный момент. Взаимодействие дипольных моментов и определяет результирующую силу — притяжения или отталкивания. В случае, если дипольные моменты молекул размещаются на одной линии, взаимодействие молекул будет интенсивней.
Индукционный тип межмолекулярного взаимодействия возникает между одной полярной и одной неполярной молекулами. При этом типе взаимодействия полярная молекула поляризует неполярную молекулу так, что заряд неполярной молекулы, противоположный действующему на неё заряда полярной молекулы, смещается до последнего: в общем, положительный заряд смещается по направлению электрического поля, которое создает полярная молекула, а отрицательный — против. Это обусловливает поляризацию неполярной молекулы, то есть явления смещения связанной электронной оболочки относительно центра положительного заряда.
Дисперсионный тип межмолекулярного взаимодействия возникает между двумя неполярными молекулами. В общем, дипольные моменты неполярных молекул равны нулю, однако в определенный момент времени, есть вероятность распределения электронов по всему объёму молекулы неравномерно. Вследствие этого возникает мгновенный дипольный момент. При этом, мгновенный диполь или поляризует соседние неполярные молекулы, или взаимодействует с мгновенным диполем другой нейтральной молекулы.
Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекул — постоянным дипольным моментом и поляризуемостью.
Дипольный момент означает несовпадение «центров тяжести» положительных и отрицательных зарядов в молекуле (электрическую асимметрию молекулы). То есть молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента, и наоборот.
Поляризуемость — это способность электронной оболочки любой молекулы перемещаться под действием электрического поля, в результате чего в молекуле образуется наведенный дипольный момент. Значение дипольного момента и поляризуемости находят экспериментально с помощью измерения диэлектрической проницаемости.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны и определяются поляризуемостью молекулы этого вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
Магнитные свойства молекул
Молекулы и макромолекулы подавляющего большинства химических соединений является диамагнитными. Магнитная восприимчивость молекул (χ) для отдельных органических соединений может быть выражена как сумма значений χ для отдельных связей.
Молекулы, имеющие постоянный магнитный момент, является парамагнитными. К таковым относятся молекулы с нечетным количеством электронов на внешней оболочке (например, NO и любые свободные радикалы), молекулы, содержащие атомы с незаполненными внутренними оболочками (переходные металлы и т. д.). Магнитная восприимчивость парамагнитных веществ зависит от температуры, поскольку тепловое движение препятствует ориентации магнитных моментов в магнитном поле.
Спектры и строение молекул
Электрические, оптические, магнитные и другие свойства молекул связаны с волновыми функциями и энергиями различных состояний молекул. Информацию о состояниях молекул и вероятности перехода между ними дают молекулярные спектры.
Частоты колебаний в спектрах определяются массами атомов, их расположением и динамикой межатомных взаимодействий. Частоты в спектрах зависят от моментов инерции молекул, определение которых с спектроскопических данных позволяет получить точные значения межатомных расстояний в молекуле. Общее число линий и полос в колебательном спектре молекулы зависит от её симметрии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, которые построены из таких молекул, характеризуются окраской; к таким веществам относятся все органические красители.
Молекулы в химии, физике и биологии
Понятия молекулы является основным для химии, и большей частью сведений о строении и функциональность молекул наука обязана химическим исследованиям. Химия определяет строение молекул на основе химических реакций и, наоборот, на основе строения молекулы, определяет каким будет ход реакций.
Строению и свойствам молекулы определяются физические явления, которые изучаются молекулярной физикой. В физике понятия молекулы используется для объяснения свойств газов, жидкостей и твердых тел. Подвижностью молекул определяется способность вещества к диффузии, её вязкость, теплопроводность и т. д.. Первое прямое экспериментальное доказательство существования молекул было получено французским физиком Ж. Перреном в 1906 году при изучении броуновского движения.
Поскольку все живые организмы существуют на основе тонко сбалансированной химической и нехимической взаимодействия между молекулами, изучение строения и свойств молекул имеет фундаментальное значение для биологии и естествознания в целом.
Развитие биологии, химии и молекулярной физики привели к возникновению молекулярной биологии, которая исследует основные явления жизни, исходя из строения и свойств биологически функциональных молекул.