На что разлагается водород
Водород: химия водорода
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы (или в 1 группе в современной форме ПСХЭ) и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода:
+1H 1s 1 1s
Физические свойства
Водород – лёгкий газ без цвета, вкуса и запаха, очень плохо растворим в воде. В смеси с воздухом или кислородом крайне взрывоопасен и горюч.
Нахождение в природе
Водород — это самый распространённый элемент во Вселенной. Доля атомов водорода составляет примерно 88,6 % всех атомов (при этом доля атомов гелия — примерно 11,3 %, а доля остальных элементов вместе взятых порядка 0,1%). Водород входит в состав звезд и межзвездного газа.
В земной коре водород составляет только 1% по массе. При этом почти весь водород встречается на Земле в виде соединений. Это связано с высокой реакционной способностью водорода.
Способы получения
Для промышленного получения водорода используют следующие методы:
Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe2O3:
Электролиз водного раствора хлорида натрия:
2NaCl + 2H2O → H2 + Cl2 + 2NaOH
Для лабораторного получения водорода используют следующие методы:
Zn + 2HCl → ZnCl2 + Н2
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3Н2
NaH + H2O → NaOH + H2
Химические свойства
2Na + H2 → 2NaH
2. Водород реагирует с неметаллами.
2.1. С серой водород реагирует с образованием сероводорода :
2.2. С галогенами водород реагирует с образованием галогеноводородов:
С фтором реакция протекает со взрывом:
2.3. C углеродом реакция протекает только в жестких условиях:
2.5. Реакция водорода с азотом протекает при нагревании и под давлением, в присутствии катализатора :
2.6. Реакция водорода с фосфором протекает плохо и только в специальных условиях.
2.7. Реакция водорода с кремнием не протекает.
CuO + H2 = Cu + H2O
Водород также реагирует с оксидом азота (II):
В жестких условиях водород может восстанавливать кремний из оксида :
4. Водород вступает в реакции присоединения с органическими веществами: алкенами, алкинами, алкадиенами, некоторыми циклоалканами, аренами.
Также водород вступает в реакции присоединения с карбонильными соединениями (альдегидами и кетонами), реагирует со сложными эфирами, нитрилами, нитросоединениями, и некоторыми другими классами органических соединений. Более подробно эти реакции рассмотрены в блоке «Органическая химия».
Водород
В трудах химиков XVI-XVIII вв. упоминался «горючий» или «воспламеняемый воздух», который в сочетании с обычным давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот – серной и соляной. Первым ученым, описавшим свойства этого газа, был Г.Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов. Кавендиш принял «горючий воздух» (водород) за чистый флогистон – невидимую субстанцию, которую тела теряют при горении или при растворении в кислотах. Тогда металлы считали сложными веществами, содержащими флогистон, его-то они якобы и выделяют под действием кислоты.
Дальнейшее развитие химии показало ошибочность этой теории. Теперь общеизвестно, что водород входит в состав кислот, а металлы являются простыми веществами. Однако способ получения водорода, открытый в те времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20-процентную серную кислоту:
А.Л.Лавуазье в 1779 г. получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку с железными опилками. При температуре красного каления железо вступает в реакцию с водяным паром, и выделяется водород: 3Fe + 4H2O = Fe3O4 + 4H2↑

Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды – Н2О. Название элемента – Hydrogenium – Лавуазье и его коллеги образовали от греческих слов «гидор» — «вода» и «геннао» — «рождаю». Русское слово «водород», т.е. «рождающий воду», является точным переводом латинского названия.
Водород относится к числу наиболее распространенных химических элементов. В земной коре он встречается почти исключительно в виде соединений: входит в состав нефти, природного газа, каменного угля, некоторых минералов. В свободном состоянии он обнаружен в незначительном количестве в вулканических газах, а также среди продуктов разложения органических веществ микроорганизмами. Но конечно, самое известное соединение водорода – это его оксид, вода. По оценкам ученых, на Земле 1,4∙10 18 т поверхностных вод, и еще около 1,3∙10 13 т – в виде пара в атмосфере. Обширны также запасы подземных вод.
Кроме того, водород самый распространенный элемент во Вселенной. Энергия, излучаемая Солнцем и другими звездами, выделяется в результате ядерных реакций с участием его ядер.
Элемент образует несколько изотопов: наряду с обычным водородом с относительной атомной массой 1 (его называют протием, 1 Н), на Земле встречаются два тяжелых изотопа – дейтерий( 2 Н или D) и тритий ( 3 Н или Т). Содержание дейтерия в природном водороде очень незначительно: лишь один из 100 тыс. атомов водорода является атом дейтерия. Этот изотоп был выделен в 1931 г. при испарении жидкого водорода. Радиоактивного трития еще меньше – примерно один атом на каждые 10 18 атомов 1 Н. Недавно зафиксировано образование сверхтяжелых изотопов водорода – 4 Н и 5 Н.
Водород – бесцветный газ без вкуса и запаха, слаборастворимый в воде. Он в 14,5 раз легче воздуха – самый легкий из газов. Поэтому водородом раньше наполняли аэростаты и дирижабли.
Молекулы Н2 настолько малы, что способны легко проходить не только через мелкие поры, но и сквозь металлы. Некоторые из них, например никель и палладий, могут поглощать большое количество водорода и удерживать его в атомарном виде в пустотах кристаллической решетки. Нагретая до 250 о С палладиевая фольга свободно пропускает водород: этим пользуются для тщательной очистки его от других газов.
Подобно Н2, дейтерий при нормальных условиях – газ, состоящий из молекул D2. Однако по сравнению с обычным водородом он имеет более высокую температуру кипения (-249 о С ).
Химические свойства водорода
В химических реакциях водород может быть как восстановителем (что для него более характерно), так и окислителем.
Водород взаимодействует как восстановитель:
Смесь 2 объемов Н2 и 1 объема О2 при поджигании взрывается (так называемый «гремучий газ»);
б) с серой при нагревании:
в) с хлором при поджигании и облучении смеси газов УФ-светом:
г) с фтором при обычных условиях:
д) с азотом при повышенном давлении и нагревании в присутствии катализаторов(реакция необратима):
Как окислитель водород взаимодействует только с активными (щелочными и щелочноземельными) металлами. В результате образуются гидриды металлов, представляющие собой солеобразные ионные соединения, которые содержат гидрид-ионы Н — :
Гидриды металлов – нестойкие кристаллические вещества белого цвета. Они являются сильными восстановителями, так как степень окисления – 1 малохарактерна для водорода. Так, при действии воды гидриды разлагаются, восстанавливая при этом воду до водорода:
а) При высокой температуре водород может восстанавливать большинство оксидов металлов; например:
в) Водород способен присоединяться ко многим органическим молекулам. Такие реакции называются гидрированием и будут подробно рассмотрены в разделе «Органическая химия».
Получение водорода
Существует достаточно много способов получения водорода. Рассмотрим наиболее широко используемые лабораторные (первые три) и промышленные способы.
Применение водорода
В химической промышленности водород служит сырьем для получения аммиака NH3, хлороводорода НСl, метанола СН3ОН и других органических веществ. В пищевой промышленности водород используют для выработки твердых жиров путем гидрогенизации растительных масел. В металлургии водород используется для восстановления некоторых цветных металлов из их оксидов. Как уже отмечалось выше, водород – очень легкий газ, поэтому им заполняют воздушные шары, зонды и другие летательные аппараты. Высокая экзотермичность реакции горения водорода в кислороде обусловливает использование «водородной» горелки для сварки и резки металлов (температура водородного пламени достигает 2600 о С ). Жидкий водород является одним из наиболее эффективных видов ракетного топлива.
В последние годы все больше внимание уделяется водородной энергетике, т.е. использованию водорода в качестве топлива, в частности для двигателей внутреннего сгорания. Это представляет особый интерес с экологической точки зрения, так как при горении водорода в выделяющихся газах не содержится вредных веществ (продукт горения – вода!).
Пероксид водорода (Н2О2)
Раствор пероксида водорода имеет кислую реакцию среды, что обусловлено диссоциацией его молекул по типу слабой кислоты:
Как кислота пероксид водорода взаимодействует с основаниями:
Некоторые пероксиды металлов, например Na2O2, BaO2, можно рассматривать как соли слабой кислоты пероксида водорода. Из них можно получать Н2О2 действием более сильных кислот:
Графическая формула пероксида водорода: Н – О – О – Н. «Пероксидный мостик» из двух атомов кислорода обусловливает неустойчивость молекулы. При хранении на свету, нагревании, в присутствии катализатора пероксид водорода разлагается на воду и кислород:
Данная реакция относится к типу реакций диспропорционирования. Способность пероксида водорода к самоокислению-самовосстановлению объясняется тем, что атомы кислорода в его молекуле находятся в промежуточной степени окисления – 1. Этим же обусловлено участие Н2О2 в различных реакциях в роли окислителя или в роли восстановителя. В реакциях с типичными восстановителями пероксид водорода проявляет свойства окислителя и восстанавливается до воды или гидроксид-ионов; например:
При взаимодействии с сильными окислителями Н2О2 проявляет восстановительные свойства и окисляется до свободного кислорода; например:
Пероксид водорода применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство в виде 3%-ного раствора.
Скачать:
Скачать бесплатно реферат на тему: «Водород» Водород.docx (240 Загрузок)
Скачать бесплатно реферат на тему: «Водород и Вселенная» Водород-и-Вселенная.docx (223 Загрузки)
Скачать бесплатно реферат на тему: «Вода» Вода.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (253 Загрузки)
Скачать бесплатно реферат на тему: «Вода и ее свойства» Вода-и-её-свойства.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Водные ресурсы» ВОДНЫЕ-РЕСУРСЫ.docx (216 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Водород
(молярная масса)[ 1,00784 ; 1,00811]а. е. м. (г/моль)Электронная конфигурация1s 1Радиус атома53 пмКовалентный радиус32 пмРадиус иона54 (−1 e) пмЭлектроотрицательность2,20 (шкала Полинга)Степени окисления+1, 0, −1Энергия ионизации
(первый электрон)1311,3 (13,595) кДж/моль (эВ)Плотность (при н. у.)0,0000899 (при 273 K (0 °C)) г/см³Температура плавления14,01 K; −259,14 °CТемпература кипения20,28 K; −252,87 °CУд. теплота плавления0,117 кДж/мольУд. теплота испарения0,904 кДж/мольМолярная теплоёмкость28,47 Дж/(K·моль)Молярный объём14,1 см³/мольСтруктура решёткигексагональнаяПараметры решёткиa = 3,780 c = 6,167 ÅОтношение c/a1,631Температура Дебая110 KТеплопроводность(300 K) 0,1815 Вт/(м·К)Номер CAS12385-13-6
Водород (H, лат. hydrogenium ) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1 H — протий, 2 H — дейтерий и 3 H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Содержание
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород.
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода.
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Распространённость
Во Вселенной
В настоящее время водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца
6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна
52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.
Получение
В промышленности
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м 3 газа. Почти все остальное получают из угля. Около 0,1 % (
100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает
830 млн тонн CO2. Себестоимость водорода из природного газа оценивается в 1,5-3 доллара за 1 кг.
В лаборатории
Очистка
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ).
Стоимость
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Физические свойства
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением.
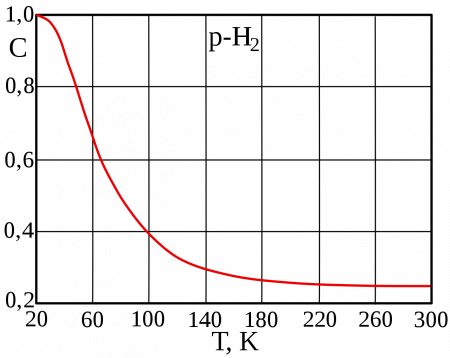
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы
Наиболее известны три изотопа водорода: протий 1 H (атомное ядро — протон), дейтерий 2 H (ядро состоит из одного протона и одного нейтрона) и тритий 3 H (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10 −21 —10 −23 с.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
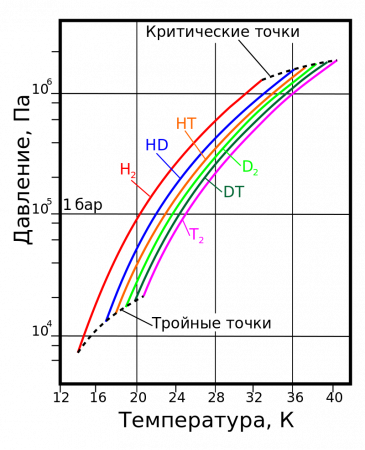
| Температура плавления, K | Температура кипения, K | Тройная точка | Критическая точка | Плотность, кг/м³ | ||||
|---|---|---|---|---|---|---|---|---|
| T, K | P, кПа | T, K | P, МПа | жидкий | газ | |||
| H2 | 13,96 | 20,39 | 13,96 | 7,3 | 32,98 | 1,31 | 70,811 | 1,316 |
| HD | 16,65 | 22,13 | 16,6 | 12,8 | 35,91 | 1,48 | 114,0 | 1,802 |
| HT | 22,92 | 17,63 | 17,7 | 37,13 | 1,57 | 158,62 | 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 | 17,1 | 38,35 | 1,67 | 162,50 | 2,23 |
| DT | 24.38 | 19,71 | 19,4 | 39,42 | 1,77 | 211,54 | 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 | 21,6 | 40,44 | 1,85 | 260,17 | 3,136 |
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице.
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1 H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1 ⁄2 + | 99,9885(70) | ||
| 2 H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1 + | 0,0115(70) | ||
| 3 H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1 ⁄2 + | β − | 18,591(1) кэВ | |
| 4 H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10 −22 с | 2 − | -n | 23,48(10) МэВ | |
| 5 H | 1 | 4 | 5,035 31(11) | более 9,1⋅10 −22 с | ( 1 ⁄2 + ) | -nn | 21,51(11) МэВ | |
| 6 H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10 −22 с | 2 − | −3n | 24,27(26) МэВ | |
| 7 H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10 −23 с | 1 ⁄2 + | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё. Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3−22 гигатонн/год).
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду.
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Применение
Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
Структура мирового потребления водорода (2007) (англ.)| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Около 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Нефтеперерабатывающая промышленность
В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов. Для этих целей используется порядка 37 % всего производимого в мире водорода.
Пищевая и косметическая промышленность
При производстве саломаса (твёрдый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Химические лаборатории
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удалённых мест.
Топливо
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Электроэнергетика
Водород применяется для охлаждения мощных электрических генераторов.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.