На что влияет дыхание
Влияние дыхательных упражнений на организм человека.
Дыхание является неотъемлемой частью нашей жизни. Это настолько привычный и естественный для нас процесс, что мы часто не придаём особого значения тому, как мы дышим. А ведь именно из-за неправильного дыхания часто образуются различные, в том числе и хронические заболевания. Недостаток кислорода в тканях ухудшает их состояние, замедляются внутренние процессы, и наш организм утрачивает силы, быстрее утомляется, стареет и не может противостоять различным вирусам и инфекциям, которые поражают его гораздо чаще, чем здоровый.
При рождении у человека закладывается правильный механизм дыхания, который постепенно утрачивается. Основными причинами сбоя в работе дыхательной системы являются: табакокурение, алкоголизм, наркомания и загрязнение окружающей среды. Нарушение функции дыхания в совокупности с нарушениями других систем организма приводит к развитию таких заболеваний как: бронхит, воспаление легких, бронхиальная астма, плеврит, эмфизема легких, сужение плевральной щели, рак легких. Нарушение ритма, частоты, типа, глубины и уровня дыхания, как правило, сопровождает не только заболевания собственно органов дыхания, но и болезни сердца, желудочно-кишечного тракта, нервной системы, крови и обмена веществ.
Спасением для большинства из нас станет дыхательная гимнастика, благодаря которой можно наладить работу организма и задействовать его в полную силу.
Дыхательная гимнастика — это совокупная система специальных дыхательных упражнений, направленных на укрепление здоровья и поднятия тонуса организма. В первую очередь, благодаря дыхательным упражнениям происходит насыщение организма кислородом, посредством газообмена в легких и транспортировки ко всем органам и системам для их стабильной работы.
При помощи дыхательной гимнастики можно справиться с переутомлением, бессонницей, чрезмерной усталостью, восстановить сердечный ритм. При систематических занятиях происходит нормализация давления у гипертоников в связи с возвращением тонуса стенок сосудов.
Прежде чем приступить к выполнению дыхательной гимнастики, нужно проконсультироваться со специалистом.
КОМПЛЕКС УПРАЖНЕНИЙ ПОДБИРАЕТСЯ ИНДИВИДУАЛЬНО.
Дышите правильно: как осознанное дыхание может улучшить ваше здоровье
Большинство людей дышат поверхностно, или «вертикально», в то время как глубокое, или «горизонтальное», дыхание практикуют только те, кто специально концентрируется на этом процессе на занятиях йогой или дыхательных практиках. Как улучшить здоровье с помощью правильного дыхания?
Правильное и неправильное дыхание
Наблюдая за детьми, вы обратите внимание, что они дышат животом. С возрастом люди теряют эту привычку и начинают дышать грудной клеткой. В этом заключается главная ошибка. Объем легких рассчитан на 4–6 л воздуха. При грудном дыхании человек вдыхает лишь 400–500 мл, при дыхании диафрагмой — 2–3 л.
Привычка дышать грудью не насыщает кислородом легкие, приводит к ослаблению мышц диафрагмы и ухудшению осанки: если область живота не включается в процесс дыхания, таз и ребра с возрастом начинают «стягиваться», а живот — проваливаться внутрь.
Дыхание диафрагмой позволяет увеличить объем вдыхаемого легкими воздуха и улучшить насыщение клеток организма кислородом. Это нормализует работу организма на всех уровнях: стабилизирует давление, работу сердца, снимает ощущения тревожности и нервозности.
Что такое осознанное дыхание
Чтобы помочь своим легким дышать полноценно, учиться этому процессу придется заново. Для начала нужно понять, что диафрагма помогает в процессе «горизонтального» дыхания. Человек не вдыхает воздух животом, но, подключая его к процессу дыхания, позволяет наполнять легкие по максимуму. Исследования показали [1], что практика осознанного дыхания по принципу 4-7-8 (вдох на четыре счета, задержка на семь и выдох на восемь) позволяет телу быстрее расслабиться, улучшает пищеварение и укрепляет иммунную систему.
Чтобы почувствовать работу диафрагмы, сядьте в удобную позу или лягте на пол, положите левую руку на грудь, а правую на живот. Почувствуйте, как живот поднимается и опускается, а грудь при этом остается неподвижной. Практикуя «горизонтальное» дыхание регулярно, старайтесь замедлять его до 10 циклов дыхания в минуту (1 цикл — вдох и выдох), постепенно увеличивая выдохи.
Как часто практиковать осознанное дыхание
Возьмите за привычку обращать внимание на дыхание несколько раз в день. Например, уделите несколько минут наблюдению за вдохами и выдохами утром, перед тем как встать с кровати, и вечером перед сном. Если получится, напоминайте себе о «горизонтальном» дыхании в течение дня и замечайте, как вы дышите в обычной жизни. Такая практика поможет вам дышать диафрагмой чаще, а значит насыщать кислородом свой организм, снимать стресс и улучшать сон.
После коронавируса: последствия для здоровья
Поскольку первые сравнительно крупные исследования пациентов, переболевших коронавирусом COVID-19, начали проводиться только с 2020 года, данные о долгосрочных клинических исходах еще не доступны, а прогнозы долгосрочных результатов, как подчеркивает физиолог Lindsay T. McDonald, в лучшем случае являются спекулятивными.
Тем не менее, в связи с ошеломляющим масштабом пандемии и тяжелыми последствиями коронавируса для некоторых групп пациентов, уже сейчас опубликованы первые результаты исследований и гипотезы о влиянии новой инфекции на здоровье взрослых и пожилых людей. В этой статье мы расскажем, с какими осложнениями сталкиваются пациенты, переболевшие COVID-19, чем эти осложнения опасны, и кто к ним предрасположен.
Как коронавирус влияет на легкие и дыхательную функцию
По данным открытой научно-исследовательской базы PubMed, наиболее распространенные осложнения после коронавируса (вирусной пневмонии) со стороны дыхательной системы, которые снижают качество жизни и сокращают функциональный объем главного дыхательного органа — это пневмофиброз и другие интерстициальные заболевания легких (ИЗЛ). Прогноз наименее благоприятный у пациентов, которые перенесли тяжелую пневмонию с обширным воспалением (КТ-3 и КТ-4) и диагностированным на КТ симптомом «булыжной мостовой». Выраженность фиброзных изменений может быть небольшой (при КТ-1 и КТ-2) — в этом случае пациент даже не почувствует, что в легких произошли изменения.
Фиброз — это защитная реакция организма на воспалительный процесс или травму. Она наблюдается приблизительно у 10-15% пациентов, переболевших вирусной пневмонией, ассоциированной с COVID-19. При фиброзе легких наблюдается патологическое разрастание соединительной ткани в альвеолярных капсулах и между ними (в интерстиции — легочном матриксе). В результате эластичная ткань дыхательного органа грубеет, образуются рубцы, сокращается пространство, предназначенное для кислорода.
Диффузный фиброз в разных сегментах приводит к деформации соединительнотканного каркаса легкого (по аналогии с ХОБЛ) и может существенно влиять на дыхание, вызывая непродуктивный кашель, одышку, резистентность к физическим нагрузкам.
Фиброз поддается консервативному лечению, но не всегда. По данным, описанным зарубежными медиками,* примерно 40% пациентов с диагностированными интерстициальными заболеваниями легких после коронавируса не восстанавливаются за 1 месяц, а нуждаются в реабилитации и дополнительном лечении, направленном на восстановление исходного объема легких.
Реабилитация после коронавируса с пневмофиброзом включает дыхательную гимнастику, ингаляции, физиопроцедуры, медикаментозную терапию. Зарубежные медики подчеркивают эффективность кортикостероидных препаратов при фиброзе легких, если у пациента нет противопоказаний.
При длительном фиброзном поражении легких у некоторых пациентов развивается тромбоз легких. Британские медики отмечают, что тромбоз легких или тромбоэмболия легочной артерии (ТЭЛА) относится к жизнеугрожающим состоянием. Почти половина пациентов, которые перенесли коронавирус в острой форме, страдают от легочной эмболии или кровяных сгустков в легких.
*Persistent Post-COVID-19 Interstitial Lung Disease. An Observational Study of Corticosteroid Treatment
Предрасположенность к тяжелому течению вирусной пневмонии с последующим развитием идиопатического фиброза зависит от:
*Peter M. George., Athol U. Wells, R. Gisli Jenkins, Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy, 2020
Таким образом, у некоторых пациентов, переболевших вирусной пневмонией, вызванной COVID-19 в острой и тяжелой форме, на КТ могут быть выявлены признаки интерстициальных изменений легких, к которым относится и фиброз легких. К радиологическим признакам в данном случае относится усиление легочного рисунка — уплотнение альвеолярных капсул, интерстиция, нарушение структуры легочного матрикса.
Следствием обширного диффузного фиброза является стойкая дыхательная недостаточность, одышка, кашель — то есть утрата отдельных функциональных участков легких. На лечение пневмофиброза могут уйти месяцы (от 3 до 12), а иногда рубцевание легочной ткани носит необратимый характер.
Противофиброзная терапия включает дыхательную гимнастику, физиопроцедуры, стероидные препараты, ингаляции, коррекцию образа жизни. Тактика лечения и сроки реабилитации определяются врачом-пульмонологом. Специалист изучает анамнез и жалобы пациента, делает функциональные пробы, изучает КТ-изображения.
Остаточные респираторные симптомы после коронавируса (одышка, ощущение неполного вдоха, боль в горле) могут беспокоить пациента в течение 1-2 месяцев после того, как он переболел пневмонией. Если улучшений нет, рекомендуется сделать КТ легких или другое обследование, рекомендованное пульмонологом, терапевтом или ЛОР-врачом — в зависимости от жалоб.
Как коронавирус влияет на сердце и сосуды
Легкие и сердце связаны малым кругом кровообращения. Обогащенная кислородом кровь транспортируется по легочным капиллярам, артериям и венам к сердцу. Повреждение легких провоцирует кислородное голодание, которое отрицательно сказывается на работе внутренних органов, однако этот фактор является лишь второстепенным для развития сердечно-сосудистых осложнений.
Преобладающее большинство исследователей сходятся во мнении, что респираторные осложнения более распространены среди пациентов, перенесших коронавирус, чем функционально-кардиологические. Тем не менее, доказано, что коронавирус может привести к острому инфаркту миокарда, сердечной недостаточности, миокардиту. Наименее благоприятный прогноз наблюдается у людей преклонного возраста и пациентов с ранее диагностированными сердечно-сосудистыми заболеваниями.
Вирус COVID-19 закрепляется на поверхности внутренних органов к белковому рецептору ACE2, который сконцентрирован как в легочной паренхиме, так и в клетках сердечной мышцы. Примерно через неделю после заражения, при отсутствии антител и адекватной противовирусной терапии, вирус начинает циркулировать и в крови. Ситуация усугубляется из-за мощного цитокинового ответа — иммунитет человека убивает не только вирионы, но и собственные защитные клетки. Агрессивная атака вируса может привести к повреждению миокарда, а образование тромбов (сгустков крови) — к острому нарушению кровотока. С другой стороны, в ряде исследований сказано, что некоторые лекарственные препараты, применяемые в рамках противовирусной терапии, провоцируют аритмию и декомпенсацию сердечной деятельности у некоторых пациентов. Поэтому противовирусная терапия у пациентов с кардиологическими нарушениями непременно включает сердечно-сосудистые препараты.
У пациентов, переболевших COVID-19, может длительное время сохраняться повышенная свертываемость крови, что повышает риск ТЭЛА, тромбоза глубоких вен, инфаркта миокарда. Для профилактики острого нарушения кровообращения врачи назначают при коронавирусе препараты, разжижающие кровь (низкомолекулярные гепарины).
Индикатором повреждения сердечной мышцы у пациентов, переболевших коронавирусом, является повышенное содержание белкового фермента тропонина в крови. Наиболее интенсивно этот фермент выделяется в кровь при инфаркте миокарда.
Поскольку анатомически легкие и сердце связаны венами и артериями, идущими к левому и правому предсердию, которые расположены в верхней части сердечной мышцы, то повреждения, воспалительные очаги, другие аномалии после коронавируса в первую очередь обнаруживаются именно в этих отделах.
В научно-исследовательской литературе есть данные, что коронавирус у пациентов, имеющих на момент заражения проблемы со здоровьем (в частности заболевания сердца и сосудов), может вызвать кардиогенный шок и синдром такоцубо (синдром «разбитого сердца»), при котором верхушки органа сильно расширяются, а левый желудочек начинает сокращаться очень быстро. Пациент ощущает это как острый сердечный приступ. Однако, в отличие от инфаркта, последствия синдрома такоцубо обратимы и редко носят летальный характер.
Таким образом, прямое вирусное поражение миокарда, гипоксия, гипотензия, обширное системное воспаление, подавление рецепторов ACE2, токсичность лекарств, закупорки сосудов тромбами — основные механизмы, ответственные за повреждение сердца и сосудов.
Если после перенесенной вирусной инфекции и пневмонии у пациента наблюдаются боли в области грудной клетки, перепады артериального давления, учащение сердцебиения на фоне одышки, обморочные состояния на фоне общей слабости — следует не теряя времени обратиться к врачу.
Как коронавирус влияет на центральную нервную систему
Ученые долгое время были озадачены вопросами: может ли коронавирус вызывать воспалительные процессы в головном мозге, и почему у больных встречаются «необычные» и на первый взгляд никак не связанные симптомы: нарушение обоняния, невралгии, синдром хронической усталости?
Исследователи выяснили, что у людей, больных, а иногда и у переболевших коронавирусом, в крови заметно превышен уровень маркеров воспаления (неоптерина и микроглобулина бета-2), а также уровень маркера NfL, который указывает на повреждение нервных клеток, однако никаких признаков инфекции в самом головном мозге выявлено не было. Ученые не обнаружили изменений и в составе спинномозговой жидкости у обследуемых людей. Медики подтверждают, что коронавирус может оказывать влияние на ЦНС, однако не напрямую, а косвенно — клетки нервной системы погибают из-за избыточно сильного иммунного ответа организма (цитокинового шторма).
Потеря обоняния при COVID-19 вызвана тем, что вирус повреждает нервные окончания (рецепторы), которые отвечают за перцепцию запахов. Восстановление этой функции может занять от пары недель до 18 месяцев. Обоняние возвращается по мере регенерации нервных клеток. Некоторые пациенты в процессе реабилитации описывают искаженные запахи и вкусы, что говорит лишь о частичном восстановлении. Чтобы ускорить регенерацию обонятельных рецепторов пациентам рекомендуют нюхать предметы с яркими ароматами: эфирные масла розы и мяты, шоколад, кофе и др.
У пациентов, которые перенесли заболевание в крайне тяжелой форме, находились под аппаратами ИВЛ и проходили интенсивную терапию, могут наблюдаться серьезные когнитивно-психологические нарушения, вызванные истощением нервной системы. Человек может испытывать депрессию, тревожность и проблемы со сном, памятью, концентрацией — вплоть до утраты способности к обучению, трудоспособности, сложностей с выполнением повседневных задач. В международной научно-исследовательской литературе подчеркивается особая значимость депрессивного расстройства у пожилых людей. Для описания состояния нервного истощения у пациентов, перенесших тяжелый ковид предложены термины «синдром хронической усталости» и «миалгический энцефаломиелит».
Наибольшую угрозу для головного мозга представляют тромбы сосудов, которые могут образоваться из-за нарушения свертываемости крови в связи COVID-19. Закупорка сосудов, питающих головной мозг, приводит к транзиторной ишемической атаке или к инсульту — в результате клетки органа погибают.
Как коронавирус влияет на сон
Российские сомнологи отмечают, что во время пандемии до 45% возросло количество пациентов с жалобами на бессонницу и нарушение сна. У этого явления несколько причин:
Чтобы восстановить здоровый сон, необходимо первично выявить причину его нарушения. Одним пациентам рекомендована психотерапия, другим необходимы медикаменты и специальные препараты (снотворное, мелатонин, витаминные комплексы с магнием, витамины B12, D), а третьим — комплексное решение проблем со здоровьем (восстановление легких, дыхания, нормализация жизненных показателей). При легком нарушении сна помогут фитопрепараты и ванны с магнием перед сном.
Сколько времени занимает восстановление после коронавируса
Время восстановления после коронавируса зависит от индивидуальных особенностей организма и клинической картины. Большинство пациентов, которые перенесли коронавирус в легкой форме с пневмонией (КТ-1 и КТ-2), возвращаются к обычной жизни уже через 1 месяц.
Остаточные респираторные симптомы (затрудненное дыхание, ощущение неполноты вдоха) могут беспокоить около 2-х месяцев, после чего, в большинстве случаев, проходят самостоятельно.
Тактику лечения и сроки реабилитации определяются лечащим врачом: пульмонологом, кардиологом, неврологом и др.
Когда делать контрольную КТ после коронавируса
Если в легких выявлены очаговые интерстициальные и фиброзные изменения, рекомендуется сделать контрольную компьютерную томографию после курса лечения. При полисегментарном пневмофиброзе терапия длится до 12 месяцев. Таким образом, окончательно оценить выраженность фиброзных изменений на КТ можно только через год.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
На что влияет дыхание
3.1 Нервная регуляция дыхания
Дыхательный центр представляет собой совокупность нейронов продолговатого мозга, обладающих ритмической активностью и определяющих ритм дыхательных движений. Бульбарный дыхательный центр выполняет две основные функции:
1) регуляцию двигательной активности дыхательных мышц (двигательная функция);
2) гомеостатическую, связанную с изменением характера дыхания при сдвигах газового состава и кислотно-основного равновесия в крови и тканях.
Двигательная функция дыхательного центра заключается в генерации дыхательного ритма и его паттерна (длительности вдоха, выдоха, величины дыхательного объема).
Нейроны дыхательного центра расположены в дорсомедиальной и вентролатеральной областях продолговатого мозга, образуя так называемую дорсальную и вентральную дыхательные группы. В указанных дыхательных группах расположены следующие виды нейронов:
1) ранние инспираторные, максимальная частота разряда которых приходится на начало инспирации;
2) поздние инспираторные нейроны, максимальная частота разряда – в конце инспирации;
3) полные инспираторные нейроны, характеризующиеся постоянной активностью в течение фазы вдоха;
4) постинспираторные нейроны, максимальный разряд которых обнаруживается в течение выдоха;
5)экспираторные нейроны, активность которых возрастает во второй части выдоха;
6) преинспираторные нейроны, максимальный пик активности проявляют перед началом вдоха.
В структурах бульбарного дыхательного центра различают так называемые респираторно-связанные нейроны, активность которых совпадает с ритмом дыхания, но они не иннервируют дыхательные мышцы, а обеспечивают иннервацию верхних дыхательных путей.
В соответствии с локализацией нейронов бульбарного дыхательного центра, различают дорсальную дыхательную группу (ДДГ) и вентральную дыхательную группу (ВДГ). Нейроны дорсальной дыхательной группы получают афферентные сигналы от легочных рецепторов растяжения по волокнам n. Vagus. Только часть инспираторных нейронов дорсальной группы дыхательного центра связана аксонами с дыхательными мотонейронами спинного мозга, преимущественно с контрлатеральной стороной.
Вентральная дыхательная группа расположена латеральнее обоюдного ядра продолговатого мозга, подразделяется на ростральную и каудальную части. Причем, ростральная часть вентральной дыхательной группы представлена ранними, поздними, полными инспираторными и постинспираторными нейронами.
Дорсальная и вентральная группы нейронов в правой и левой половинах продолговотого мозга взаимосвязаны как в пределах одной половины, так и с нейронами противоположной стороны. В синхронизации деятельности контрлатеральных нейронов бульбарного дыхательного центра участвуют проприобульбарные нейроны и экспираторные нейроны комплекса Бетцингера.
Таким образом, нейроны бульбарного дыхательного центра в зависимости от их значимости в регуляции внешнего дыхания разделяют на три группы:
1) нейроны, иннервирующие мышцы верхних дыхательных путей и регулирующие поток воздуха в дыхательных путях;
2) нейроны, синаптически связанные с мотонейронами спинного мозга и регулирующие активность мышц вдоха и выдоха;
3) проприобульбарные нейроны, участвующие в генерации дыхательного ритма, аксоны которых обеспечивают связь только с нейронами продолговатого мозга.
Подобно многим физиологическим системам контроля, система управления дыханием организована как контур отрицательной обратной связи.
Афферентация с различных рецепторных зон интегрируется в бульбарном дыхательном центре. Последний, в свою очередь, генерирует импульсацию к мотонейронам спинального отдела дыхательного центра, регулирующего сократительную активность дыхательной мускулатуры.
Важная роль в регуляции внешнего дыхания отводится центрам варолиева моста, в частности, пневмотаксическому центру. Последний включает медиальное, парабрахиальное ядро и ядро Келликера. В парабрахиальном ядре находятся преимущественно инспираторные, экспираторные и фазопереходные нейроны. Ядро Келликера содержит инспираторные нейроны.
Дыхательные нейроны моста участвуют в механизмах смены фаз дыхания, регулируют величину дыхательного объема.
Непосредственными регуляторами сократительной способности дыхательных мышц являются спинальные мотонейроны, получающие информацию по нисходящим ретикулоспинальным путям от бульбарного дыхательного центра.
Как известно, нейроны диафрагмального нерва расположены узким столбом в медиальной части вентральных рогов от СIII до CV. Подавляющее количество волокон диафрагмального нерва являются аксонами α-мотонейронов, а меньшая часть представлена афферентными волокнами мышечных и сухожильных веретен диафрагмы, а также рецепторов плевры, брюшины и свободных нервных окончаний самой диафрагмы.
Мотонейроны, иннервирующие межреберные мышцы, расположены в передних рогах спинного мозга на уровне TIV-TX, из них часть нейронов регулирует сокращения межреберных мышц, а другая часть – их позно-тоническую активность.
Обращает на себя внимание тот факт, что активность спинальных мотонейронов, обеспечивающих регуляцию двигательной активности межреберных мышц и диафрагмы, в свою очередь, находится под контролем инспираторных нейронов спинного мозга, расположенных на уровне СI-CII вблизи латерального края промежуточной зоны серого вещества.
В обеспечении дыхания, особенно в условиях патологии, участвуют мышцы брюшной стенки, получающие иннервацию от мотонейронов спинного мозга на уровне TIV-LIII.
Двум фазам внешнего дыхания (вдоху и выдоху) соответствуют три фазы активности бульбарного дыхательного центра: инспирация, пассивная контролируемая экспирация и активная экспирация. Во время фазы инспирации диафрагма и наружные межреберные мышцы увеличивают силу сокращения, активируются мышцы гортани, расширяется голосовая щель, снижается сопротивление потоку воздуха. В постинспираторную фазу дыхания происходит медленное расслабление диафрагмы, сокращение мышц гортани, выход воздуха в окружающую среду.
В фазе экспирации – экспираторный поток усиливается за счет сокращения внутренних межреберных мышц и мышц брюшной стенки.
Рефлекторная регуляция дыхания обеспечивается за счет афферентной импульсации в бульбарный дыхательный центр с различных рецепторных зон. Мощной рефлексогенной зоной является слизистая оболочка полости носа, где расположены различные типы механорецепторов, в том числе ирритантные, растяжения, а также болевой чувствительности, обоняния.
Возбуждение этих рецепторов возникает в момент каждого вдоха и приводит к формированию потока афферентной импульсации в ретикулярную формацию ствола мозга с последущей активацией бульбарного дыхательного центра, сосудодвигательного центра, гипоталамических и корковых структур мозга.
Раздражение ирритантных рецепторов слизистой оболочки носа приводит к рефлекторному сужению бронхов, голосовой щели, остановке дыхания на выдохе, развитию брадикардии, а в ряде случаев прекращению сердечных сокращений и другим изменениям (тормозной тригемино-вагусный рефлекс Кречмера ).
Слизистая трахеи и бронхов является слабой рефлексогенной зоной. В стенке крупных внелегочных бронхов и трахеи имеются высокопороговые, низкочувствительные медленноадаптирующиеся, быстроадаптирующиеся и промежуточные механорецепторы, в норме их роль в регуляции дыхания минимальна.
Чувствительность этих рецепторов возрастает при развитии воспалительного процесса в бронхолегочной системе инфекционной или аллергической природы, когда освобождаются медиаторы воспаления и аллергии: гистамин, кинины, лейкотриены, простагландины и др.. Возбудимость рецепторов трахеи и бронхов возрастает и в случае застойных явлений в малом кругу кровообращения, когда прежние объемы воздуха сильно растягивают стенки воздухоносных путей. Афферентация с рецепторов трахеи и бронхов направляется в бульбарный дыхательный центр по чувствительным волокнам n. Vagus, модулируя глубину и частоту дыхательных движений.
Мощной рефлексогенной зоной является паренхима легких, обеспечивающая не только альвеолярное дыхание, но и рефлекторную регуляцию внешнего дыхания.
Основные типы легочных вагусных афферентов включают: медленноадаптирующиеся рецепторы растяжения альвеол, быстроадаптирующиеся рецепторы, С-волокна.
Многочисленные быстроадаптирующиеся рецепторы (БАР) находятся в эпителии внутрилегочных бронхов и бронхиол. Эти рецепторы наиболее чувствительны к следующим типам раздражителей: ирритантным воздействиям, повреждению паренхимы и механическому раздражению дыхательных путей. Возбуждение БАР возникает также при глубоком дыхании, легочной эмболии и капиллярной гипертензии. Афферентация с этих рецепторов распространяется по чувствительным маломиелинизированным волокнам n. Vagus в ретикулярную формацию ствола мозга и бульбарный дыхательный центр, вызывая бронхоконстрикцию, тахипноэ, развитие кашля и тахикардии. Возбуждение этих рецепторов может быть клинически значимым в патогенезе бронхиальной астмы и нарушениях реактивности дыхательных путей.
По данным ряда авторов в паренхиме легких выделяют и БАР рецепторы спадения, реагирующие на спадение альвеол под воздействием внутрилегочных и внелегочных факторов. Афферентация с этих рецепторов поступает в бульбарный дыхательный центр по маломиелинизированным волокнам n. Vagus и обеспечивает развитие тахипноэ.
Медленноадаптирующиеся рецепторы растяжения – важная группа механорецепторов c вагусной афферентацией, расположенных в гладких мышцах воздухоносных путей. Частота импульсов с этих рецепторов возрастает по мере растяжения альвеол вдыхаемым воздухом и распространяется по толстым миелинизированным α-волокнам n. Vagus в бульбарный дыхательный отдел, обеспечивая формирование рефлекса Геринга-Брейера. Последний контролирует частоту и глубину дыхания, имеет физиологическое значение при дыхательных объемах превышающих 1 л (у взрослых при физической нагрузке). Рефлекс Геринга-Брейера более важен для регуляции дыхательного акта у новорожденных, а также в условиях патологии как один из механизмов реализации инспираторной, экспираторной и смешанной одышек.
Третьей группой легочных механорецепторов являются С-волокна – тонкие миелинизированные вагусные афференты. С – волокна оканчиваются в паренхиме легких, в бронхах и кровеносных сосудах, активируются экзогенными раздражителями и медиаторами альтерации. Активация С-волокон приводит к тахипноэ, брадикардии, гиперсекреции слизи. В состав С-волокон входят J-рецепторы, расположенные в альвеолярных перегородках в контакте с капиллярами (юкстакапиллярные рецепторы), чувствительные к интерстициальному отеку, легочной венозной гипертензии, микроэмболии, раздражающим газам и ингаляционным наркотическим веществам. Активация J-рецепторов вызывает закрытие гортани и апноэ, за которыми следует частое поверхностное дыхание, гипотензия и брадикардия.
Важная роль в рефлекторной регуляции дыхания отводится проприорецепторам суставов грудной клетки, межреберных мышц, диафрагмы, сухожильным рецепторам. Недостаточное укорочение инспираторных или экспираторных мышц усиливает импульсацию от мышечных веретен, которая через α-мотонейроны повышает активность α-мотонейронов и дозирует таким образом мышечное усилие.
В регуляции активности бульбарного дыхательного центра и внешнего дыхания принимает участие и афферентация с висцеральных рецепторов и рецепторов кожи, о чем свидетельствует развитие гипервентиляции легких при болевом и термическом раздражении.
3.2. Механизмы гуморальной регуляции дыхания
Важная роль в регуляции дыхания отводится хеморецепторам.
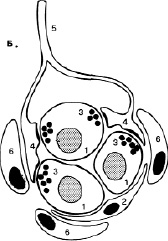
Изменения газового состава крови (РаО2, РаСО2) влияют на активность дыхательного центра путем возбуждения хеморецепторов каротидных и аортальных телец (периферические рецепторы), а также хеморецепторов вентральной зоны продолговатого мозга и дорсального дыхательного ядра (центральные рецепторы). Периферические хеморецепторы (рис.5) обеспечивают регуляцию частоты дыхательных движений. Адекватным раздражителем для них является уменьшение РО2 артериальной крови, в меньшей степени – увеличение РСО2 и снижение рН. Периферические хеморецепторы расположены у бифуркации общих сонных артерий на внутреннюю и наружнюю. Несмотря на свой миниатюрный размер, каротидные тельца интенсивно кровоснабжаются (1,4-2 л/мин на 100 г ткани). Этот орган особенно чувствителен к колебаниям кислорода в артериальной крови. При Ра О2 в пределах 60-80 мм рт. ст. наблюдается слабое усиление вентиляции, при Ра О2 ниже 50 мм рт. ст. возникает выраженная гипервентиляция легких. Ра СО2 и рН крови потенцируют эффекты гипоксемии на артериальные хеморецепторы и не являются адекватными раздражителями для этих рецепторов. После двустороннего удаления каротидных телец гипоксический вентиляторный ответ у человека исчезает. При отсутствии хеморецепторной стимуляции, например, при глубокой гипокапнии, повреждении синокаротидной зоны (опухоли, коллагенозы, травмы) ритмогенез дыхания снижается и полностью прекращается.
Рис. 5. Каротидное тельце: 1-хеморецепторные клетки; 2-поддерживающие клетки; 3-синаптические пузырьки; 4-чувствительные нервные окончания; 5-нервное волокно
Центральные хемочувствительные клетки реагируют на отклонения РСО2 и [H+] во внеклеточной жидкости внутримозгового интерстициального пространства, регулируют глубину вдоха. Гиперкапния и ацидоз стимулируют, а гипокапния и алкалоз тормозят центральные хеморецепторы.
Одной из причин высокой скорости вентиляторного ответа на гиперкапнию является легкость диффузии СО2 через барьерную систему кровь-головной мозг. Более того, повышенное РСО2 вызывает расширение сосудов, особенно церебральных, способствуя тем самым усилению диффузии СО2 через гемато-энцефалический барьер.