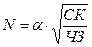На что влияет наличие частиц трудно растворимых примесей в растворе расплаве
Теоретические основы процесса кристаллизации металлов
МАТЕРИАЛОВЕДЕНИЕ
Методические указания
к лабораторным работам по дисциплине
Кафедра «Машиностроение и материаловедение»
секция «Материаловедение и технология конструкционных материалов»
Лабораторная работа № 2
Изучение процесса кристаллизации
Цель работы: изучить процесс кристаллизации капель раствора четырёх солей. Сравнить строение закристаллизовавшейся капли раствора нитрата свинца со строением слитка спокойной стали.
Содержание работы
Теоретические основы процесса кристаллизации металлов
Процесс образования кристаллов называется кристаллизацией. Визуальное изучение кристаллизации металлов сопряжено с техническими трудностями. Поскольку законы кристаллизации растворов солей и расплавленных металлов сходны, изучение процесса кристаллизации можно проводить на растворах солей.
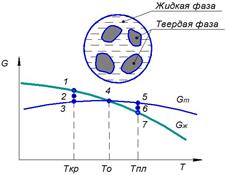
Согласно законам термодинамики, устойчивым состоянием при определённых внешних условиях будет то состояние, которое обладает меньшим уровнем свободной энергии. Под свободной энергией понимают часть внутренней энергии, которая может быть превращена в работу. При изменении внешних условий (например, при понижении температуры) любая система самопроизвольно стремится к состоянию с наименьшим уровнем свободной энергии.
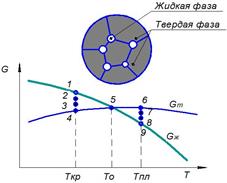
 | Рис. 2.1. Изменение свободной энергии жидкого Gж и твёрдого Gт состояния в зависимости от температуры: Ткр − фактическая температура кристаллизации, То − теоретическая (равновесная) температура кристаллизации и плавления, ΔТ − степень переохлаждения, Тпл − фактическая температура плавления, ΔТ ‘ − степень перегрева |
С изменением температуры свободная энергия жидкого Gж и твёрдого Gт состояния изменятся по разным законам (рис. 2.1). При высоких температурах жидкое состояние обладает меньшей свободной энергией, поэтому металл при этих температурах находится в жидком состоянии (области III, IV). При охлаждении металл достигнет температуры Т0, при которой свободные энергии жидкого и твёрдого состояния равны. Эта температура Т0 носит название теоретической (равновесной) температуры кристаллизации при охлаждении и температуры плавления при нагреве.
При Т0 процесс кристаллизации протекать не может. Для развития процесса кристаллизации надо создать условия, при которых свободная энергия твёрдого состояния будет меньше, чем свободная энергия жидкого состояния. Это возможно лишь при охлаждении ниже Ткр, т. е. ниже теоретической температуры кристаллизации на некоторую величину ΔТ. В области II металл при охлаждении продолжает оставаться в жидком состоянии, поскольку разность (Gж – Gт) не велика и температура не достигла критического значения Ткр при котором твёрдое состояние обладает меньшей свободной энергией. При достижении Ткр разность (Gж – Gт) увеличивается, поэтому оставаться дальше в жидком состоянии металл не может, и при этой температуре в металле самопроизвольно начинается процесс кристаллизации.
В области I (рис. 2.1) металл будет находиться в твердом состоянии. Температура Ткр носит название фактической температуры кристаллизации, а разность между теоретической и фактической температурами 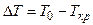
Для развития процесса плавления необходима некоторая степень перегрева

где Тпл – фактическая температура плавления.
Д. К. Чернов ещё в 1878 году показал, что кристаллизация складывается из двух элементарных процессов (рис. 2.2). Первый процесс заключается в образовании из жидкого раствора мельчайших кристаллических частиц-зародышей или центров кристаллизации. Интенсивность этого процесса определяется числом зародышей ЧЗ, возникающих в единице объёма (1 мм 3 ) за единицу времени (1 с). Второй процесс состоит в росте кристаллов из зародышей. Интенсивность этого процесса определяется скоростью кристаллизации (СК) – линейным перемещением грани кристалла (в миллиметрах) в единицу времени (1 с).
Рис. 2.2. Последовательные этапы процесса кристаллизации
Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов. В месте соприкосновения кристаллов рост отдельных их граней прекращается и развиваются не все, а только некоторые грани кристаллов. В результате кристаллы не имеют правильной геометрической формы и называются кристаллитами или зернами.
Процессы образования зародышей и роста кристаллов протекают одновременно, причём интенсивность их зависит от степени переохлаждения. При данной степени переохлаждения величины ЧЗ и СК – постоянные в течение всего времени процесса кристаллизации.
Размер полученных кристаллов N зависит от соотношения ЧЗ и СК при данной степени переохлаждения и выражается формулой
При малой степени переохлаждения ΔТ1 (рис. 2.3) кристаллы после затвердевания будут крупными, так как ЧЗ мало, а СК велика. При большой степени переохлаждения ΔТ2 кристаллы будут мелкими, так как кристаллизация в этом случае идёт при почти той же СК, что и в первом случае, но при значительно большем ЧЗ.
Таким образом, изменяя степень переохлаждения, можно получить кристаллы разной величины.
Степень переохлаждения зависит от скорости охлаждения. Чем больше скорость охлаждения, тем больше степень переохлаждения и мельче кристаллы. В реальных условиях затвердевания больших масс металла на процесс кристаллизации, размер и форму кристаллов оказывают влияние и другие факторы: твёрдые взвешенные тугоплавкие частицы примесей, инородные тела, газовые включения, теплоёмкость самого металла, направление отвода тепла, конвекционные потоки в жидком металле, температура заливаемого металла и формы, способы заливки, состояние поверхности изложницы (формы) и другие.
Форма растущих кристаллов определяется не только условиями их столкновений между собой, но и составом сплава, наличием примесей и условиями охлаждения. В большинстве случаев при кристаллизации металлов механизм образования кристаллов носит так называемый дендритный характер.
 | Рис. 2.3. Зависимость ЧЗ и СК от степени переохлаждения при кристаллизации металлов |
Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях решетки, которые имеют наибольшую плотность упаковки атомов (минимальное межатомное расстояние). В этих направлениях образуются длинные ветви будущего кристалла − так называемые оси первого порядка (1 на рис. 2.4).
В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называют осями второго порядка (2), от осей второго порядка растут оси третьего порядка (3) и т. д.
По мере кристаллизации образуются оси более высокого порядка (четвертого, пятого, шестого и т. д.), которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
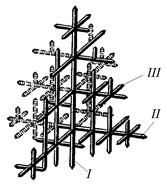 | Рис. 2.4. Схема дендритного роста кристалла |
Если жидкого металла не хватает для заполнения межосных пустот, то древовидная форма кристаллов сохраняется. Такие дендриты можно обнаружить в усадочных раковинах и на свободной поверхности слитков. Если жидкого металла достаточно для заполнения межосного пространства, то образуются крупные кристаллы, вытянутые в направлении главного теплоотвода. Такие кристаллы называются столбчатыми.
При равномерном теплоотводе, а также при большом числе зародышей, кристаллы растут с одинаковой скоростью по всем направлениям и вырастают равнооcными.
Процесс кристаллизации слитка спокойной стали (рис. 2.5, а) начинается у стенок изложницы и последовательно продвигается к центру слитка.
У стенок изложницы (рис. 2.5, б) образуется зона 1 − зона мелких равноосных, беспорядочно направленных кристаллов. Мелкие кристаллы получаются, благодаря быстрому охлаждению ещё холодной стенкой прилегающих слоев жидкой стали.
Поэтому кристаллизация здесь идёт при большой степени переохлаждения, при большом числе зародышей. Кристаллы получаются равноосными, беспорядочно направленными, потому что оси первого порядка растут перпендикулярно неровностям внутренней поверхности изложницы. Растущие кристаллы сталкиваются между собой и образуют зону мелких дезориентированных кристаллов.
Следующая зона 2 − зона столбчатых кристаллов − крупных кристаллов, главная ось которых перпендикулярна стенке изложницы. Кристаллы получаются крупными, так как в этой зоне скорость охлаждения меньше, чем в зоне 1, т. к тепло отводится не холодной стенкой, а через зону 1 и уже нагревшуюся стенку изложницы.
Поэтому кристаллизация здесь идёт с меньшей степенью переохлаждения с меньшим числом зародышей. Кристаллы вытянуты главной осью перпендикулярно стенке изложницы, так как в этом направлении идет главный теплоотвод. В центре слитка образуется зона 3 − зона крупных равноосных кристаллов. В этой части слитка скорость охлаждения меньше, чем в зоне 1 и 2, поэтому кристаллизация идет при малой степени переохлаждения, при малом числе зародышей. Кристаллы этой зоны получаются равноосными, произвольно ориентированными, так как отвод тепла идет во всех направлениях с одинаковой скоростью. Скелетом этих крупных кристаллов являются дендриты (рис. 2.5, а).
Кристаллизация солей
В настоящей работе студенты изучают процесс кристаллизации четырёх солей: нитрата свинца Рb(NO3)2, хлорида аммония NH4Cl, дихромата калия К2Сr2O7 (хромпик), хлорида натрия NaCl (поваренная соль), вызванный испарением растворителя.
Водные растворы этих солей приготавливаются почти насыщенными с тем, чтобы незначительное испарение воды привело их к состоянию перенасыщения и выделению кристаллов.
 | Рис. 2.6. Схема хода лучей в биологическом микроскопе: I – зеркало; 2 – предметный столик; 3 – предметное стекло; 4 – капля соли; 5 – объектив; 6 – окуляр |
Наблюдение за процессом кристаллизации солей производится с помощью биологического микроскопа, работающего по принципу проходящего света (рис. 2.6). Лучи от естественного источника света, отразившись от зеркала микроскопа, проходят через отверстие предметного столика, предметное стекло, каплю соли и попадают в объектив. Полученное в объективе изображение капли увеличивается им и окуляром. Пройдя через окуляр, лучи попадают в глаз наблюдателя. Наблюдение за кристаллизацией капель в этой работе проводится при увеличении, но более чем в 100 раз.
Порядок выполнения работы
1. Глядя в окуляр, вращать зеркало микроскопа, добиваясь яркого освещения (получить светлое поле).
2. Предметное стекло с нанесенной на него каплей соли установить на предметный столик так, чтобы капля была в центре отверстия предметного столика.
3. Произвести грубую настройку на фокус, для чего смотреть одним глазом в окуляр и держа второй глаз открытым, вращать винт грубой подачи, поднимая тубус до тех пор, пока не появится изображение капли.
4. Вращением микрометрического винта произвести тонкую настройку на фокус.
5. Перемещать предметное стекло по предметному столику, наблюдая за кристаллизацией сначала у краёв капли, а затем в центре капли.
6. По мере появления кристаллов производить зарисовку к журнал, передавая при этом особенности их строения.
 | Рис. 2.7. Строение затвердевшей капли раствора нитрата свинца: 1 – мелкие равноосные кристаллы, 2 – крупные вытянутые кристаллы, 3 – дендриты |
7. Исследование начинать с капли нитрата свинца, так как его кристаллизация идёт аналогично кристаллизации слитка спокойной стали. Наибольшее испарение возникает у краёв капли, так как тут уровень жидкости наименьший, а концентрация соли раньше, чем в других местах, достигает предела насыщения. Здесь образуются мелкие равноосные кристаллы. Они настолько мелкие, что при используемом в данной работе увеличении каждый кристалл не виден, и эта зона чаще всего просматривается в виде тонкой тёмной линии (рис. 2.7.)
Затем начинают образовываться крупные, вытянутые нормально к краям капли, столбчатые кристаллы. Здесь кристаллизация идёт при большой скорости и ограниченном числе зародышей.
В последнюю очередь кристаллизация идёт в центре капли, где образуются крупны кристалла, имеющие форму дендритов.
Контрольные вопросы
1. На рис. 2.1 укажите:
· теоретическую температуру кристаллизации (плавления) металла;
· фактическую температуру кристаллизации (плавления) металла;
· необходимое условие, при котором начнётся процесс кристаллизации (процесс плавления) металла;
· область температур, в которых металл будет находиться в агрегатных состояни 
а) жидком при охлаждении;
б) твёрдом при охлаждении;
в) твёрдом при нагреве;
г) жидком при нагреве,
2. На рис. 2.3 укажите, при какой величине переохлаждения металл закристаллизуется наиболее крупнозернистым (наиболее мелкозернистым).
3. Укажите среду закристаллизовавшегося раствора соли: а) Рb(NO3)2, б) NH4Cl; в)К2Сr2O7; г) NaCl. Объясните особенности её строения.
4. Укажите форму и схему строения закристаллизовавшейся капли водного раствора соли, схожую со структурой слитка спокойной стали. Объясните особенности ее строения.
Тестовые вопросы
1. Часть внутренней энергии, которая может быть превращена в работу, называется?
2. Первичная кристаллизация – это?
4. При изменении внешних условий устойчивым будет состояние, обладающее?
5. Укажите на графике точку, соответствующую состоянию металла (см. схемы структур на рис.) в процессе охлаждения и в процессе нагревания.
 |  |
| а | б |
 |  |
| в | г |
 | |
| д |
6. Укажите запас свободной энергии металла в начале (конце) процесса плавления (кристаллизации).
 |
7. Укажите агрегатное состояние в областях I–IV при охлаждении или нагревании:
 |
8. Укажите фактические и теоретические температуры кристаллизации (плавления).
 |
9. Укажите структуру металла, соответствующую точкам 1-7 на графике.
 | |
| 10. Укажите, при какой величине переохлаждения металл закристаллизуется наиболее крупнозернистым (мелкозернистым)? |  |
| 11. Укажите расположение зон в слитке в порядке их образования. | 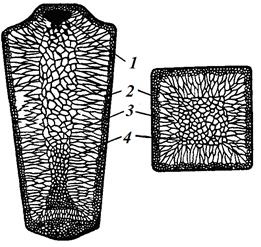 |
12. На что влияет наличие частиц трудно растворимых примесей в растворе (расплаве)?
13. Как влияет температура окружающей среды (подогрев солей) на размеры кристаллов и возможность образования труднорастворимых частиц?
13. В каком направлении происходит образование дендритов?
14. Как называются кристаллы, расположенные строго в направлении главного теплоотвода?
15. Какие кристаллы образуются при замедленном охлаждении, происходящем при равномерном отводе теплоты во всех направлениях?
16. Какие кристаллы образуются при ускоренном охлаждении, происходящем при равномерном отводе теплоты во всех направлениях?
17. Где начинается процесс образования кристаллов?
18. Какая из солей, использующихся в лабораторной работе, кристаллизуется подобно слитку спокойной стали?
19. Какая из солей, использующихся в лабораторной работе, кристаллизуется по дендритной схеме?
Лабораторная работа № 3
Построение диаграммы состояния «Свинец – олово»
термическим методом
Цель работы: нахождение термическим методом критических точек свинца, олова и трёх сплавов из свинца и олова и построения по полученным кривым охлаждения диаграммы состояния «Свинец – олово».
Содержание работы
Теоретические основы
У кристаллических тел при переходе из одного состояния в другое, при протекании фазовых превращений выделяется или поглощается теплота и физические свойства при этом меняются скачкообразно.
Температуры, при которых происходят те или иные физико-химические изменения в сплаве, называются критическими температурами, а соответствующие им точки на кривых охлаждения – критическими точками.
Для определения критических точек сплава достаточно через короткие, но равные промежутки времени измерять температуру медленно охлаждающегося от жидкого состояния до комнатной температуры сплава, затем, построив по этим данным кривую охлаждения в координатах «Температура − время», отыскать на ней точки перегиба, которые и будут являться критическими точками данного сплава.
В сплавах в зависимости от характера взаимодействия металлов друг с другом в твёрдом состоянии образуются твёрдые фазы и протекают различные фазовые превращения: образование твердых растворов, химических соединений, смесей.
По критическим точкам чистых металлов и сплавов, строятся диаграммы фазового равновесия. Эти диаграммы в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации компонентов и дают наглядное представление о процессах, происходящих в сплавах системы при нагреве и охлаждении.
Различают следующие основные типы диаграмм состояния:
— диаграмма для случая полной нерастворимости компонентов в твердом состоянии (образование смесей) (рис. 3.1, а);
Рис. 3.1. Типичные диаграммы состояния сплавов
— диаграмма для случая неограниченной растворимости компонентов в твердом состоянии (неограниченные твердые растворы) (рис. 3.1, б);
— диаграмма для случая ограниченной растворимости компонентов в твердом состоянии (ограниченные твердые растворы) (рис. 3.1, в);
— диаграмма для случая, когда компоненты образуют химическое соединение (рис. 3.1, г).
Сплавы, образующие диаграмму I-го типа (рис. 3.1, а), в твердом состоянии представляют собой смеси из зерен чистых металлов А и В.
В сплавах на рис. 3.1,в металлы А в В образуют 2 типа растворов: твёрдый раствор компонента В в компоненте А – α-твёрдый раствор и твёрдый раствор компонента А в компоненте В – β-твёрдый раствор.
Совокупность точек начала кристаллизации всех сплавов системы (линия АСВ в рис. 3.1, а–в) называется ликвидус. Выше этой линии все сплавы находятся в жидком состоянии.
Совокупность точек конца кристаллизации всех сплавов системы (линия DСE на рис. 3.1, а, ADB – на рис. 3.1, б, АDCEB – на рисунке 3.1,в) называется солидус. Ниже этой линии все сплавы находятся в твердом состоянии.
Сплавы, представленные на рис. 3.1, б, ниже линии солидус при любой концентрации имеют только одну фазу – зерна твердого раствора компонента В в компоненте А.
Сплав двух металлов А и В определенной концентрации, образующийся в точке С (рис. 3.1, а, в), называется эвтектическим. Такой сплав кристаллизуется подобно чистому металлу при постоянной температуре, образуя смесь кристаллов двух твёрдых растворов, называемую эвтектикой.
Сплавы с концентрацией металла В меньше эвтектической называются доэвтектическими, а с концентрацией металла В больше эвтектической называются заэвтектическими сплавами.
Рассмотрим кривую охлаждения доэвтектического сплава (рис. 3.2).
На участке 1 – 2 идет охлаждение жидкого сплава по физическим законам. В точке 1 начинается процесс кристаллизации, за счёт выделения скрытой теплоты кристаллизации уменьшается скорость охлаждения сплава и на кривой охлаждения образуется перегиб. Температура t1 – критическая точка начала кристаллизации из жидкости α-твёрдого раствора. Этот процесс продолжается до точки 3. В точке 3 начинается кристаллизация эвтектики – смеси двух фаз, выделяющихся из жидкого раствора эвтектической концентрации. Кристаллизация эвтектики происходит при постоянной температуре (участок 3 – 4) и заканчивается в точке 4 при температуре t2 по реакции Ж → (α + β). Температура t2 – критическая точка конца первичной кристаллизации сплава.
 | Рис. 3.2. Кривая охлаждения доэвтектического сплава |
На участке 4 – 5 при охлаждении сплава понижается растворимость компонента В в компоненте А. Это приводит к выпадению вторичных кристаллов βII из α-твёрдого раствора: α → βII.
В результате описанных процессов в сплаве образуется конечная структура, состоящая из первичных кристаллов α-твёрдого раствора, эвтектики (α + β) и вторичных кристаллов βII-твёрдого раствора.
Привет студент
Влияние примесей на форму роста кристаллов
Изменение условий приводит к различным эффектам сольватации и десольватации на разных гранях адсорбента, а это в свою очередь приводит к непропорциональному изменению скорости роста этих граней. Прибавление к раствору так называемых поверхностно-активных веществ вызывает неодинаковое изменение интенсивности адсорбции кристаллографически различных граней растущего кристалла. Влияние таких примесей может быть чисто внешнее, ибо примесь не входит в состав растущего кристалла и никакого изменения кристаллической решетки не вызывает. Поэтому оказались удачными попытки получать химически чистые кристаллы с определенной огранкой, изменяя поверхностную энергию их граней. Если же причина влияния примеси на огранку заключается исключительно в том, что примеси вступают в химическое соединение с основным веществом, то этот вопрос не может представлять особого интереса. Естественно, что всякие новые активные соединения могут образовать иные, чем у основного вещества, кристаллические структуры и их кристаллы будут иметь иную огранку.
Обычно установившиеся процессы адсорбции динамически равновесны, т. е. молекулы адсорбата лишь временно закреплены на поверхности адсорбента и при данных условиях рано или поздно покидают ее, освобождая место для таких же или иных молекул. Крайний случай адсорбции, когда молекулы или ионы вещества навсегда закрепляются на поверхности адсорбента, мы наблюдаем в эпитаксии.
Эпитаксией называется ориентированное наращивание вещества на кристаллической поверхности. Эпитаксия зависит от
— двумерного подобия кристаллических решеток в составляющих сетках и химических типов срастающихся веществ. Однако наблюдаются случаи взаимной ориентации как при малом химическом: сходстве, так и при полном его отсутствии (NaNO3 и СаСОз — кальцит, KI и MgSO4*7H3O и т. д.).
Во многих работах установлено, что срастание в вакууме происходит лучше, чем на воздухе или из раствора. Причина — в отравлении части поверхности—адсорбции посторонних частиц из воздуха и раствора, препятствующих возникновению закономерного сростка. Той же причиной объясняется пассивирование свежеполученной поверхности, находящейся длительное время на воздухе перед началом опыта по эпитаксии.
От эпитаксии можно формально перейти к изоморфизму, если представить, что одно вещество закономерно отлагается на всех, гранях другого вещества.
Таким образом, эпитаксия и изоморфизм могут рассматриваться как частные случаи общего явления адсорбции одного вещества на другом.
Особый интерес представляет влияние примесей — модификаторов на расплавы и растворы металлов. Модификаторами называются такие вещества, которые, будучи введены в весьма малых количествах, резко влияют на процессы кристаллизации металлов из растворов или расплавов. Прежде всего модификаторы увеличивают число зародышей и тем способствуют получению мелкозернистого слитка из расплава. Известно, что металлы и сплавы с мелкозернистой структурой обладают значительными преимуществами перед крупнозернистыми. Чем мельче зерно, тем выше механические свойства металлов и сплавов, больше предел упругости, предел прочности и ударная вязкость. Так, присадка ванадия в количестве 0,10—0,15% сообщает литой стали очень тонкое строение.
Такие модификаторы образуют в растворе или расплаве вьисо-кодисперсную, иногда коллоидно-дисперсную взвесь. Ее отдельные частицы являются зародышами, вокруг которых образуются и растут кристаллы. Предполагается, что они химически не взаимодействуют с расплавом или растворенным веществом. Для металлических расплавов модификаторы должны быть тугоплавкими, чтобы они сохранились как твердая фаза в расплаве модифицируемого металла.
Ко второй группе относятся поверхностно-активные модификаторы. Действие их совершенно иное, чем действие первой группы. Поверхностно-активные молекулы этих модификаторов адсорбируются на гранях зародившегося кристаллика и понижают скорость роста его граней. Адсорбция не равномерна на всех гранях. На одних адсорбция происходит более интенсивно, чем на других, и возможно, на некоторых гранях она совсем не выражена. Таким образом, грани оказываются по-разному отделенными адсорбционным слоем постороннего вещества от расплава или раствора. Вследствие этого происходит задержка в развитии кристалла и изменение его формы. В тех случаях, когда скорость роста замедляется, увеличивается промежуток времени от начала появления зародышей до окончательного затвердевания расплава, следовательно, успевает возникнуть большое число центров кристаллизации, в результате чего получается мелкозернистая структура слитка.
По Ребиндеру механизм эффективного влияния поверхностноактивных модификаторов на рост кристалла сводится к следующему. В начале процесса кристаллизации из расплава каждый металл или сплав представляет собой коллоидно-дисперсную систему. При дальнейшем росте зародышей происходит образование поликристаллического слитка. Решающим фактором для структуры слитка следует считать первую стадию кристаллизации, т. е. возникновение зародышей. При таком предельно дисперсном состоянии металл, начавший кристаллизоваться, обладает наибольшим запасом свободной энергии на поверхностях, разделяющих кристалл от расплава, т. е. зародыши в момент их образования являются неустойчивыми. Величину поверхностной энергии можно изменять путем адсорбции поверхностно-активных веществ.
Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ