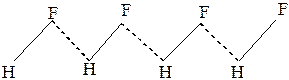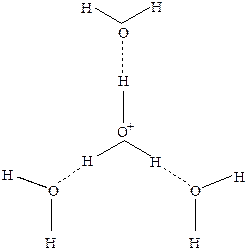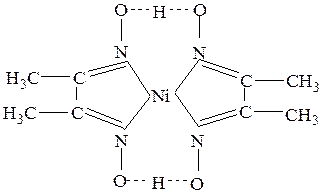На что влияют водородные связи
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
Характеристика водородной связи
Водородная связь характеризуется
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Влияние водородной связи на физические и химические свойства водородных соединений.
Ассоциация водородных соединений
Установлено, что в газообразном HF существует несколько видов молекул (HF)n c n=1–6. Среди них молекула (HF)6 особенно устойчива благодаря образованию дополнительной водородной связи при замыкании кольца.
Молекулы HF и HCN в жидком состоянии ассоциированы в цепи вида: (рис.24 ).Фторид водорода в обычных условиях – бесцветная жидкость(tкип =19,5 о С). Даже в состоянии газа фторид водорода состоит из смеси полимеров H2F2,H3F3,H4F4,H5F5,H6F6.Простые молекулы HF существуют лишь при температурах выше 90 о С. У фтороводорода расстояния H– F и F … H, т.е. протон располагается посередине между ионами фтора.
.… H−C ≡N .… H −C≡ N …. H− C≡ N ….
Рис. 24Водородные связив HF и HCN
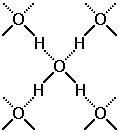
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары
Рис.25 Водородные связи в Н2О
Энергия водородной связи для соединений кислорода с водородом
(13–29 кДж/моль) меньше, чем энергия ковалентной связи. И тем не менее, эта связь обусловливает существование в парах димерных молекул (Н2О)2 и муравьиной кислоты. В ряду сочетаний атомов НF, HO, HN, HCl, HS энергия водородной связи падает вследствие уменьшения электроотрицательности. Она также уменьшается с повышением температуры, поэтому вещества в парообразном состоянии проявляют водородную связь лишь в незначительной степени. В большей степени она характерна для веществ в жидком и твердом состояниях.
Рис.26 Строение иона Н9О4 +
Аномалия температур плавления и кипения
Известно, что соединения водорода с сильно электроотрицательными неметаллами, такими как F, О, N, имеют аномально высокие температуры кипения. Температуры плавления и кипения соединений определяются энергией межмолекулярного взаимодействия: чем выше энергия взаимодействия, тем больше поглощённой энергии расходуется на преодоление сил сцепления, тем при более высоких температурах плавится и кипит вещество. Поэтому соединения, образующие прочные межмолекулярные водородные связи, обладают аномально высокими температурами плавления и кипения. Если в ряду Н2Тe – H2Se – H2S температура кипения закономерно уменьшается, то при переходе от H2S к Н2О наблюдается резкий скачок к увеличению этой температуры. Такая же картина наблюдается и в ряду галогеноводородных кислот. Это свидетельствует о наличии специфического взаимодействия между молекулами Н2О, молекулами HF—образование ассоциатов посредством межмолекулярных водородных связей. Благодаря водородным связям молекулы объединяются в димеры и полимеры. Такое взаимодействие должно затруднять отрыв молекул друг от друга, т.е. уменьшать их летучесть, а, следовательно, повышать температуру кипения соответствующих веществ (см. табл.2).
| Вещество | tпл о С | tкип о С | Вещество | tпл о С | tкип о С |
| H2O | 0,0 | 100,0 | HF | –83,1 | 19,5 |
| H2S | –85,5 | –60,7 | HCl | –112,0 | –84,9 |
| H2Se | –64,8 | –41,5 | HBr | –87,0 | –66,8 |
| H2Te | –49,0 | –2,0 | HI | –50,9 | –39,4 |
Табл.2 Температуры плавления и кипения водородных соединений
Р-элементов VI и VII групп.

Прочностью ассоциатов объясняется аномально высокая теплоёмкость воды, поскольку при нагревании воды много энергии расходуется на разрыв водородных связей. При понижении температуры водородные связи восстанавливаются, освобождая энергию.
При температурах выше 0 о С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру. В жидкой воде молекулы связаны между собой в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты — все крупнее. Наконец, образуется лед, который имеет именно такую упорядоченную структуру.
На рис 27 показан фрагмент структуры льда. В кристалле льда молекулы воды ориентируются таким образом, чтобы образовать максимальное число водородных связей. Каждый атом кислорода в этой структуре тетраэдрически связан с четырьмя другими атомами; между ними располагаются атомы водорода. Два из них соединены с данным атомом кислорода полярной ковалентной связью, два других — водородной связью,т.е. входят в состав других молекул Н2О. Таким образом, получается ажурная структура, далёкая от плотной упаковки. Вследствие этого лёд имеет небольшую плотность и значительную рыхлость. Любая молекула соединена тремя связями с молекулами своего слоя и лишь одной связью с соседним слоем. Поэтому слои легко перемещаются относительно друг друга. Каждый слой молекул состоит из шестичленных колец, которые, располагаясь друг над другом, образуют пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность.
При таянии льда рвётся лишь часть водородных связей, поэтому в жидкой воде сохраняются фрагменты структуры льда, между которыми находятся молекулы воды, не связанныве водородными связями. Эти молекулы заполняют пустоты, в результате плотность жидкой воды при О о С выше, чем у льда, а объём воды жидкой по сравнению с объёмом тающего льда не возрастает как у других веществ, а уменьшается. При повышении температуры от О о С до 4 о С доля разорванных водородных связей и, следовательно, свободной воды, заполняющей пустоты, увеличивается; поэтому возрастает и плотность воды, которая достигает максимального значения при 4 о С. При дальнейшем повышении температуры термическое расширение воды преобладает над уменьшением объёма обусловленного более высокой упаковкой и плотность воды уменьшается.
Рис.27 Окружение молекулы воды в структуре льда
Растворимость и другие свойства водородных соединений
Водородная связь весьма распространена и играет важную роль в процессах растворения, кристаллизации, электролитической диссоциации и других физико-химических процессах.
В водных растворах фтороводород находится в виде устойчивых димеров H2F2. При растворении в воде происходит процесс:
Вследствие наличия водородной связи фтороводородная кислота ( в отличие от её аналогов( HCl,HBr и HI) не является сильной кислотой.
Константа кислотности HF в водном растворе Ка = 6,7 ∙ 10–4
Если вещество способно образовать водородные связи с молекулами растворителя, то оно обладает хорошей растворимостью. По этой причине неограниченно растворяются в воде: хлороводород, аммиак, фтористый водород, этиловый спирт и многие другие вещества.
Отсутствием влияния водородной связи объясняются случаи, когда полярные соединения не растворимы в полярном растворителе — воде. Так, полярный C2H5I хорошо растворяет неполярный нафталин, но сам не растворяется в воде.
Способностью к образованию водородных связей объясняется растворимость в воде некоторых белков. На поверхности белков находятся гидрофильные группы (–OH,–COOH,–NH2 и др.), которые посредством водородных связей присоединяют молекулы воды. Таким образом, каждая белковая молекула гидратирована. При разрыве водородных связей гидратная оболочка разрушается, и молекулы объединяются в более крупные агрегаты— белок выпадает в осадок. Это происходит, например, под действием солей щелочных металлов, спиртов, ацетона.
Внутримолекулярные водородные связи
Наряду с межмолекулярной водородной связью соединяющей отдельные молекулы существует и внутримолекулярная водородная связь, соединяющая атом водорода с каким-либо атомом той же молекулы. Особенно такая связь характерна для многих органических веществ (аминокислот, белков,амидов,многоатомных спиртов и др.).
Внутримолекулярная связь возникает, например, в молекулах салициловой кислоты и нитрофенола:
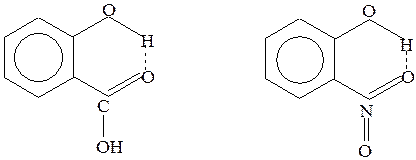
Рис.28 Водородные связи в салициловой кислоте и нитрофеноле
Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеII(см.рис.29).
Рис.29Бис(диметилглиоксимато) никель II
Водородные связи в значительной степени определяют устойчивость конформации белков. Внутримолекулярные водородные связи между группами >C=O и >N−H полипептидной цепи поддерживают
α–спиральную структуру белка. Межмолекулярные водородные связи двух полипептидных цепей определеяют образование слоистых белковых структур. Молекулы ДНК состоят из трёх частей: фосфатных групп, углеводных остатков(дезоксирибоза) и пуриновых и пиримидиновых оснований(аденин, цитозин, гуанин, тимин). Остов молекулы составляют чередующиеся углеводные и фосфатные остатки. С каждым углеводным о соединено пуриновое или пиримидиновое основание.Двойная спираль образуется за счёт того, что водородные связи между основаниями удерживают вместе две отдельные спирали.Основания ориентированы примерно перпендикулярно спирали.Каждое основание может образовать прочную связь только с одним из четырёх оснований, встречающихся в ДНК.Эта специфичность оснований составляет основу генетического кода.
Рис. 30Строение молекулы ДНК
Металлическая связь
В отличие от ковалентных и ионных соединений небольшое число валентных электронов в металлах одновременно связывают большое число атомных ядер. В металлах имеет место сильно делокализованная связь которая называется металлической. Эта связь является достаточно прочной, так как большинство металлов имеет высокую температуру плавления. Валентные электроны достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Делокализированные электроны обусловливают высокую тепло- и электропроводность.
Влияние водородных связей на свойства веществ



Водородные связи влияют на физические (т.кип. и т.пл., летучесть, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С2Н6О).
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность
Химическая связь, образованная положительно заряженным водородом молекулы (или полярной группы) и электроотрицательным атомом другой или той же молекулы, называется водородной связью.
Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Водородная связь между молекулами А–Н и В–R обозначается тремя точками ···.
водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлено тем, что в полярных молекулах А – Н или полярных группах –А – Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Атомы могут быть одинаковыми, как при взаимодействии НF
F δ ‾–Н δ+ + F δ ‾–Н δ+ = F–Н···F–Н,
но могут быть и разными, как при взаимодействии воды и фтороводорода