Наблюдение в динамике что это
Что такое МРТ в динамике?

врач-рентгенолог высшей категории
МРТ в динамике позволяет оценить ранее выявленные у пациента изменения и ответить на основной вопрос: есть или нет отрицательная динамика в сравнении с данными предыдущего исследования, и если есть, то в чем она заключается. Периодичность динамического МРТ контроля чаще всего определяет лечащий врач.
Опытные врачи
Врач высшей категории
Пашкова Анна Александровна
Кандидат медицинских наук
Александров Тимофей Александрович
Томограф экспертного класса
Как проходит процедура МРТ-исследования
Запись исследования на ваш выбор*
 |  |  |
| на диск | на пленку | на флешку |
Частые вопросы о МРТ-исследованиях
Свяжусь с вами
в ближайшее время
Расшифровка в течение 30 минут
После проведения процедуры опытный врач-рентгенолог сделает расшифровку за полчаса.
Запись результатов исследования
Вы можете получить исследование на удобном для Вас носителе, а также выбрать несколько вариантов.
Нажимая на кнопку «Записаться», Вы даете согласие на обработку персональных данных в соответствии с Федеральным законом от 27.07.2006 г. № 152-ФЗ «О персональных данных».
Отзывы о работе центра
Приехали в центр из Эстонии, Таллинна. Делали с мужем много процедур: мозг, сосуды, брюшная полость, мягкие ткани шеи. Всё быстро, качественно, ответ на руках. Спасибо! Буду рекомендовать ваш центр друзьям. И если надо будет опять МРТ, приедем именно к вам.
Хочу поблагодарить весь персонал за внимательное обслуживание. Все было очень «по-петербуржски». Спасибо! Всем здоровья! Так и держать в дальнейшем марку. Успехов во всех ваших делах!
Центр меня поразил новым ремонтом и новым современным оборудованием. Процедура обследования, двух отделов позвоночника прошла под классическую музыку и легкий «бриз», было спокойно и комфортно.
Очень нравится ваш центр, услуги, обслуживание. Проверяюсь уже в 6-й раз за 2 года. Хожу только к вам. Очень удобно, комфортно. Квалифицированный персонал. Всем огромное спасибо. Отдельно хочется отметить доктора Черкасову С.А.
Записывалась на исследование ночью. Приехала раньше времени, но все сделали быстро, четко и как и оговаривалось по более сниженной цене. Спасибо большое за отличный сервис.
Очень переживала перед обследованием, но сотрудники клиники успокоили и все прошло хорошо, спасибо! Результат был готов практически сразу, что очень порадовало! Добрая и уютная обстановка!
Плюсы для пациентов
Возможно присутствие сопровождающего в кабинете МРТ
Wi-Fi, чай и кофе для посетителей центра
Удобный график работы центра
Наушники с музыкой для комфортного прохождения МРТ
Отзывы о работе центра
Приехали в центр из Эстонии, Таллинна. Делали с мужем много процедур: мозг, сосуды, брюшная полость, мягкие ткани шеи. Всё быстро, качественно, ответ на руках. Спасибо! Буду рекомендовать ваш центр друзьям. И если надо будет опять МРТ, приедем именно к вам.
Хочу поблагодарить весь персонал за внимательное обслуживание. Все было очень «по-петербуржски». Спасибо! Всем здоровья! Так и держать в дальнейшем марку. Успехов во всех ваших делах!
Центр поразил меня новым ремонтом и современным оборудованием. Процедура обследования 2-х отделов позвоночника прошла под классическую музыку и легкий «бриз», было спокойно и комфортно.
Очень нравится ваш центр, услуги, обслуживание. Проверяюсь уже в 6-й раз за 2 года. Хожу только к вам. Очень удобно, комфортно. Квалифицированный персонал. Всем огромное спасибо. Отдельно хочется отметить доктора Черкасову С.А.
Записывалась на исследование ночью. Приехала раньше времени, но все сделали быстро, четко и как и оговаривалось по более сниженной цене. Спасибо большое за отличный сервис.
Очень переживала перед обследованием, но сотрудники клиники успокоили и все прошло хорошо,спасибо! Результат был готов практически сразу, что очень порадовало! Добрая и уютная обстановка!
Для граждан с ограниченными возможностями предусмотрен пандус
Мобильная версия сайта
Полная версия сайта
Наблюдение в динамике что это
Первые препараты для иммунотерапии в США и Европе начали использоваться в 2011 году. Разработаны и опробованы они были, разумеется, ещё раньше.
Сначала иммунотерапия использовалась только как средство лечения меланомы, опасной формы рака кожи. Сейчас спектр применения иммунотерапевтических средств существенно шире.
В Российской Федерации эти препараты были зарегистрированы в конце 2015 — начале 2016 года, и с этого времени уже и в России накопился достаточно большой опыт их применения.
«Дело в том, что иммунотерапия — это, наверное, самое важное из всего, что за последние годы произошло в онкологии как в науке.
Онкология — это вообще очень динамично развивающаяся область, и новые лекарства появляются практически ежегодно. Но с появлением иммунотерапии в нашем распоряжении оказалось целое новое направление. Оно дополнило имеющиеся подходы: химиотерапию и таргетную терапию; изменило принципы и алгоритмы лечения целого ряда заболеваний.
До появления иммунотерапии некоторые виды опухолей считались не поддающимися лекарственной терапии ни в каком формате. А теперь даже пациенты с распространённым опухолевым процессом могут жить годами. В некоторых случаях мы можем получить полный клинический эффект даже на четвёртой стадии заболевания — и все это благодаря иммунотерапии. Поэтому это действительно чрезвычайно новое, интересное, перспективное направление в мировой онкологии», – отметил эксперт.
Он добавил, что химиотерапия сейчас – важный и нужный метод, он активно используется в онкологии. Но при выборе препаратов необходимо руководствоваться тем, какое лечение показано конкретному пациенту. А показано может быть только то лечение, которое даёт самые лучшие результаты, лечение, с помощью которого пациент живёт дольше.
Но химиотерапия не может продлевать жизнь до бесконечности, её возможности предельны. Если бы это было не так, мы бы вылечивали рак первой линией терапии. Назначили препарат, добились полной регрессии опухоли, пациент выздоровел. Всё замечательно. Но, к сожалению, в реальности так не бывает, потому что эффективность химиотерапии предельна. Если поначалу мы получаем яркий клинический эффект, то при последующих контрольных исследованиях он слабеет, и в какой-то момент заканчивается, вынуждая нас подбирать новый препарат. Но и линейка препаратов может исчерпаться.
«Поэтому каждый раз, когда мы получаем дополнительную опцию в виде нового химиопрепарата, нового таргетного препарата, рассчитанного на лечение того или иного заболевания, и уж тем более нового направления, такого как иммунотерапия, конечно, мы этому бесконечно рады. Более того, конечно же, если мы говорим о переносимости, то иммунотерапия переносится на порядки легче, чем среднестатистическая химиотерапия, к тому же она обладает существенно меньшим количеством побочных эффектов. Хотя нельзя сказать, что их нет. Они есть, они встречаются, но, конечно, выражены они не так сильно, как побочные эффекты химиотерапии», – добавил онколог.
По его словам, в последнее время снижается подход к онкологии, как к «смертельному заболеванию». Есть огромное количество различных онкологических заболеваний, которые успешно излечиваются. Существуют так называемые прогностически благоприятные опухоли, например определённые виды рака щитовидной железы, рака предстательной железы. Более того, обсуждается даже, что рак предстательной железы на определённой стадии заболевания, в принципе, требует только динамического наблюдения. То есть человек знает, что у него есть рак, но не получает никакого лечения, потому что этот рак не представляет опасности — до определённых моментов.
«Некоторые виды рака молочной железы, — опять же, на определённой стадии — могут быть полностью излечены. Даже сейчас есть очень много пациенток, которые приходят на обследования после операций, сделанных в семидесятые годы, и у них все в порядке.
Конечно, есть и агрессивные, прогностически неблагоприятные опухоли, но даже в этой области произошло очень много положительных изменений. Одна из самых агрессивных опухолей, например, — это рак поджелудочной железы. Буквально пятнадцать лет назад в крупных хирургических центрах — даже применив все возможные варианты лечения, — было практически невозможно получить хоть какие-то цифры пятилетней выживаемости у больных. А сейчас есть огромное количество публикаций, в которых приводятся цифры не только пяти-, но и десятилетней выживаемости при этом заболевании. Связано это с использованием, во-первых, новых схем, новых препаратов, а во-вторых, с тем, что сейчас практически никакое онкологическое заболевание не лечится только одним методом, практически всегда используется комбинированный подход, сочетание хирургического лечения с лекарственной терапией и лучевой терапией.
Поэтому рак, безусловно, излечим. Рак — это никоим образом не приговор», – заключил Андрей Пылёв.
Как сообщалось ранее, член правления Российского общества клинической онкологии (RUSSCO), заведующая отделением химиотерапии НМИЦ онкологии им. Н. Н. Блохина Елена Артамонова рассказала о значении новых иммунных препаратов при уничтожении рака, а также о ближайшей перспективе развития лечения онкологии. Подробнее читайте: «Иммунные препараты – не панацея, но мы стоим на пороге новых достижений».
Динамическое наблюдение пациентов с хроническими заболеваниями сердечно-сосудистой системы
Динамическое наблюдение подразумевает регулярные обращения пациента к врачу для контрольных обследований. Такой подход позволяет вовремя заметить изменения в течении болезни и принять меры по профилактике осложнений. Наблюдением больных с хроническими сердечно-сосудистыми патологиями занимаются кардиологи, терапевты или врачи общей практики (семейные врачи). При малейшем ухудшении состояния пациенту рекомендуется обращаться сразу к кардиологу.
Когда требуется динамическое наблюдение
Показаниями для взятия пациента «на контроль» являются:
Как проходят приемы
Периодичность осмотров зависит от характера нарушений. Если больной перенес инфаркт или операцию, то первые полгода/год ему рекомендуется посещать специалиста 2-4 раза в мес. При стабильном состоянии достаточной считается частота приемов 2-4 раза в год.
При каждом визите врач:
Основными диагностическими методами контроля являются:
По показаниям назначаются:
По завершении диагностики врач вносит необходимые коррективы в лечение и назначает дату следующей явки на прием.
Задача динамического наблюдения — не допустить дальнейшего прогрессирования болезни у пациента. Кардиологи «Спектры» имеют большой опыт в наблюдении больных с хроническими сердечно-сосудистыми патологиями. Для этого в клинике используются новейшие методики обследования, которые позволяют проводить всестороннюю диагностику и точно оценивать состояние организма. Подходящие лечебные меры подбираются в соответствии с действующими европейскими стандартами. Регулярное обращение к нашим специалистам служит гарантией своевременной профилактики осложнений и поддержания стабильно хорошего самочувствия.
Наблюдение в динамике что это
Факультетская хирургическая клиника им. Н.Н. Бурденко Московской медицинской академии им. И.М. Сеченова
Факультетская хирургическая клиника им. Н.Н. Бурденко Московской медицинской академии им. И.М. Сеченова
Впервые выявленные очаговые образования легких малого размера (до 2 см в диаметре). Динамическое наблюдение или операция?
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(10): 57-60
Павлов Ю. В., Рыбин В. К. Впервые выявленные очаговые образования легких малого размера (до 2 см в диаметре). Динамическое наблюдение или операция?. Хирургия. Журнал им. Н.И. Пирогова. 2016;(10):57-60.
Pavlov Iu V, Rybin V K. First time revealed small formations of lungs (under 2 cm in diameter). Dynamic follow-up or surgery?. Khirurgiya. 2016;(10):57-60.
https://doi.org/10.17116/hirurgia20161057-60
Факультетская хирургическая клиника им. Н.Н. Бурденко Московской медицинской академии им. И.М. Сеченова
Факультетская хирургическая клиника им. Н.Н. Бурденко Московской медицинской академии им. И.М. Сеченова
Факультетская хирургическая клиника им. Н.Н. Бурденко Московской медицинской академии им. И.М. Сеченова
Одиночный очаг в легких (ООЛ) определяют как локальный участок уплотнения легочной ткани округлой или близкой к ней формы диаметром до 3 см [15]. Это международное определение отличается от традиционного отечественного представления о легочных очагах, источником которого является фтизиатрическая практика (в классификации туберкулеза легких размер очагов не превышает 1 см, а уплотнения большего размера определяются как инфильтраты, туберкуломы и другие виды изменений) [14, 15].
Патологические образования легких малого размера (до 2 см) в большинстве случаев выявляются при проведении компьютерной томографии грудной клетки, выполняемой по различным причинам [10, 11, 14, 16-18].
Между тем по результатам одного КТ-исследования часто трудно провести дифференциальную диагностику, требуются повторные исследования в динамике. При воспалительном процессе очаги исчезают через 1-2 мес. В случае атипичной железистой гиперплазии очаги не изменяются в течение нескольких лет. При аденокарциноме можно заметить увеличение размера и/или усиление плотности, а также сосудистую конвергенцию [11, 12].
Обнаруженные при таком обследовании очаговые образования в легочной ткани нередко остаются без внимания специалистов, что порой влечет за собой неутешительные результаты лечения этой категории больных.
По мнению С.В. Миллер и соавт. [8], диагностическая торакотомия является завершающим методом комплексного обследования больных с округлыми образованиями легких небольшого размера и обеспечивает действительно раннюю диагностику и своевременное хирургическое лечение. Следовательно, радикальное хирургическое вмешательство, предпринятое при округлом образовании в легком, генез которого неясен, является методом, позволяющим провести морфологическую верификацию ранней стадии злокачественной опухоли и выполнить органосохраняющую операцию.
Другие авторы считают, что в настоящее время не существует единого подхода к определению характера очаговых образований легких. Очевидно, что при высоком риске злокачественной опухоли оптимальный подход заключается в возможно более ранней морфологической верификации диагноза. В случае низкого риска злокачественного процесса более рационально проводить динамическое наблюдение [11].
Результатом этих действий может быть выделение группы пациентов с очевидно доброкачественным процессом, о чем свидетельствуют отсутствие динамики роста очага на протяжении 2 и более лет, наличие «доброкачественных» обызвествлений, включений жира (гамартома) или жидкости (киста) в очаге по данным КТ. В такой ситуации необходимо только наблюдение. Сюда же относятся случаи артериовенозных мальформаций и других сосудистых изменений, а также воспалительные процессы в легких (округлый туберкулезный инфильтрат, туберкулома, мицетома и др.), требующие специфического лечения [5, 9, 13].
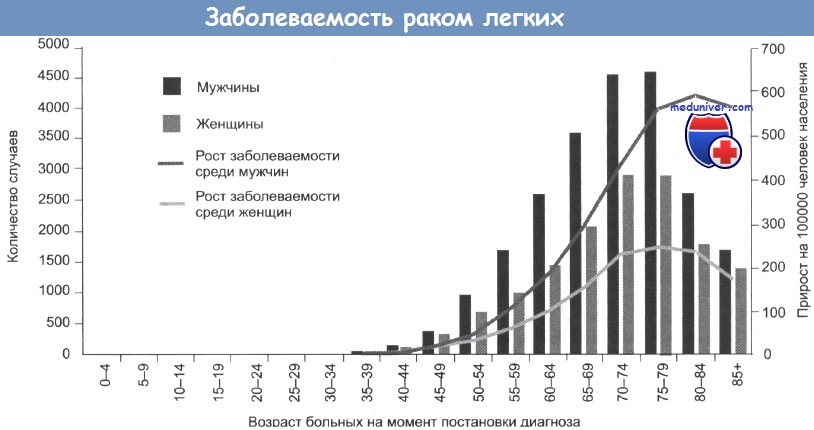
Ежегодно в России раком легкого заболевают свыше 63 тыс. человек, в том числе свыше 53 тыс. мужчин. У более 20 тыс. пациентов (34,2%) рак легкого выявляется в IV стадии, поэтому задача обнаружения злокачественных опухолей легких на ранних стадиях их развития чрезвычайно актуальна [2, 7, 8].
Угрожающим фактором при диагностике опухолей легких малого диаметра является их бессимптомность. Отсутствие жалоб, скудная клиническая картина заболевания, сложности с профилактикой и первичным выявлением очагов делают проблему образований легких до 2 см в диаметре актуальной для научных изысканий и практически значимой для сохранения здоровья и нередко жизни пациентов.
Материал и методы
У всех больных при рентгенологическом исследовании, включая компьютерную томографию, были впервые выявлены очаговые образования в легких размером от 0,5 до 2 см. Всем пациентам были выполнены операции удаления участков легочной ткани с опухолью из различных доступов: 44 видеоторакоскопические резекции легкого, 43 миниторакотомии с видеосопровождением, 23 миниторакотомии. Окончательный диагноз формулировали после планового гистологического исследования удаленного патологического образования легкого. Летальных исходов не было.



Результаты и обсуждение

Во 2-й группе у 13 пациентов был выявлен рак легкого. Доброкачественные опухоли (гамартомы) легкого имелись у 18 больных, у 7 пациентов была диагностирована туберкулома. Таким образом, в этой группе частота злокачественных и доброкачественных опухолей вместе с туберкуломами составила 88,4%.
Таким образом, диагностический алгоритм исследований у больных с впервые выявленными периферическими образованиями легких определяют данные мультиспиральной компьютерной томографии. При малом размере образований (от 0,5 до 2 см) показано их удаление без морфологического подтверждения диагноза до операции. Оптимальный оперативный доступ для хирургического лечения пациентов с опухолями легких малого размера следует выбирать в зависимости от диаметра и количества патологических образований. При единичной опухоли легкого размером менее 0,5 см, впервые выявленной при компьютерной томографии, наиболее целесообразной тактикой будет динамическое наблюдение больного и проведение контрольной компьютерной томографии через 3, 6, 12 мес.
Наблюдение в динамике что это
Несмотря на то что технологические достижения в области лучевой диагностики облегчили обнаружение рака легких, важно понимать, что некоторые факторы могут привести к неправильной интерпретации данных исследования. Рак легких может характеризоваться широким спектром признаков: наличием узелков с изменениями по типу «матового стекла», солидных объемных образований, множественных участков консолидации легочной ткани, которыми также могут проявляться и заболевания доброкачественной этиологии.
Для дифференцирования таких заболеваний и рака легких необходимо учитывать клиническую картину, а в некоторых случаях и результаты патоморфологического исследования. Основной причиной высокой заболеваемости и смертности при раке легких является несвоевременное его выявление. Как было показано, при рентгенографии органов грудной клетки доля ложноотрицательных результатов составляет до 20-50%. Определяющими факторами гиподиагностики служат ошибки обнаружения патологических изменений, их интерпретации и документирования.
Затруднить выявление рака легких могут некоторые особенности локализации, плотности и структуры патологических образований, а также наличие патологических изменений, обусловленных другими заболеваниями.
По результатам Национального скринингового исследования легких (NLST, США) смертность от рака легких снизилась на 20%. Также было установлено, что скрининг с использованием низкодозной компьютерной томографии (НДКТ) является надежным методом выявления данного заболевания на ранней стадии, когда его лечение более эффективно. Если рак легких был заподозрен при скрининговом исследовании с использованием НДКТ или при КТ, выполненной по другим показаниям, следующим этапом диагностики пациента часто становится проведение хирургической биопсии или биопсии под визуализационным контролем.
Последний может осуществляться посредством КТ или УЗИ, а для взятия образцов ткани выполняется как тонкоигольная аспирационная биопсия (ТАБ), так и пункционная биопсия. Поскольку пункционная биопсия позволяет получать более крупные и менее поврежденные образцы тканей, предпочтительно применять именно данный метод биопсии. Тем более что в последнее время все шире проводится детальное исследование опухолей, в том числе и посредством генетического тестирования. После установления диагноза рака легких и проведения лечения обычно назначается динамический контроль с помощью КТ или ПЭТ/КТ.
Однако в настоящее время четкие рекомендации относительно оптимальных сроков выполнения повторных исследований после лечения рака легких отсутствуют.
а) Заболевания, имитирующие рак легких. Несмотря на то, что технологические достижения в области компьютерной томографии (КТ) позволяют во многих случаях достоверно выявлять рак легких, существует множество заболеваний, сходных с первичным раком легких по лучевым признакам. Дифференциальный диагноз во многом зависит от преобладания в лучевой картине определенных признаков, например узелков с изменениями по типу «матового стекла» (УМС), частично солидных узелков (солидный компонент и изменения по типу «матового стекла»), солидных узелков или участков консолидации легочной ткани.
Так, при выявлении узелка с изменениями по типу «матового стекла» аденокарциному in situ следует дифференцировать с такими состояниями, как атипичная аденоматозная гиперплазия (ААГ), очаговый фиброз, легочное кровоизлияние и острые инфекционные и неинфекционные воспалительные процессы. Аналогичным образом, несмотря на то что первичная аденокарцинома легкого может проявляться участком консолидации легочной ткани, в дифференциальный ряд должны быть включены и другие заболевания доброкачественной и злокачественной этиологии: лимфома, типичные и атипичные инфекции, а также неинфекционные воспалительные процессы, например саркоидоз.
Часто для постановки правильного диагноза помимо лучевой картины необходимо учитывать и клиническую. Однако при сомнительных результатах исследования в конечном счете может потребоваться проведение гистологического анализа.
б) Несвоевременное выявление рака легких. Несвоевременное выявление рака легких является потенциальным источником увеличения заболеваемости и смертности, а также одной из ведущих причин в США для обвинения врачей лучевой диагностики в халатности. При рентгенографии органов грудной клетки доля ошибок в диагностике раннего рака легких оценивается в 20-50%. Виной этому могут служить такие специфические особенности патологических образований, как их малые размеры, нечеткость контуров и низкая плотность. Кроме того, затруднять визуализацию патологических образований может расположение их в таких областях, как верхушки и корни легких, парамедиастинальные и ретрокардиальные отделы, а также базальные отделы легких вблизи купола диафрагмы.
При КТ патологические изменения в легких визуализируются лучше, поэтому доля ошибок ниже, чем при рентгенографии органов грудной клетки. К факторам, влияющим на обнаружение рака легких при КТ, относят размер патологического образования, его локализацию, плотность (изменения по типу «матового стекла» или солидный компонент), структуру и наличие дополнительных затемнений в легких. С уменьшением размера образования снижается и выявляемость узелков при КТ, вследствие чего большинство пропущенных карцином легких соответствуют ранней стадии (стадия IA).
Чаще всего рак легких пропускают при его локализации в дыхательных путях (эндобронхиальные образования), области вокруг корней легких, парамедистинальных и субплевральных отделах легких. Вследствие относительно небольшой плотности и медленного роста узелки с изменениями по типу «матового стекла» обнаружить труднее, чем солидные или частично солидные (с изменениями по типу «матового стекла» и солидным компонентом) узелки. На фоне уплотнений в легких, обусловленных ателектазом, пневмонией, легочным фиброзом или другими инфекционными и неинфекционными воспалительными заболеваниями, рак легких может не визуализироваться. В то же время злокачественные новообразования, характеризующиеся такими нетипичными лучевыми признаками, как консолидация легочной ткани или участок уплотнения в субплевральных отделах, могут быть ошибочно приняты за доброкачественный процесс.
Для улучшения визуализации рака легких могут использоваться различные подходы: выполнение КТ с тонкими срезами, построение реконструкций в режиме максимальной интенсивности (MIP), применение двухэнергетической рентгенографии органов грудной клетки, использование режима подавления костной ткани при рентгенографии, а также применение компьютерных систем диагностики при КТ или рентгенографии.
в) Скрининг рака легких. В Соединенных Штатах в структуре смертности от злокачественных новообразований рак легких занимает лидирующую позицию. В большинстве случаев его выявляют уже на стадии местного распространения или метастазирования. Поэтому в последнее время акцент делается на обнаружение злокачественных новообразований на ранних стадиях, когда могут быть использованы эффективные методы лечения с более благоприятным исходом. Скрининг с использованием низкодозной компьютерной томографии (НДКТ) зарекомендовал себя, как эффективный метод снижения смертности от рака легких благодаря выявлению данного заболевания на ранней стадии.
Национальное скрининговое исследование легких (NLST) представляет собой мультицентровое клиническое исследование, в котором сравнивалась эффективность обнаружения рака легких у пациентов группы риска с помощью рентгенографии и НДКТ По его результатам скрининг с использованием низкодозной КТ (НДКТ) по сравнению с использованием рентгенографии привел к снижению смертности в группе риска на 20%. В Европе аналогичное исследование NELSON, посвященное скринингу рака легких, было проведено в 2015-2016 годах.
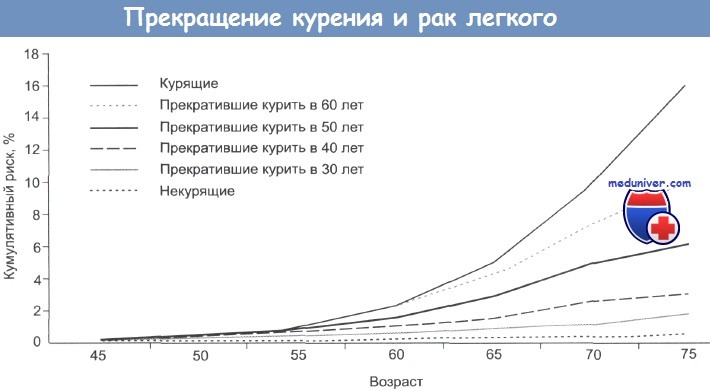
В отличие от скрининга других злокачественных новообразований, таких как рак молочной железы, рактолстой кишки и рак предстательной железы, скрининг рака легких с использованием НДКТ только недавно вошел в практику многих медицинских учреждений. Однако его внедрение было поддержано многочисленными профессиональными организациями. Так, рабочей группой Профилактической службы США (USPSTF) было рекомендовано проводить скрининг рака легких в группе риска у пациентов 55-80 лет со стажем курения 30 лет, курящих в настоящее время либо отказавшихся от курения в течение последних 15 лет.
Недавно было объявлено, что в США скрининг рака легких будет охватывать всех участников государственных программ бесплатной медицинской помощи престарелым и малоимущим (Medicare и Medicaid). В разработке алгоритмов диагностики с небольшими различиями в рекомендациях относительно скрининга и динамического контроля участвовали такие организации, как Национальная сеть многопрофильных онкологических учреждений (США), Американская коллегия радиологов (ACR), Американская ассоциация торакальных хирургов (AATS), Американская коллегия специалистов в области торакальной медицины (АССР) и Американское общество клинической онкологии (ASCO).
Недавно для стандартизации заключений при скрининге рака легких Американской коллегией радиологов была создана система Lung-RADS, призванная уменьшить путаницу и повысить эффективность мониторинга. Алгоритм Lung-RADS включает в себя категории оценки (0-4) и модификаторы (S и X), которые могут применяться в отдельных случаях и соответствуютопределенным рекомендациям по ведению пациента.
Создание и внедрение программы скрининга рака легких представляет собой непростую задачу, требующую усилий множества специалистов различного профиля. И немаловажную роль здесь играет врач лучевой диагностики, от которого напрямую зависит успех данной работы. Помимо знания методических инструкций и рекомендаций по проведению скрининга в группе риска, врачу лучевой диагностики необходимо знать оптимальные протоколы исследования, сотрудничать с рентгенолаборантами и заниматься их обучением в целях надлежащего сканирования пациентов, а также обладать навыками интерпретации данных НДКТ.
Кроме того, врач лучевой диагностики должен сотрудничать с медицинскими работниками другого профиля, в том числе пульмонологами, хирургами, онкологами, онкологами-радиологами, патоморфологами, терапевтами и медицинскими сестрами, поскольку они участвуют в скрининговых исследованиях и влияют на выбор тактики ведения пациента и выполнения динамического контроля. Во многих учреждениях за планирование выполнения НДКТ, передачу результатов исследования и рекомендаций пациентам и другим врачам и обеспечение надлежащего динамического контроля отвечает отдельный сотрудник.
В настоящее время используется множество протоколов НДКТ, различающихся в зависимости от производителя оборудования, модели компьютерного томографа и предпочтений врача лучевой диагностики. Для создания протокола, подходящего для индивидуальной программы скрининга, необходим анализ протоколов, применявшихся в клинических испытаниях, особенно в рамках исследования NLST. Во многом на основании таких исследований несколькими профессиональными организациями были разработаны рекомендации по выбору параметров сканирования.
Наиболее важным компонентом любого протокола НДКТ, используемого для скрининга рака легких, является применение определенного метода, позволяющего снижать дозу облучения пациента, сохраняя высокое качество изображений и получая тонкие срезы. Благодаря технологическим усовершенствованиям диагностическое исследование можно выполнять при меньшей дозе облучения, однако для сохранения приемлемого для интерпретации качества необходима оптимизация конкретных протоколов.
В основе большинства подходов к снижению дозы облучения лежит уменьшение величины силы тока на трубке или пикового киловольтажа (кВ). Например, НДКТ может быть выполнена при значении произведения величины силы тока на трубке на время экспозиции, равном всеголишь 20 мАс. При этом в рутинной практике в большинстве случаев КТ органов грудной клетки выполняется при 200-250 мАс. НДКТ в рамках исследования NLST обычно проводилась при 20-40 мАс. Однако врачам лучевой диагностики следует понимать, что использование низких значений тока на трубке или низкого пикового киловольтажа (кВп) приводит к повышению уровня шумов на изображении.
г) Биопсия под визуализационным контролем. После выявления подозрительных изменений при КТ или ПЭТ/КТ следующим этапом диагностики часто становится выполнение хирургической биопсии или биопсии под визуализационным контролем. Последняя может выполняться под контролем КТ или под ультразвуковым контролем и характеризуется меньшей травматичностью, чем хирургическая биопсия. Преимуществами проведения биопсии под визуализационным контролем являются возможность ее выполнения в амбулаторных условиях, относительно меньшее время восстановления после процедуры, возможность оценки состояния легких и других органов грудной клетки и выявления осложнений во время и после проведения процедуры.
Взятие образцов тканей может выполняться несколькими способами, в том числе методом тонкоигольной аспирационной биопсии (ТАБ) или пункционной биопсии. В большинстве случаев биопсия под визуализационным контролем традиционно выполняется методом ТАБ. Однако пункционная биопсия позволяет получить больший объем неизмененных тканей и потому в клинической практике является более предпочтительной. Большее количество биоптата позволяет выполнить детальный анализ тканей, в том числе провести генетическое и биомаркерное тестирования.
д) Динамический контроль при раке легких. После диагностики и лечения рака легких динамический контроль обычно проводят с помощью КТ или ПЭТ/КТ. Однако в настоящее время методические инструкции по оптимальным условиям его проведения еще только продолжают разрабатываться. Так, были определены две основные задачи динамического контроля после проведенного лечения (резекции, химиотерапии, лучевой терапии): выявление рецидива рака легких и нового первичного рака легких.
Поскольку в большинстве случаев рак легких рецидивирует в течение первых пяти лет после терапии (пик приходится на 2-3 годы), то КТ органов грудной клетки обычно выполняется каждые шесть месяцев в течение первых двух лет. Проведение КТ с контрастным усилением является более предпочтительным по причине лучшей визуализации патологических изменений в области корней легких и средостения, которыми может проявляться рецидив заболевания. По прошествии этого периода времени динамический контроль может выполняться с помощью нативной низкодозной КТ. Конкретные рекомендации по использованию ПЭТ/КТ в целях выявления рецидива опухоли в настоящее время отсутствуют. Данный метод может применяться после проведенного лечения при наличии симптоматики и в случае обнаружения подозрительных изменений при КТ.
Редактор: Искандер Милевски. Дата публикации: 30.1.2019