Наличие аллеля риска что значит
Наличие аллеля риска что значит
Совершенно другой подход к идентификации генетического вклада в комплексные заболевания применяют при обнаружении конкретных аллелей, связанных с болезнью. Присутствие конкретного аллеля в локусе с повышенной или сниженной частотой у больных по сравнению с группой контроля известно как ассоциация с болезнью.
При анализе ассоциации частота конкретного аллеля (например гаплотип HLA или конкретный SNP, или гаплотип SNP), сравнивают среди больных и здоровых в популяции.
Если дизайн исследования — анализ типа случай-контроль, в котором индивидуумов с болезнью, выбранных из популяции, сопоставляют с контрольной группой без болезни, и генотипы индивидуумов в двух группах определены, то ассоциацию между болезнью и генотипом затем вычисляют по отношению шансов. Шансы сами по себе — это отношение.
Согласно приведенной таблице, шансы иметь клиническую картину болезни у носителей аллеля равны числу больных носителей аллеля (а), деленному на число здоровых носителей аллеля (b). Аналогично, шансы быть больным у неносителя аллеля равны количеству больных-неносителей (с), деленному на количество здоровых неносителей (d). Отношение шансов болезни вычисляют как отношение этих отношений: Отношение шансов = a/b/c/d=ad/be.
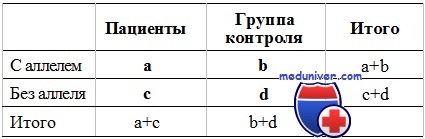
Если исследование спланировано как поперечное или как когортное, при которых берут случайную выборку из всей популяции, анализируемую как на наличие болезни, так и на присутствие генотипа восприимчивости, выраженность ассоциации можно оценивать с помощью относительного риска. Относительный риск сравнивает частоту болезни у всех носителей аллеля восприимчивости [а/(а+b)] с частотой болезни у тех, кто не несет аллеля восприимчивости ([c/(c+d)].
Относительный риск = a/(a+b)/c/(c+d).
Относительный риск приблизительно равен отношению шансов, если болезнь редкая (т.е. а A в гене протромбина.
Есть значимое преобладание числа пациентов, несущих аллель 20210G>A по сравнению с группой контроля (h2=15 при числе степеней свободы 1; р
Сила и слабости исследования ассоциации гена с болезнью
Методы определения ассоциации — мощные инструментальные средства для точного определения генов, способствующих развитию генетической болезни, выявляющие не только ген, но и конкретные ответственные аллели. Они также сравнительно легки для выполнения, поскольку нужны образцы только от больных и группы контроля, и нет необходимости в кропотливых семейных исследованиях и сборе образцов от многих членов родословной.
Тем не менее исследования ассоциации следует интерпретировать осторожно, поскольку повышение относительного риска, наблюдаемое при обнаружении аллеля в конкретном локусе, не доказывает, что аллель или даже локус, в котором этот аллель находится, включен в патогенез болезни. Существуют два пути, которыми конкретный аллель может быть связан с болезнью без реального участия в развитии заболевания.
Первый и наиболее серьезный — проблема полностью искусственной ассоциации, вызываемая стратификацией популяции. Если популяция стратифицирована на отдельные субпопуляции (например по этнической принадлежности или религии) и участники одной субпопуляции редко вступают в брак с участниками других субпопуляций, то болезнь, независимо по какой причине более часто встречающаяся в одной субпопуляции, может быть связана (неправильно) с любыми аллелями, которые также окажутся более частыми в этой субпопуляции, чем в популяции в целом.
Ошибка ассоциации из-за стратификации популяции, тем не менее, может быть минимизирована при тщательном подборе группы контроля. Разработаны также методы, не использующие дизайн случай-контроль, но тестирующие ассоциации между болезнью и конкретными аллелями в пределах семей. Для этих методов необходимо не только наличие ассоциации, но и чтобы ассоциированный аллель находился в локусе, связанном с локусом болезни. Такие основанные на исследовании семей ассоциативные методы не подвержены ошибкам, вызываемыми стратификацией.
Во-вторых, ограниченность умозаключения о функциональной значимости ассоциации аллеля с болезнью связана с тем, что множество локусов могут оказаться в неравновесном сцеплении. Предположим, что два тесно сцепленных локуса имеют два аллеля, находящихся в неравновесном сцеплении друг с другом. Это означает, что когда один из аллелей присутствует в гаплотипе, другой также имеет повышенную вероятность присутствия в этом гаплотипе.
Фактически, все аллели с неравновесным сцеплением с аллелем в локусе болезни покажут явную положительную ассоциацию, независимо от того, есть у них какая либо функциональная значимость в развитии болезни или нет. Ассоциации, основанные на неравновесном сцеплении, все же остаются полезными, так как сцепленные аллели, по крайней мере, должны быть в локусах, достаточно близко расположенных к локусу болезни.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Наличие аллеля риска что значит
Маркер связан с изменением метаболизма метионина.
Исследуется для выявления генетической предрасположенности к гипергомоцистеинемии, анемии, ишемической болезни сердца, ишемическому инсульту, гипертензии, атеросклерозу, тромбозам, преэклампсии, различным формам рака, первичной глаукоме, мигреням, депрессии; у плода – к изолированным дефектам нервной трубки, хромосомным аномалиям, расщелинам верхней губы и неба. Информативен при назначении фолиевой кислоты, составлении рекомендаций по питанию, при подготовке к беременности. Имеет значение при оценке риска побочных эффектов ряда препаратов, используемых в химиотерапии рака.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Ген MTHFR кодирует белок МТНFR (метилентетрагидрофолатредуктазу) – внутриклеточный фермент, участвующий в превращении гомоцистеина в метионин при наличии кофакторов – пиридоксина (витамина В6), цианокобаламина (витамина В12) – и субстрата – фолиевой кислоты.
Генетический маркер A1298C
Участок ДНК гена MTHFR, в котором происходит замена основания аденина (A) на цитозин (С) в позиции 1298, обозначается как генетический маркер А1298С. Это приводит к замене аминокислоты в ферменте, и, следовательно, изменяются его биохимические свойства.
Glu429Ala – замена глутаминовой кислоты на аланин в позиции 429 в аминокислотной последовательности белка MTHFR.
Возможные генотипы
Встречаемость в популяции
Встречаемость минорного С-аллеля в европейской популяции составляет 10 %.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
МТНFR (метилентетрагидрофолатредуктаза) – внутриклеточный фермент, участвующий в превращении гомоцистеина в метионин в присутствии кофакторов – пиридоксина (витамина В6) и цианокобаламина (витамина В12) – и субстрата – фолиевой кислоты. Активность фермента может снижаться в результате нуклеотидных замен в кодирующем его гене. Вследствие этого нарушается метаболический путь превращения гомоцистеина и его содержание в плазме крови увеличивается.
Среди всех известных генетических причин гипергомоцистеинемии наиболее распространены замены в гене MTHFR. Известно около десяти вариантов этого гена, влияющих на изменение функции кодируемого им фермента.
Самым изученным является вариант, в котором цитозин (С) в позиции 677 заменен на тимин (T). Такой полиморфизм MTHFR обозначается как C677Т и сопровождается повышением уровня гомоцистеина в крови.
Другим вариантом полиморфизма гена MTHFR является замена нуклеотида аденина (A) на цитозин (С) в позиции 1298, приводящая к изменению структуры фермента, в котором глутаминовая кислота в позиции 429 меняется на аланин. Данная замена приводит к снижению активности фермента, более выраженному у носителей двух аллелей 1298С (генотип С/С). Биохимические характеристики измененного фермента не отличаются от свойств фермента дикого типа (неизмененного).
Комбинация генотипов 677 С/T и 1298 А/C сопровождается не только снижением активности фермента, но и повышением концентрации гомоцистеина в плазме и снижением уровня фолата, как это бывает при носительстве двух аллелей 677T. Кроме того, эта комбинация увеличивает вероятность дефектов нервной трубки у плода. Дефицит MTHFR способствует тератогенному (повреждающему плод) и мутагенному (повреждающему ДНК) действию из-за нарушения процессов метилирования ДНК.
Увеличение концентрации гомоцистеина повышает риск атеросклероза и тромбоза. Накапливаясь в организме, гомоцистеин повреждает внутреннюю стенку артерий, что приводит к разрывам эндотелия. На поврежденную поверхность осаждаются холестерин и кальций, образуя атеросклеротическую бляшку, вследствие чего просвет сосуда сужается, а иногда закупоривается.
В исследованиях был подтвержден протективный эффект присутствия аллеля 1298С при врождённых пороках сердца. Поскольку фермент MTHFR участвует в процессе синтеза нейромедиаторов (серотонина, мелатонина, дофамина, адреналина и др.), изменения функции белка могут влиять на умственную, эмоциональную и физическую деятельность.
Таким образом, присутствие аллеля С по маркеру А1298С может способствовать развитию в основном сердечно-сосудистых заболеваний и осложнений беременности, особенно в комбинации с нарушениями в работе других ферментов, а также в условиях наличия дополнительных факторов риска развития гипергомоцистеинемии или дефицита фолатов (нерациональное питание, лекарственная терапия, сопутствующие заболевания, вредные привычки).
Что означают результаты?
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Поскольку перестройка A1298C в гене MTHFR часто влечет за собой последствия, в том числе при изменении в участке С677Т, необходимо также оценивать работу фермента по маркеру:
Генетический маркер входит в исследование:
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
Невынашивание беременности и женское бесплодие – генетические аспекты
Патологии женской репродуктивной системы в целом, и невынашивание беременности, как важная часть этой проблемы тесно связаны с генетикой человека. Так, наиболее значимые звенья сложного и многосоставного патогенеза акушерских патологий имеют своей причиной мутации генов, обеспечивающих самые разнообразные процессы, участвующие в возникновении и нормальном протекании беременности. Рассмотрим несколько основных акушерских патологий с генетической точки зрения.
Тромбофилия
Тромбофилия – термин, обозначающий предрасположенность к венозному и случайному артериальному тромбоэмболизму. Патологическая способность к тромбообразованию может быть результатом врожденного или приобретенного нарушения свертывания крови. Наиболее распространена активация резистентности протеина С, которая вызвана мутацией фактора 5 Лейден (5)
Тромбофилия играет важную роль в патогенезе развития:
Тромбофилия является ключевой проблемой в процессе развития акушерских осложнений во время беременности:
Венозные тромбозы занимают третье место по распространённости среди сердечно-сосудистых заболеваний. Частота венозных тромбозов в общей популяции, согласно мировым данным, составляет 1-2 случая на 1000 населения ежегодно.
Риск тромбозов значительно увеличивается при наличии таких провоцирующих факторов, как хирургические операции, приём гормональных контрацептивов, различные заболевания (диабет, онкология, ожирение), а также беременность и роды.
Планирование беременности.
Своевременно выявленная тромбофилия – не приговор, а прямая инструкция к действию, ведь своевременно, еще до наступления беременности, терапия позволяет минимизировать, а часто и полностью исключить патологии беременности, вызванные тромбофилией.
Выбор способа контрацепции.
При приеме эстрогенсодержащих контрацептивов свертываемость крови повышается, что в случае тромбофилии становится просто опасным для здоровья и жизни.
Показания к назначению исследования на наследственную тромбофилию:
Факторы риска тромбофилий:
Основные блоки генов, участвующих в развитии тромбофилии:
К первичным (генетически обусловленным) тромбофилиям относят (10):
Частота различных тромбофилий (10):
Основные мутации, приводящие к наследственной тромбофилии:
Коагуляционный фактор 5
Лейденская мутация; G1691A; Arg506Gln
Замедление деградации фактора 5 активированным протеином
Коагуляционный фактор 2 (протромбин)
Усиление синтеза протромбина аллеля А, смещение равновесия в системе гемостаза в сторону усиления свертывания крови
Коагуляционный фактор 2 (протромбин)
Повышение экспрессии гена фибриногена, увеличение выработки фибрина, повышенное тромбообразование
Снижение интенсивности синтеза фибриногена
Образование термолабильной формы фермента со сниженной активностью приводит к нарушению метилирования гомоцистеина и повышению его уровня в крови. Гипергомоцистеинемия приводит к поврежению эндотелия сосудов.
Мутация приводит к термолабильности MTHFR ТОЛЬКО при СОВМEСТНОМ носительстве с мутацией 677T
Усиление плотности рецепторов к коллагену на поверхности тромбоцитов, усиление адгезии тромбоцитов к эндотелию
Мутация влияет на агрегационный свойства тромбоцитов
Ингибитор активатора плазминогена 1-го типа
Аутосомно-доминантная тромбофилия вследствие дефицита протеина С
Аутосомно-доминантная тромбофилия вследствие дефицита протеина С
Аутосомно-доминантная тромбофилия вследствие дефицита протеина S
Аутосомно-доминантная тромбофилия вследствие дефицита протеина S
Тромбофилии в акушерской практике
В настоящее время тромбофилии являются причиной более чем 45 % случаев невынашивания беременности, 80 % преэклампсий, нередко приводя к преждевременной отслойке нормально расположенной плаценты (ПОНРП), синдрому задержки роста плода (СЗРП) с его антенатальной гибелью, а также к последовым и послеродовым кровотечениям (2, 4)
Связь тромбофилии с патологиями беременности:
F5 Лейденская мутация (G1691A)
F2 Коагуляционный фактор 2 / Протромбин (G20210A)
Риск развития тромбозов у носителей аллеля А возрастает в 2-5 раз. У беременных при наличии этой мутации значительно возрастает риск не только венозных, но и артериальных тромбозов, что может приводить к развитию инсультов и ИБС.
FGB Фириноген (G-455A)
Мутация является фактором риска периферического и коронарного тромбоза, ассоциирована со степенью атеросклеротического поражения сосудов. При беременности возрастает риск тромбозов, невынашивания беременности, тромбоэмболических осложнений в родах и послеродовом периоде.
F7 Коагуляционный фактор 7 (G10976A)
SERPINE 1 Ингибитор активатора плазминогена 1-го типа (5G>4G)
Мутации в генах тромбоцитарных факторов
MTHFR 5,10-метилентетрагидрофолатредуктаза (C677T)
Дефекты генов фолатного цикла и беременность
Определённую роль в невынашивании беременности могут играть гены, принимающие участие в метаболизме фолиевой кислоты и витамина В12.
Фолиевая кислота (витамин В9) отвечает за перенос метильных групп (СН3-) при химических реакциях в организме – это реакции, в ходе которых синтезируются ДНК, РНК и ряд аминокислот (глицин, метионин). Поэтому для беременных и для плода так важно не иметь дефицита как самой фолиевой кислоты, так и ферментов, участвующих в ее метаболизме.
Высокие концентрации активной формы фолиевой кислоты необходимы для превращения гомоцистеина в метионин. Основными генами, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, являют ся MTHFR (метилентетрагидрофолатредуктаза), MTR (метионинредуктаза) и MTRR (метионинсинтетазредуктаза). Снижение активности этих ферментов – одна из важных причин накопления гомоцистеина в организме.
Схема метаболизма фолиевой кислоты
Причины токсического действия избытка гомоцистеина на организм женщины и плода следующие (6):
Полиморфизм: названия и [синонимы]
C677T; Ala222Val; A222V
Мутантный вариант этого полиморфизма 677Т приводит к образованию термолабильного фермента и повышению уровня гомоцистеина в крови
A1298C; Glu429Ala; E429A
Повышенная частота генотипов А/С и С/С для этого полиморфизма была зарегистрирована у женщин с повторными выкидышами раннего срока.
Показано увеличение частоты встречаемости аллеля 66А гена MTRR и аллеля 2756G гена MTR у женщин с преждевременными родами в анамнезе (после 22-й недели беременности).
Полиморфизм гена MTRR A66C связан с синдромом Дауна и дефектами спинного мозга.
Нарушение имплантации эмбриона (гены TP53, LIF и другие)
На настоящий момент доказано, что экспрессия белка LIF является круциальным фактором для формирования так называемого «окна имплантации».
В эндометрии женщин с бесплодием снижена экспрессия LIF, а также было показано, что при бесплодии неясного генеза значительно снижается экспрессия LIF в среднюю секреторную фазу эндометрия.
Уровень LIF регулируется белком р53, соответственно, мутации генов сигнального пути гена TH53 опосредованно влияют и на экспрессию LIF в эндометрии. Это мутации генов TP53, MDM2, MDM4, USP7 и некоторых других (D.d’Avila Paskulin et al., 2012)
Нарушения имплантации эмбриона (генная сеть генов LIF и TP53)
Эстрогеновый рецептор 1
XbaI Polymorphism; A-351G; IVS1-351A>G
Совместное регулирование как р53 так и эстрогенами требуется для обеспечения экспрессии LIF на уровне, достаточном для имплантации бластоцисты. Учитывая, что функция эстрогенового рецептора при варианте гена rs9340799-G в гомозиготном состоянии (генотип G/G) значительно снижена, следует ожидать уменьшения количества LIF и, как следствие, нарушения имплантации бластоцисты.
Эстрогеновый рецептор 1
Совместное регулирование как р53 так и эстрогенами требуется для обеспечения экспрессии LIF на уровне, достаточном для имплантации бластоцисты. Учитывая, что функция эстрогенового рецептора при варианте гена rs2234693-C в гомозиготном состоянии (генотип C/C) значительно снижена, следует ожидать уменьшения количества LIF и, как следствие, нарушения имплантации бластоцисты.
5-гидрокситриптаминовый (серотониновый) рецептор 1A
У гомозиготных носителей варианта rs6295-C гена 5-HT1A (генотип C/C) обнаруживаются значительно более низкие показатели имплантации. Для них также свойственны значительно более высокие биохимические показатели потери беременности. PMID: 23499153
Фактор, ингибирующий лейкемию
Val64Met; Val86Met; 3400 G/A; G3400A; Arg26His
Фактор, ингибирующий лейкемию
Выявлена ассоциация варианта C полиморфизма rs929271 в 3 ‘UTR гена LIF с нарушением имплантации бластоцисты. Встречаемость C аллеля много выше у женщин с идиопатическим бесплодием в возрасте до 35 лет, но не старше.
MDM2 протоонкоген, E3 убиквитин-протеин-лигаза
Вариант rs2279744-G резко увеличивает экспрессию кодируемого MDM2 белка. Повышенное количество MDM2, в свою очередь, ингибирует p53, что снижает уровень LIF и вероятность имплантации.
MDM4, регулятор p53
Присутствие аллеля Т в полиморфизме rs1563828 гена MDM4 увеличивает экспрессию кодируемого этим геном белка-супрессора р53. Ингибирование р53, в свою очередь, приводит к снижению количества LIF и вероятности имплантации.
Простагландин-эндопероксид синтаза (простагландин G/H синтаза и циклооксигеназа)
Нейротрансмиттерный переносчик серотонина
L/S; Long/Short; 44-bp Ins/Del
У гомозиготных носителей (генотип L/L) обнаруживаются значительно более низкие показатели имплантации, более низкие клинические показатели беременности (PR) и более высокие биохимические показатели потери беременности (BPL).
Опухолевый протеин р53
Arg72Pro; Ex4+119C>G; 12139G>C; R72P
Процент женщин-носительниц аллеля Pro72 был существенно выше в выборке перенесших ЭКО в связи с повышенным числом случаев нарушений имплантации. Аллель Pro72 служит фактором риска развития недостаточности имплантации.
Убиквитин-специфическая пептидаза 7, ассоциированная с вирусом герпеса
У пациентов, несущих аллель Hausp A (генотип A/A), наблюдается значительное нарушение функции гена USP7, снижающее в итоге активность p53. Потеря активности p53 влечёт за собой снижение экспрессии гена LIF, что уменьшает количество соответствующего белка, играющего ключевую роль в процессе имплантации бластоцисты
Преэклампсия
Преэклампсия – возникающий при беременности синдром полиорганной недостаточности, в основе которого лежит увеличение проницаемости сосудстой стенки и других мембран исвязанные с этим волемические и гемодинамические нарушения.
На генетическую предрасположенность к преэклампсии влияет целый ряд генетических полиморфизмов. В настоящее время исследованы свыше 20 генов предрасположенности к гестозу, однако данные постоянно перепроверяются и пополняются.
Четко показана связь с гестозом для следующих групп генов:
Генетическая предрасположенность преэклампсии (эндотелиальной дисфункции, гестозу)
Полиморфизм: названия и [синонимы]
Эстрогеновый рецептор 1
XbaI Polymorphism; A-351G; [IVS1-351A>G]
При одновременном наличии Т/Т генотипа полиморфизма Pvull, риск преэклампсии возрастает в 3,26 раза даже при отсуствии таких факторов риска, как повышенный индекс массы тела, курение, беременность.
Эстрогеновый рецептор 1
PvuII Polymorphism; T-397C; [-397T>C]
При одновременном наличии A/A генотипа полиморфизма Xball, риск преэклампсии возрастает в 3,26 раза даже при отсуствии таких факторов риска, как повышенный индекс массы тела, курение, беременность.
Met235Thr; M235T; Met268Thr; M268T
У носительниц аллеля 235Thr повышена концентрация ангитензиногена в крови; риск развития преэклампсии в 2 раза выше, чем у носительниц «дикого» аллеля Met235.
Ins/Del, Intron 16; 289bp Alu-Ins/Del
У носительниц аллеля D упровень АФП повышен; риск развития преэклампсии в 2 раза выше, чем у носительниц «дикого» аллеля I.
Ангиотензин-превращающий фермент (Дипептидилкарбоксипептидаза 1)
Ins/Del, Intron 16; 289bp Alu-Ins/Del
Мутации гена АСЕ являются одной из причин эндотелиальной дисфункции. У носительниц генотипа D/D уровень АПФ повышен; риск развития преэклампсии и тромбоэмболий в 2 раза выше, чем у носительниц «дикого» генотипа I/I.
Синтаза оксида азота 3
Glu298Asp; E298D; [G894T; 894G>T]
Показано, что у гомозигот по минорному аллелю Asp/Asp риск развития преэклампсии выше по сравнению со среднепопуляционным в 2,45 раза. Носительницы аллеля Asp (генотипы Asp/Asp и Glu/Asp) встречаются чаще в группах беременных, страдающих гипертонией и отслойкой плаценты, по сравнению с группой женщин без данных осложнений беременности. Наличие аллеля Asp является фактором риска развития гипертензии при беременности.
T-786C; [-786 T/C; IVS1-762C>T]
Замена С на Т в регуляторной области гена ведет к снижению экспрессии гена, которая ведет к повышению тонуса артерий. Это является фактором риска спазма коронарных сосудов, в сочетании с присутствием аллеля 298Asp значительно повышает риск развития преэклампсии.
Активатор ингибитора плазминогена, тип 1 (PAI1)
4G/5G; PAI1: 4G/5G; Ins/Del G; [-675 4G/5G; Ins/Del(G)]
Полиморфизм 4G/5G является полиморфизмом инсерции/делеции нуклеотида G в промоторной области гена SERPINE1. Отсутствие одного нуклеотида в области полиморфизма получило название 4G варианта, который связан с высокой транскрипционной активностью данного гена и увеличением концентрации его продукта, что, в свою очередь, негативно воздействует на фибринолиз, повышает риск сосудистых осложнений и тромбозов. Наличие варианта 4G в гомозиготном состоянии (генотип 4G/4G) связано со значительным риском развития поликистоза яичников, а также со значительным риском возникновения осложений беременности, таких как ранние эмбриональные и преэмбриональные потери, гестозы и неудачи ЭКО. Указанные риски увеличиваются при сочетании с носительством варианта 34Leu гена полипептида A1 фактора коагуляции XIII (F13A1).
Фактор коагуляции XIII, полипептид A1
Val34Leu; Val35Leu; 9G>T
Данная мутация приводит к дефициту фактора свертывания 13, вызванной отсутствием субъединица А белка. Этот дефект приводит к склонности к кровотечениям, плохому заживлению ран и привычным выкидышам.
Интерлейкин 6 (интерферон, бета 2)
Гиперандрогения и синдром поликистозных яичников (СПКЯ)
Согласно консенсусу специального Международного симпозиума объединенной рабочей группы ESHRE/ASRM (Европейского общества репродукции и эмбриологии человека и Американского общества репродуктивной медицины). Симпозиум состоялся 1–3 мая 2003 г. в Роттердаме (Нидерланды), на нем были приняты следующие диагностические критерии постановки диагноза наличие хотя бы двух из трех утвержденных критериев позволяет после исключения иных состояний верифицировать диагноз СПКЯ. Таким образом, с одной стороны, в плане обследования СПКЯ остается синдромом (комплексом симптомов), идентификация которого невозможна и недопустима на основании изолированного наличия любого единственного диагностического критерия (одиночно от остальных двух). С другой стороны, простой анализ попарного сочетания современных критериев позволяет сделать принципиальный вывод о необходимости расширенного толкования термина СПКЯ. Это связано с дополнительным включением в его дефиницию новых клинических форм, а именно: в отсутствие другой гиперандрогенной патологии диагноз СПКЯ допустимо выставлять не только при классическим течении (полной триаде признаков), но и при наличии одного из трех неполных (неклассических) клинико-инструментальных дуэтов.
Диагностические критерии СПКЯ (по консенсусу Симпозиума рабочей группы ESHRE/ASRM):
Основные мутации, приводящие к развитию СПКЯ
(CAG)n repeat; (3bp)n, Short/Long (S/L)
При уменьшенном количестве (CAG)-повторов у женщин возрастает риск развития рака груди, эндометрия, синдрома поликистозных яичников и гиперандрогении (является фактором риска развития инсулинорезистетности, но лишь при наличии других факторов риска).
Мутации в гене SRD5A1 повышают уровень активности фермента, что приводит к увеличению синтеза дигидротестостерона. Дигидротестостерон обладает более выраженным андрогенным эффектом, чем тестостерон.
Фермент преобразует прегненолон и прогестерон в дегидроэпиандростерон (DHEA) и андростендион. Мутации в этом гене связаны с псевдогермафродитизмом и гиперплазией коры надпочечников.
Цитохром P450, семейство 11, подсемейство А, полипептид 1 (Фермент, расщепляющий боковую цепь холестерина)
При увеличении числа (TTTTA)n повторов (вариант L, где n>16) в гене CYP11A1 повышается продукция андрогенов, что является фактором риска развития СПКЯ.
Цитохром P450, семейство 21, подсемейство A, полипептид 2
Мутация ведет к развитию неклассической (постпубертатной) формы врожденной дисфункции коры надпочечников. При этой форме заболевания первые признаки появляются только во время полового созревания. Высок риск бесплодия и невынашивания беременности.
Показано, что риск развития ановуляции у носительниц аллеля III гена INS повышен по сравнению с носительницами генотипа I/I. Это связано с тем, что гиперинсулинемия/резистентность к инсулину опосредует снижение чувствительности гипофиза к гонадотропин-релизинг гормону, что способствует ановуляции.
Рецептор гамма, активируемый пролифератором пероксисом
Pro12Ala; P12A (протективный)
У носителей мутантного аллеля 12Ala повышена чувствительность к инсулину. Это является протективным фактором в отношении риска развития диабета 2 типа и СПКЯ. Однако, протективный эффект нивелируется при ожирении и повышении индекса массы тела.
Показания к назначению исследования на СПКЯ (8):

