Натрий серноватистокислый что это
Тиосульфат натрия (Е539)

Тиосульфат натрия выполняет функции регулятора кислотности (антиокислителя), антислеживающего агента или консерванта. Применение тиосульфата как пищевой добавки позволяет увеличить сроки хранения и качество продукции, предупредить гниение, закисание, брожение. В чистом виде это вещество участвует в технологических процессах изготовления пищевой йодированной соли как стабилизатор йода и используется для обработки хлебопекарской муки, склонной к слеживанию и комкованию.
Применение пищевой добавки Е539 ограничивается исключительно промышленной сферой, вещество не поступает в розничную продажу. В медицинских целях тиосульфат натрия используется как противоядие при тяжелых отравлениях и противовоспалительное средство наружного применения.
общие сведения
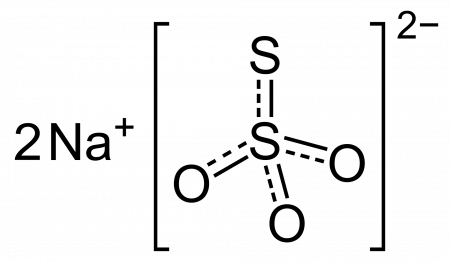
Тиосульфат (гипосульфит) – это неорганическое соединение, которое является натриевой солью тиосерной кислоты. Вещество представляет собой бесцветный порошок без запаха, который при ближайшем рассмотрении оказывается прозрачными моноклинными кристаллами.
Гипосульфит является неустойчивым соединением, которое не встречается в природе. Вещество образует кристаллогидрат, который при нагревании выше 40 °С плавится в собственной кристаллической воде и растворяется. Расплавленный тиосульфат натрия склонен к переохлаждению, а при температуре около 220 °С соединение полностью разрушается.
Тиосульфат натрия: синтез
Серноватистокислый натрий был впервые получен искусственным путем в лабораторных условиях методом Леблана. Это соединение является побочным продуктом производства соды, которое образуется в результате окисления сульфида кальция. Взаимодействуя с кислородом, сульфид кальция частично окисляется до тиосульфата, из которого с помощью сульфата натрия получают Na2S2O3.

Вышеуказанные методы позволяют получить тиосульфат натрия как побочный продукт реакции или в виде водного раствора, из которого нужно выпарить жидкость. Получить щелочной раствор серноватистокислого натрия можно, растворив его сульфид в насыщенной кислородом воде.
Чистое безводное соединение тиосульфата является результатом взаимодействия соли натрия и азотистой кислоты с серой в веществе, известном как формамид. Реакция синтеза протекает при температуре 80 °С и длится около получаса, ее продукты – тиосульфат и его оксид.
Во всех химических реакциях гипосульфит проявляет себя как сильный восстановитель. В реакциях взаимодействия с сильными окислителями Na2S2O3 окисляется до сульфата или серной кислоты, со слабыми – до тетратионовой соли. Реакция окисления тиосульфата является основой йодометрического метода определения веществ.
Отдельного внимания заслуживает взаимодействие тиосульфата натрия со свободным хлором, который является сильным окислителем и ядовитым веществом. Гипосульфит легко окисляется хлором и переводит его в безвредные водорастворимые соединения. Таким образом, это соединение препятствует разрушительному и токсическому воздействию хлора.
В промышленных условиях тиосульфат добывают из отходов газового производства. Самым распространенным сырьем является светильный газ, который выделяется в процессе коксования угля и содержит примеси сероводорода. Из него синтезируют сульфид кальция, который подвергают гидролизу и окислению, после чего соединяют с сульфатом натрия для получения тиосульфата. Несмотря на многостадийность, этот способ считается наиболее экономически выгодным и экологически чистым методом добычи гипосульфита.
| Систематическое наименование | Тиосульфат натрия (Sodium thiosulfate) |
|---|---|
| Традиционные наименования | Серноватистокислый натрий, гипосульфит (натрия) соды, антихлор |
| Международная маркировка | Е539 |
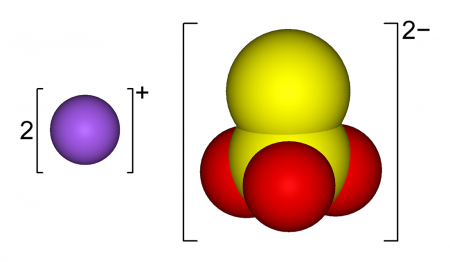
| Химическая формула | Na2S2O3 |
| Группа | Неорганические тиосульфаты (соли) |
| Агрегатное состояние | Бесцветные моноклинные кристаллы (порошок) |
| Растворимость | Растворим в воде, нерастворим в спиртах |
| Температура плавления | 50 °С |
| Критическая температура | 220 °С |
| Свойства | Восстановительные (антиокислительные), комплексообразующие |
| Категория пищевой добавки | Регуляторы кислотности, вещества против слеживания (антислеживатели) |
| Происхождение | Синтетическое |
| Токсичность | Не исследована, вещество условно безопасно |
| Области применения | Пищевая, текстильная, кожевенная промышленность, фотодело, фармацевтика, аналитическая химия |
Тиосульфат натрия: применение

Современные направления применения гипосульфита в промышленности:
Серноватистокислый натрий используют в качестве реактива в аналитической и органической химии, им нейтрализуют сильные кислоты, обезвреживают тяжелые металлы и их токсические соединения. Реакции взаимодействия тиосульфата с различными веществами являются основой йодометрии и бромометрии.
Пищевая добавка Е539
Тиосульфат натрия не является широко распространенной пищевой добавкой и не находится в свободном доступе из-за неустойчивости соединения и токсичности продуктов его распада. Гипосульфит участвует в технологических процессах производства пищевой йодированной соли и хлебобулочных изделий в качестве регулятора кислотности и антислеживателя (антикомкователя).
Добавка Е539 выполняет функции антиокислителя и консерванта при изготовлении овощных и рыбных консерв, десертов и алкогольных напитков. Это вещество также входит в состав химикатов, которыми обрабатывают поверхность свежих, сушеных и замороженных овощей и фруктов.
Консервант и антиоксидант Е539 используют для улучшения качества и увеличения срока годности таких продуктов:
При изготовлении поваренной йодированной соли пищевую добавку Е539 применяют для стабилизации йода, что позволяет существенно продлить сроки хранения продукта и сохранить его пищевую ценность. Предельно допустимая концентрация Е539 в поваренной соли составляет 250 мг на 1 кг.
В хлебопекарном деле активно используют тиосульфат натрия в составе различных добавок для улучшения качества продукции. Хлебопекарные улучшители бывают окислительными и восстановительными. Антислеживатель Е539 относится к улучшителям восстанавливающего действия, которые позволяют изменить свойства пшеничной муки.
На предприятиях антислеживатель добавляют в муку вместе с дрожжами непосредственно перед замешиванием теста. Содержание тиосульфата в муке составляет 0,001-0,002 % ее массы в зависимости от технологии изготовления хлебобулочного изделия. Санитарно-гигиенические нормы для добавки Е539 составляют 50 мг на 1 кг пшеничной муки.
Антислеживатель Е539 используют в технологических процессах в строгой дозировке, поэтому риск отравления тиосульфатом при употреблении мучных изделий отсутствует. Мука, предназначенная для розничной реализации, перед продажей не обрабатывается. В пределах нормы добавка безопасна и не оказывает токсического действия на организм.
Использование в медицине и его влияние на организм
Гипосульфит соды входит в перечень основных лекарственных средств Всемирной организации здравоохранения как один из наиболее эффективных и безопасных лекарственных препаратов. Его вводят под кожу, внутримышечно и внутривенно как раствор для инъекций или применяют в качестве наружного средства.
В начале ХХ века тиосульфат натрия был впервые использован как противоядие при отравлении синильной кислотой. В сочетании с нитритом натрия, тиосульфат рекомендуют для особо тяжелых случаев отравления цианидами и вводят внутривенно для превращения цианидов в нетоксичные тиоцианаты, которые впоследствии можно безопасно вывести из организма.
Медицинское применение серноватисто-кислого натрия:
Влияние гипосульфита на организм человека при пероральном употреблении не изучено, поэтому нельзя судить о пользе и вреде вещества в чистом виде или в составе продуктов питания. Случаев отравления добавкой Е539 зарегистрировано не было, поэтому ее принято считать нетоксичной.
Тиосульфат натрия и законодательство
Тиосульфат натрия входит в перечень пищевых добавок, разрешенных для применения при изготовлении продуктов питания в России и Украине. Антислеживающий агент и регулятор кислотности Е539 используют согласно установленным санитарно-гигиеническим нормам исключительно в промышленных целях.
Ввиду того, что действие химического вещества на организм человека при пероральном применении до сих пор не изучено, добавка Е539 не разрешена к применению в странах ЕС и США.
Тиосульфат натрия
| Тиосульфат натрия | |||
|---|---|---|---|
| |||
| Систематическое наименование | тиосульфат натрия | ||
| Традиционные названия | гипосульфит | ||
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) | ||
| Молярная масса | 158,11 г/моль | ||
| Плотность | 2,345 г/см³ | ||
| Температура | |||
| • плавления | 48,5 °С (пентагидрат) | ||
| • разложения | 300 °C | ||
| Растворимость | |||
| • в воде | 70,1 20 ; 229 80 г/100 мл | ||
| Рег. номер CAS | 7772-98-7 | ||
| PubChem | 24477 | ||
| Рег. номер EINECS | 231-867-5 | ||
| SMILES | |||
| Кодекс Алиментариус | E539 | ||
| RTECS | XN6476000 | ||
| ChEBI | 132112 | ||
| ChemSpider | 22885 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Тиосульфат натрия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
Содержание
Получение
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
Физические и химические свойства
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль.
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C)).
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100 о С.
При нагревании до 220 °C распадается по схеме:
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, йодом, переводится в соли тетратионовой кислоты:
Приведённая реакция очень важна, так как служит основой йодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия йодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
Натрий серноватистокислый что это
НАТРИЙ СЕРНОВАТИСТОКИСЛЫЙ (НАТРИЯ ТИОСУЛЬФАТ) 5-ВОДНЫЙ
Reagents. Sodium thiosulphate, 5-aqueous. Specifications
ОКП 26 2112 0820 02
Дата введения 1987-07-01
Постановлением Государственного комитета СССР по стандартам от 29 октября 1986 г. N 3321 дата введения установлена 01.07.87
Ограничение срока действия снято по протоколу N 5-94 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 11-12-94)
ПЕРЕИЗДАНИЕ. Апрель 2003 г.
Формула: 
Стандарт полностью соответствует стандарту СЭВ 223-85.
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. Серноватистокислый натрий должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
1.2. Физико-химические показатели серноватистокислого натрия должны соответствовать нормам, указанным в таблице.
Чистый для анализа (ч.д.а.)
ОКП 26 2112 082200
Чистый (ч.)
ОКП 26 2112 082101
1. Массовая доля серноватистокислого натрия (
2. Массовая доля нерастворимых в воде веществ, %, не более
3. Массовая доля сульфатов и сульфитов в пересчете на сульфаты (SO ), %, не более
4. Массовая доля сульфидов (S), %, не более
5. Массовая доля кальция (Са), %, не более
6. Массовая доля тяжелых металлов (Рb), %, не более
7. Массовая доля железа (Fe), %, не более
8. рН 5%-ного раствора
3. МЕТОДЫ АНАЛИЗА
Масса средней пробы не должна быть менее 600 г.
3.3. Определение массовой доли серноватистокислого натрия
3.3.1. Реактивы, растворы, аппаратура и посуда
Вода дистиллированная по ГОСТ 6709-72.
Йод по ГОСТ 4159-79, раствор концентрации 
Крахмал растворимый по ГОСТ 10163-76, раствор с массовой долей 1%, готовят по ГОСТ 4517-87.
Весы лабораторные типа ВЛР-200 2-го класса точности или другие с ценой деления 0,0001 г.
Колба Кн-2-250-34 ТХС по ГОСТ 25336-82.
3.3.2. Проведение анализа
1,0000 г препарата растворяют в 100 см воды и титруют раствором йода, прибавляя в конце титрования 1 см раствора крахмала.
3.3.3. Обработка результатов
Массовую долю серноватистокислого натрия ( ) в процентах вычисляют по формуле

— масса навески препарата, г;
3.4. Определение массовой доли нерастворимых в воде веществ
3.4.1. Реактивы, аппаратура и посуда
Вода дистиллированная по ГОСТ 6709-72.
Тигель фильтрующий ТФ ПОР 10 или ТФ ПОР 16 по ГОСТ 25336-82.
Весы лабораторные типа ВЛР-200 2-го класса точности или другие с ценой деления 0,0001 г.
Весы лабораторные технические типа ВЛТ-1 1-го класса точности или другие с ценой деления 0,01 г.
Стакан В-1-250 ТХС по ГОСТ 25336-82.
3.4.2. Проведение анализа
30,00 г препарата помещают в стакан и растворяют в 100 см воды. Раствор фильтруют через фильтрующий тигель, предварительно доведенный до постоянной массы и взвешенный (результат взвешивания записывают с точностью до четвертого десятичного знака). Остаток на фильтре промывают 100 см горячей воды и сушат в сушильном шкафу при температуре 105-110 °С до постоянной массы.
3.4.3. Обработка результатов
Массовую долю веществ, нерастворимых в воде, ( ), в процентах вычисляют по формуле

— масса навески препарата, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 15% среднего результата определения.
Пределы допускаемой относительной суммарной погрешности результата анализа составляют ±20% при доверительной вероятности =0,95.
3.5. Определение массовой доли сульфатов и сульфитов в пересчете на сульфаты
3.5.1. Реактивы, растворы и посуда
Реактивы и растворы по ГОСТ 10671.5-74.
Йод по ГОСТ 4159-79, раствор концентрации 
Натрий серноватистокислый (натрия тиосульфат), раствор концентрации 
Колба коническая Кн-2-50-18 ТХС по ГОСТ 25336-82.
3.5.2. Проведение анализа
1,00 г препарата помещают в стакан и растворяют в 100 см воды (если раствор мутный, его фильтруют через промытый горячей водой беззольный фильтр).
Через 30 мин после прибавления реактивов к анализируемому раствору прибавляют 1-2 капли раствора серноватистокислого натрия (раствор должен обесцветиться) и заканчивают определение фототурбидиметрическим или визуально-нефелометрическим методом (способ 1).
Препарат считают соответствующим требованиям настоящего стандарта, если масса сульфатов и сульфитов не будет превышать:
Тиосульфат натрия
| Тиосульфат натрия | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | тиосульфат натрия |
| Традиционные названия | гипосульфит |
| Химическая формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) |
| Физические свойства | |
| Молярная масса | 158,11 г/моль |
| Плотность | 1,667; гидр. 1,715 г/см³ |
| Термические свойства | |
| Химические свойства | |
| Растворимость в воде | 70,1 20 ; 229 80 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7772-98-7 |
| Рег. номер PubChem | 24477 |
| SMILES | [Na+].[Na+].[O-]S([O-])(=O)=S |
| RTECS | XN6476000 |
Содержание
Получение
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
Свойства
Бесцветные моноклинные кристаллы. Молярная масса 248,17 г/моль (пентагидрат).
Растворим в воде (41,2 % при 20 о С, 69,86 % при 80 о С).
При 48,5 °C плавится в своей кристаллизационной воде, обезвоживается около 100 о С.
При нагревании до 220 °C распадается по схеме:
Тиосульфат натрия сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты:
Приведённая реакция очень важна, так как служит основой иодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается:
Расплавленный тиосульфат натрия очень склонен к переохлаждению.
Применение
См. также
Ссылки
Полезное
Смотреть что такое «Тиосульфат натрия» в других словарях:
ТИОСУЛЬФАТ НАТРИЯ — (Na2S2O35H2O), химикат, используемый для получения фотографий в качестве фиксирующего раствора. Обычно окисляется при добавлении метабисульфита натрия … Научно-технический энциклопедический словарь
Тиосульфат натрия — серноватистокислый натрий, гипосульфит натрия Na2S2O3. Т. н. бесцветные кристаллы, хорошо растворимые в воде (41,2% по массе при 20 °С, 69,9% при 80 °С). Т. н. образует несколько кристаллогидратов; в промышленности и в лабораториях… … Большая советская энциклопедия
тиосульфат натрия — антихлор, серноватистокислый натрий … Cловарь химических синонимов I
Тиосульфат натрия (лекарственное средство) — Эта статья о лекарственном средстве «Тиосульфат натрия». О химическом соединении см. Тиосульфат натрия. Тиосульфат натрия соль, используется в виде растворов в качестве лекарственного средства дезинтоксикационного и… … Википедия
НАТРИЯ ТИОСУЛЬФАТ — Natrii thyosulfatis. Синонимы: гипосульфит натрия, серноватистокислый натрий. Свойства. Натрия тиосульфат представляет собой бесцветные прозрачные кристаллы без запаха, солоновато горького вкуса. Легко растворим в воде (1:1), практически нераств … Отечественные ветеринарные препараты
Натрия тиосульфат — Тиосульфат натрия (антихлор, гипосульфит, сульфидотриоксосульфат натрия) Na2S2O3 или Na2SO3S, соль натрия и тиосерной кислоты. В обычных условиях существует в виде пентагидрата Na2S2O3·5H2O. См. также статью: Тиосульфат натрия (лекарственное… … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
Натрия тиосульфат — Na2S2O3, см. Тиосульфат натрия, Тиосульфаты … Большая советская энциклопедия
Натрия сульфит — сернисто кислый натрий, Na2SO3, соль; бесцветные кристаллы, плотность 2,63 г/см3. Растворимость в воде (%): 20,82 (19,9 °С), 21,70 (99 °С). При обычной температуре из водных растворов кристаллизуется Na2SO3․7H2O. Н. с. сильный… … Большая советская энциклопедия
НАТРИЯ ТИОСУЛЬФАТ — Действующее вещество ›› Натрия тиосульфат (Sodium thiosulfate) Латинское название Natrii thiosulfas АТХ: ›› V03AB06 Натрия тиосульфат Фармакологические группы: Детоксицирующие средства, включая антидоты ›› Противопаразитарные средства… … Словарь медицинских препаратов