Как понять что у кота опухоль мозга
Новообразования (опухоль) головного мозга у кошек
Опухоль головного мозга у кошек – тяжело протекающая патология, на ранних стадиях неоплазия – это бессимптомный процесс. Своевременно выявить новообразования головного мозга поможет профилактика, проведение высокоинформативных исследований – КТ и МРТ. В ВЦ «Рос-Вет» напоминают, что периодический (1-2 раза) в год вызов ветеринарного врача уменьшит число «случайных» заболеваний, диагностированных несвоевременно.
Какие виды бывают
Новообразования формируются непосредственно из тканей мозга или его оболочек или проникают «извне» из прилегающих структур. Опухоль нередко бывает следствием метастазирования рака из других органов и систем, проникает по гематогенному (лимфогенному) пути. Причины их формирования доподлинно не известны, предполагается, что в возникновении новообразований играет роль совокупность факторов. Опухоль мозга у кошек может формироваться по причине нарушения диеты, из-за воздействия внешней среды (химия, экология, вирусы), как следствие травм, снижения иммунитета.
Какие опухоли диагностируют в ВЦ «Рос-Вет»:
Первичные новообразования формируются непосредственно из тканей мозга. Вторичные – это проникающие в мозг посредством метастазирования или чрезмерного разрастания от смежных структур.
У кошек, в ВЦ «Рос-Вет», ветеринарные врачи чаще находят опухоли: глиомы, менингиомы, папилломы, макрокарциному гипофиза и пр.
Какие симптомы можно заметить самостоятельно
Понять владельцу, что у кошки в головном мозге формируется опухоль, на первых этапах невозможно. Большинство новообразований проявляют себя при значительном объеме, когда начинают сдавливать внутримозговые структуры. Происходит выпадение жизненно-важных функций, но и при явных клинических симптомах нужно исключить заболевания, схожие по признакам с опухолью.
В самом начале владелец кошки может заподозрить неладное по следующим симптомам:
Подобные поведенческие реакции не являются характерными для опухолей под черепной коробкой. Просто указывают на дискомфорт в самочувствии животного. Длительность бессимптомного течения объясняется адаптацией тканей мозга к изменению давления, сама кошка может приспосабливаться к некоторым симптомам, и хозяин это списывает на особенности характера питомца.
Сила неврологических признаков опухоли головного мозга у кошек напрямую зависит от локализации и размера новообразования, степени сдавливания окружающих тканей и формирования метастаз.
Когда патологический процесс запущен:
Не исключены параплегии и параличи, хотя они больше характерны для опухолей спинного мозга. Нередки кратковременные, частичные выпадения слуха, зрения. Если нервы, отвечающие за восприятие окружающего мира, будут «поглощены» новообразованием, то кошка полностью ослепнет.
Диагностика новообразований
В первую очередь, ветеринарный врач-невролог, изучает анамнез, анализирует, что ему рассказывает владелец. Оценивает насколько поведение питомца изменилось, за какое время.
| Передний мозг | Мозжечок | Вестибулярный аппарат | Ствол мозга |
| При поражении коры больших полушарий кошка совершает движения по кругу с наклоном в ту сторону, в которой сформирована опухоль. Голова опущена, изменен аппетит, жажда, депрессия, судороги, потеря ориентации. Если поражен гипоталамус происходит потеря зрения. | Гиперметрия, тремор, усиливающийся при резких движениях, кошка стоит неестественно, лапы широко расставлены. | Косоглазие, нистагм, движение по кругу, плохой аппетит и рвота, атаксия, голова наклонена. | Параличи, атаксия, слабость мышц, лап с одной стороны, изменения работы сердца и легких, кома. |
Далее кошку обследуют полностью, делают все, чтобы визуализировать новообразование и поставить диагноз. Обязательно дифференцируют неоплазмы от иных расстройств, инфекций, нарушения обмена веществ. Делают :
Биопсия – достоверный метод, который может подтвердить наличие новообразований в головном мозге и их злокачественность. Делается она под контролем КТ и МРТ.
Какое лечение будет действенным
Сейчас в ветеринарной практике используют:
Не всегда назначение препаратов оправдано, так как через ГЭБ проходят не все химические средства. Если клетки новообразования не одинаковы не все они могут быть чувствительны к однотипной химиотерапии. Высокие дозы нанесут непоправимый вред органам и структурам, животное может погибнуть от токсического действия препаратов.
В 95% случаев диагностирования новообразований головного мозга у кошек прогноз неблагоприятный. Это объясняется возрастом, опухоль встречается у животных после 10 лет, когда уже есть масса сопутствующих заболеваний. Невозможность добраться и отделить новообразование от здоровых тканей, а также метастазирование в смежные структуры не позволяет врачу-хирургу провести удаление. В этом случае лечение направлено на поддержание приемлемого качества жизни кошки, купирование симптомов.
Когда Вы заметили, что кошка ведет себя нестандартно, у нее появились «странные» привычки, характер изменился или о ее нездоровье говорит внешний вид – не медлите! Позвоните в ветеринарный центр «Рос-Вет» по телефону +7 (495) 256-11-11, запишитесь на консультацию или вызовите врача на дом. Помните, что сомнения и промедление стоят питомцу жизни!
Опухоли головного мозга у кошек — не всегда смертный приговор
Самый распространенный тип опухоли у кошек — менингиома (56% опухолей головного мозга).
На самом деле, называть это состояние «опухолью головного мозга» не совсем правильно. Аномальные клетки, образующие массу, возникают не в головном мозге, а в покрывающей его мембране (мозговых оболочках).
Часто менингиомы смертельны. Они давят на близлежащие части мозга и разрушают их. А когда они достаточно велики — увеличивают давление внутри черепа, что может иметь критические последствия.
Причины
Причины, которые могут вызвать опухоль головного мозга у кошек — неизвестны. Предполагается, что могут быть задействованы различные факторы питания, окружающей среды, генетические, химические и иммунные системы.
Симптомы
Клинические признаки обычно появляются медленно.
Кризис — необходима немедленная помощь ветеринарна:
Важно! Большинство животных инстинктивно скрывают свою боль. Любые необычные звуки вашего питомца могут указывать на то, что их боль и беспокойство стали невыносимыми.
Диагностика
Вам также необходимо предоставить предшествующую историю симптомов и возможные инциденты, которые могли спровоцировать это состояние (например, травма головы могла вызвать скопление жидкости в черепе).
Способы лечения
Существует три основных метода лечения:
Хирургическое удаление — лучший способ лечения кошек с менингиомами.
Профилактика
В связи с тем, что причины опухолей головного мозга неизвестны, сложно установить конкретные методы профилактики.
Новообразования головного мозга собак и кошек
Авторы: Гиршов А. В., ветеринарный врач-терапевт, онколог; Албул А.В., ветеринарный врач-невролог, нейрохирург. Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Интракраниальные опухоли головного мозга занимают достаточно мало места в структуре всех неоплазий мелких домашних животных. Но несмотря на низкую частоту встречаемости этой группы заболеваний, необходимо учитывать возможность опухолевого поражения головного мозга у животных с неврологическими расстройствами и дефицитами.
Эпидемиология
Классификация
Классификация базируется на базе цитологических и гистологических критериев. Опухоли головного мозга подразделяются на первичные и вторичные. Первичные опухоли зарождаются в тканях самого головного мозга. В зависимости от происхождения делятся на опухоли, происходящие из нейронов, нейроэпителиальные, глиальные, менингеальные. Большинство первичных опухолей происходит из нейроглии (глиомы), астроцитов (астроцитомы), олигодендроцитов (олигодендроглиомы) и эпендимальных клеток (эпендимомы). Также существуют смешанные формы, содержащие астроцитарный и олигодендроглиальный компоненты (смешанно-клеточная или олигоастроцитома). Могут быть обнаружены смешанные глионевральные опухоли, содержащие в себе элементы глии и нейроны, например ганглиоглиомы, дизэмбриопластическая нейроэпителиальная опухоль, а также опухоли, происходящие только из нейронов (ганглиоцитома, центральная ганглиоцитома).
Таблица №1. Классификация интракраниальных опухолей.
Опухоли из окружающих тканей
Клинические признаки
Клинические признаки интракраниальных опухолей весьма разнообразны и обычно представлены нарушением ментального статуса, дезориентацией и утратой привычных действий. Большинство специфических клинических признаков зависит от локализации опухоли. На начальных стадиях клинические признаки могут быть кратковременны и непостоянны, но по мере роста опухоли они становятся более выраженными и постоянными.
Эпилептиформные приступы могут быть одним из первых признаков опухоли коры головного мозга. Множественный дефицит черепных нервов характерен для опухоли вентральной части ствола мозга. Дисметрия, судорожная готовность и атаксия могут быть при опухолях мозжечка. Ухудшение зрения и слепота – гипоталамус или менингиома зрительного нерва. Первичные опухоли головного мозга обычно не сопровождаются паранеопластическими синдромами. Исключение может составлять аденома гипофиза, приводящая к гиперадренокортицизму. Также клинические признаки в основном обусловлены нарастающим внутричерепным давлением, эффектом массы и отеком мозга. Крайне опасное осложнение со смертельным исходом – это вклинивание мозга через foramen magnum. При этом наблюдаются изменение сознания, летаргия, навязчивая ходьба, манежные движения, беспорядочные движения, дыхательная недостаточность. Вклинивание у таких животных возможно при неправильном заборе ликвора и недостаточной подготовке животного к этой манипуляции.
Таблица №2. Возможные клинические признаки интракраниальных опухолей в
зависимости от локализации.
Диагностика
Обследование животного с признаками поражения головного мозга должно
включать:
1. Рутинное гематологическое и биохимическое исследование для исключения экстракраниальных причин (уремия и т. д.), сопутствующих заболеваний.
2. Рентгенографию черепа с целью выявления остеолиза или гиперостоза костей черепа, что характерно для менингиомы у кошек, первичного новообразования носовой полости и параназальных синусов или новообразования костей черепа.
3. Обзорную рентгенографию грудной и брюшной полости для выявления первичных новообразований и сопутствующих заболеваний.
4. УЗИ грудной и брюшной полости для обнаружения первичной опухоли и диагностики сопутствующих заболеваний.
5. Анализ ликвора с целью диагностики воспалительных заболеваний головного мозга, что очень важно для дифференциального диагноза. Предпочтительно использовать методы осаждения. В некоторых случаях это позволяет обнаружить атипичные клетки. Также этим методом возможно диагностировать нейролейкоз. Спинномозговая пункция у таких животных должна проводиться с особой осторожностью. При повышенном внутричерепном давлении существует опасность вклинивания головного мозга в случае резкого падения давления. Возможные меры профилактики подобного осложнения – это медленное отведение ликвора, предварительная инфузия маннитола и гипервентиляция.
6. Электроэнцефалографию. Данный метод диагностики при опухолевом поражении головного мозга основан на том, что, как правило, опухолевая ткань электрически нейтральна. Подобные изменения электроэнцефалограммы могут дать основания для дальнейшей диагностики в направлении поиска неоплазии головного мозга.
7. Магнитно-резонансную томографию (МРТ) для определения размера, формы и точной локализации новообразования и предположения типа опухоли (табл. 3). МРТ имеет значительные преимущества перед компьютерной томографией (КТ): более качественная визуализация интракраниальных мягких тканей, возможность дифференцировать более тонкие изменения в тканях (отек, изменения сосудов, кровоизлияния и некроз).
8. Биопсию. Прижизненная биопсия достаточно сложна и не во всех случаях выполнима. Для биопсии необходимо точно знать локализацию опухоли, поэтому биопсия проводится только после МРТ. Возможность проведения биопсии зависит от локализации новообразования и общего статуса животного. Часто биопсия выполняется только посмертно.
Таблица №3. Предположительная диагностика опухолей головного мозга по
данным МРТ.
Поддерживающее и симптоматическое лечение включает антиконвульсивную терапию (фенобарбитал 2-4 мг/кг внутрь каждые 12 часов) и кортикостероидную терапию (метилпреднизолон 10-15 мг/кг).
Менингиомы полости черепа у собак и кошек: обновленный обзор
Резюме
Менингиомы – самые распространенные первичные опухоли головного мозга у собак и кошек. Существует несколько морфологических фенотипов этого новообразования, расположенного вне вещества мозга; отмечена предрасположенность к определенным анатомическим локализациям. Предпринимался ряд попыток применить текущую классификацию менингиом человека Всемирной Организации Здравоохранения (ВОЗ) к собакам и кошкам и получить универсальную схему классификации для домашних животных. Недавно были определены конкретные ферменты, участвующие в опухолевом росте, которые можно использовать в качестве биологических маркеров, связанных со степенью злокачественности. Также исследовались вторичные эффекты менингиом; сообщалось, что сосудистый эндотелиальный фактор роста и отек тканей вокруг опухоли уменьшают время выживания.
И у собак, и у кошек известна породная и возрастная предрасположенность, а клинические признаки довольно постоянны. Магнитно-резонансная томография и компьютерная томография считаются предпочтительными методами постановки предварительного диагноза менингиомы у домашних животных, однако методы визуальной диагностики постоянно совершенствуются. Методы лечения менингиом включают хирургическое уменьшение объема опухоли, химиотерапию и лучевую терапию; в литературе подробно описано несколько протоколов лечения.
Введение
Менингиома – наиболее часто встречающаяся первичная опухоль мозга у собак и кошек (Troxel et al., 2003; Snyder et al., 2006). Она возникает из клеток покрывающих грануляции паутинной оболочки, особенно в точке проекции в венозные синусы (Summer et al., 1995). Учитывая развитие из мезенхимы и нервного гребня и широкий набор функций, выполняемых клетками паутинной оболочки (Kepes, 1986), неудивительно, что менингиомы характеризуются высокой морфологической и иммунофенотипической вариабельностью. Тем не менее у человека биологическое поведение менингиом, кроме анапластических, обычно считается доброкачественным (Louis et al., 2007); это же относится к менингиомам собак и кошек.
Этот обзор был написан, чтобы собрать обновленную информацию для практикующих врачей и патологов, которые могут встретиться с внутричерепными менингиомами собак и кошек. В нем рассматриваются клинические признаки, диагноз, макроскопическая анатомия, гистологическая классификация, лечение, прогноз и будущие возможные исследования менингиом собак и кошек.
Согласно недавнему ретроспективному анализу первичных внутричерепных новообразований собак и кошек, менингиома была диагностирована в 45% (Snyder et al., 2006) и 85% (Troxel et al., 2003) случаев, соответственно; на менингиомы приходится 22,3% (Snyder et al., 2006, 2008) и 59% (Troxel et al., 2003) новообразований мозга у собак и кошек.Менингиомы представляют собой экстрааксиальные опухоли центральной нервной системы (ЦНС), развивающиеся в пределах твердой оболочки, но за пределами паренхимы головного и спинного мозга, однако, способные прорастать в нервную ткань.
У людей большинство менингиом развивается в выпуклых участках мозга, часто располагаются парасагиттально и связаны с серпом мозга и венозными синусами (Louis et al., 2007). Большинство менингиом собак прилегает к своду черепа, и значительное количество этих опухолей поражает область обонятельной/лобной коры, дно полости черепа, перекрест зрительных нервов или область над турецким седлом или вокруг него (Patnaik et al., 1986; Snyder et al., 2006; Sturges et al., 2008) (Рис. 1). Прочие, менее распространенные локализации, включают область мозжечка, моста и продолговатого мозга (Bagley et al., 2000; Kaldrymidou et al., 2001; Kitagawa et al., 2004; Sturges et al., 2008; Holland et al., 2010), пространство за глазным яблоком (Patnaik et al., 1986; Willis et al., 1997; Pérez et al., 2005) и полость среднего уха (Owen et al., 2004).У кошек опухоль часто развивается в сосудистой выстилке третьего желудочка, мозговых оболочках над мозжечковым наметом (Troxel et al., 2003; Mandara et al., 2006) (Рис. 2) и (редко) в оболочках мозжечка (Quesnel and Parent, 1995; Kaldrymidou et al., 2000; Troxel et al., 2003; Tomek et al., 2008). Менингиомы у них часто бывают множественными (Luginbohl, 1961; Zaki and Hurvitz, 1976; Nafe, 1979; Averill, 1987; Gordon et al., 1994; Lobetti et al., 1997; Troxel et al., 2003; Forterre et al., 2007; Tomek et al., 2008), что встречается примерно в 17% случаев менингиомы (Nafe, 1979; Summer et al., 1995; Troxel et al., 2003) (Рис. 3); в то время как у собак очень редко удается обнаружить более одной менингиомы (McDonnell et al., 2007; Sturges et al., 2008).
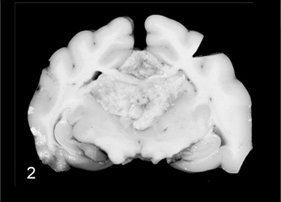
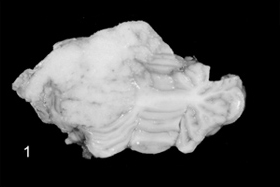
Рис. 2. Менингиома у кошки (зернистоклеточный гистотип), распространяющаяся от третьего желудочка в поясную извилину, пересекая мозолистое тело. Новообразование сильно обызвествлено и имеет неравномерную поверхность среза.
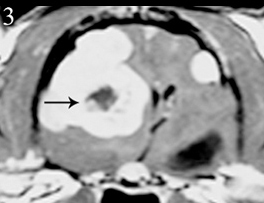
У собак и кошек описаны случаи внутричерепных менингиом в сочетании с сопутствующими нарушениями нервной системы (Stacy et al., 2003; Troxel et al., 2003; Snyder et al., 2006; Ginel et al., 2009) или другими нарушениями, например мукополисахаридозом 1 типа (Haskins and McGrath, 1983), лимфомой тимуса (Lobetti et al., 1997) и другими несвязанными опухолями (Snyder et al., 2006). В частности, у 139% кошек и 19% собак менингиома развивается в сочетании с другим новообразованием полости черепа (Stacy et al., 2003; Troxel et al., 2003; Snyder et al., 2006). Кроме того, у кошек возможны сопутствующие доброкачественные и злокачественные множественные менингиомы (Lu et al., 2003).
Клинические особенности и диагноз
Порода, пол, возраст и неврологические симптомы
Обычно менингиомы встречаются у долихоцефалических пород, особенно немецких овчарок, золотистых ретриверов и лабрадор-ретриверов, половой предрасположенности не отмечено (Snyder et al., 2006; Sturges et al., 2008). Известно, что у боксеров эти новообразования встречаются с большей частотой (Snyder et al., 2006; Sturges et al., 2008). Домашние короткошерстные кошки, по-видимому, предрасположены к менингиомам, значительных половых различий не отмечено (Troxel et al., 2003; Tomek et al., 2006). В большинстве опубликованных случаев менингиомы диагностировались у собак старше 7 лет и у кошек старше 9 лет (Nafe, 1979; Troxel et al., 2003; Snyder et al., 2006; Tomek et al., 2006), но иногда встречались у кошек
Хотя у большинства животных с новообразованиями мозга отмечается ряд легких или слабовыраженных неврологических симптомов, наиболее распространенными клиническими признаками у собак и кошек с внутричерепными менингиомами являются изменение уровня сознания, судороги и вестибулярные нарушения (Gordon et al., 1994; Troxel et al., 2003; Greco et al., 2006; Snyder et al., 2006; Tomek et al., 2006; Negrin et al., 2010). Вероятно, что эти клинические признаки связаны с нейроанатомической локализацией менингиом. Эпилептические припадки генерируются в коре больших полушарий и промежуточном мозге (Fisher et al., 2005); у собак и кошек эти области часто поражаются менингиомами (Troxel et al., 2003; Snyder et al., 2006; Sturges et al., 2008). Кроме того, компрессия и/или повреждение промежуточного мозга может привести к изменению уровня сознания из-за дисфункции нисходящей ретикулярной активирующей системы, сети нейронов, ответственной за поддержание бодрствующего состояния (De Lahunta and Glass, 2009). И, наконец, поражение промежуточного мозга может привести к вестибулярным симптомам, поскольку таламус действует как «ретрансляционная станция» для афферентной информации, поступающей от вестибулярной системы в кору (Dieterich et al., 2005).
Описаны редкие случаи других специфических неврологических нарушений, связанных с внутричерепными менингиомами, например наружная или внутренняя офтальмоплегия (Larocca, 2000; Webb et al., 2005; Holland et al., 2010; Seruca et al., 2010).
Анализ крови и спинномозговой жидкости
Клинических исследований по оценке гематологических, биохимических показателей крови или результатов анализа мочи у собак и кошек с менингиомами полости черепа не проводилось. У собак с менингиомой полости черепа наркоз может вызвать клинически значимую гиперлактатемию (Sullivan et al., 2009), однако степень практической значимости этих данных не установлена. К сожалению, анализ спинномозговой жидкости (СМЖ) не является чувствительным или специфичным методом диагностики менингиом собак и кошек (Troxel et al., 2003; Dickinson et al., 2006). Примерно в 30% случаев внутричерепных менингиом у собак и кошек обнаруживается альбумино-цитологическая диссоциация (Troxel et al., 2003; Snyder et al., 2006). У кошек возможен плейоцитоз от легкой до умеренной степени, преимущественно нейтрофильный, в сочетании с повышением общего белка (Bailey and Higgins, 1986; Dickinson et al., 2006), особенно при расположении опухоли в кудальной части черепной ямки (Dickinson et al., 2006). Однако нейтрофильный плейоцитоз характерен для многих других неврологических заболеваний (Di Terlizzi and Platt, 2009). Описано значительное повышение концентрации мочевой кислоты в СМЖ у собак с подтвержденной внутричерепной менингиомой (Platt et al., 2006a), однако клиническое значение этого неясно.
Визуальная диагностики
Так как внутричерепные менингиомы могут метастазировать в легкие (Dahme, 1957; Geib, 1966; Schulman et al., 1992; Pérez et al., 2005) или сочетаться с первичными опухолями легких (Snyder et al., 2006), рекомендуется рентген грудной клетки.
Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) считаются основными диагностическими методами прижизненного исследования новообразований мозга различных гистологических типов. Однако гистологическое исследование биоптатов остается наиболее надежным способом постановки окончательного диагноза. Современные методы визуальной диагностики также хорошо позволяют выявить точную анатомическую локализацию и взаимоотношение между внутричерепной опухолью и окружающими тканями. Эта информация важна и полезна, в частности, при планировании хирургической резекции, во время операции (Gallagher et al., 1995) и в послеоперационный период (Bergman et al., 2000; Forterre et al., 2007). Показано, что УЗИ может служить информативным диагностическим средством во время операции (Gallagher et al., 1995), помогая выявить глубоко расположенные поражения мозга, невидимые при краниотомии, и установить протяженность опухоли. У людей и собак диагностическая точность КТ при обнаружении менингиом полости черепа составляет примерно 80% (Polizopoulou et al., 2004; Assefa et al., 2006). Диагностическая точность КТ при менингиомах полости черепа у кошек неизвестна. У людей прогностическая правильность диагноза менингиомы по МРТ варьирует от 65 до 96% (McDermott and Wilson, 1996; De Monte et al., 2001; Engelhard, 2001). Чувствительность МРТ для правильной идентификации менингиом полости черепа собак варьирует от 66 до 100% (Thomas et al., 1996; Polizopoulou et al., 2004; Snyder et al., 2006; Ródenas et al., 2011), а у кошек оценивается как 96% (Troxel et al., 2004).
Несмотря на относительно высокую чувствительность МРТ для диагностики менингиом, данный метод обследования не позволяет предсказать подтип или степень злокачественности опухолей собак (Sturges et al., 2008). В противоположность этому, недавнее медицинское исследование показало, что кистозные изменения опухоли и признаки распространения за пределы полости черепа через отверстия в основании черепа, видимые при МРТ, могут быть показателями атипичной/злокачественной менингиомы (Hsu et al., 2010). Насколько нам известно, исследований по оценке изменений при МРТ, которые можно использовать для предсказания типа или степени злокачественности менингиомы у кошек, не проводилось. Одно ограниченное исследование показало, что КТ по диагностической чувствительности сходна с МРТ при постановке предположительного диагноза менингиомы у собак (Polizopoulou et al., 2004). У собак несколько патологических процессов, включая опухоли гипофиза (Pollard et al., 2010), лимфомы (Thomovsky et al., 2011), гистиоцитарные саркомы полости черепа (Tamura et al., 2009) и внутричерепные опухоли из зародышевых клеток (Motta et al., 2011) могут давать сходную с менингиомами картину МРТ. У кошек токсоплазмоз мозга (Falzone et al., 2008) и криптококкоз (Sykes et al., 2010) при МРТ могут выглядеть сходно с менингиомой.
После внутривенного введения контрастного вещества при менингиомах возможно усиление сигнала от твердой мозговой оболочки («дуральный хвост»). Это выглядит как линейное усиление утолщенной твердой мозговой оболочки, образующей единое целое с экстрааксиальным новообразованием; степень накопления контраста такая же или больше, чем в связанном новообразовании (Nagele et al., 1994; Graham et al., 1998). У людей при обнаружении «дурального хвоста» любое связанное новообразование вероятнее всего является менингиомой, однако данный специфический признак встречается также у пациентов с глиобластомой, аденомой гипофиза и шванномой слухового нерва (Rokni-Yazdi and Sotoudeh, 2006).Потеря сигнала в соседних участках свода черепа в результате реактивного гиперостоза – еще один признак, связанный с менингиомами у собак (Mercier et al., 2007), кошек (Troxel et al., 2004) и людей (Pieper et al., 1999). Гиперостоз, связанный с опухолью, представляет собой эрозию кости в результате атрофии от давления с последующим утолщением в результате прорастания опухолевых клеток в гаверсовы каналы (Adamo et al., 2004). Недавно был описан гиперостоз черепа в результате внутричерепной минингиомы с прорастанием в кости черепа у кошки (Gutierrez-Quintana et al., 2011). Особенности картины МРТ и КТ при менингиомах кратко представлены в Таблице 1 (Рис. 4 и 5). Для более точной диагностики менингиомы у животных можно применять новые методы визуальной диагностики (Таблица 2).
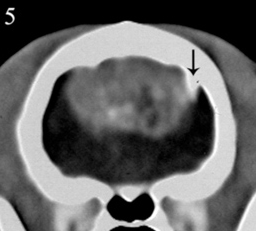
Рис. 5. Та же кошка, что и на рис. 4. К лобной кости прилегает крупное, четко очерченное опухолевидное образование с однородным выраженным усилением контраста. Обратите внимание на сильное смещение серпа мозга (черная стрелка). Внутри опухоли видны множественные мелкие очаги пониженной и повышенной плотности, соответствующие некрозу и острому кровоизлиянию, соответственно (это было подтверждено гистологическим анализом).
Патологическая картина
Большинство менингиом представляет собой четко отграниченные, иногда дольчатые, плотные зернистые образования, прикрепленные к вышележащим мозговым оболочкам с помощью широкого основания или ножки (Summer et al., 1995). У собак в некоторых случаях менингиома имеет крупную кистозную полость, образовавшуюся в результате ишемических явлений или агрегации сильно вакуолизированных опухолевых клеток (Pinna et al., 1986; Salvadori et al., 2010).
Цитологическое исследование материала, полученного во время операции по уменьшению объема опухоли либо с помощью стереотактических техник, может помочь при диагностике менингиомы (Zimmerman et al., 2000; Long et al., 2002; Platt et al., 2002; Sharkey et al., 2004; De Lorenzi et al., 2006; Harms et al., 2009; Wills et al., 2009); оно может выявить извитые структуры из эпителиоподобных или веретеновидных клеток, расположенных в виде «плетеных» пучков. Главными преимуществами этой техники постановки диагноза во время операции являются скорость, простота приготовления препарата, техническая простота и минимальная необходимость в техническом оборудовании, и высокая степень цитологического разрешения.
Эта система имеет следующие ограничения:
Гистологическое исследование биоптатов по-прежнему остается лучшим способом постановки окончательного диагноза. При гистологическом исследовании для менингиомы характерны:
Нередко менингиомы представляют собой смесь менинготелиальной и фибробластной ткани (переходная менингиома), либо имеют спиралевидно закрученную форму с гиалинизацией, некрозом и обызвествлением в центре (псаммоматозный тип) (Koestner and Higgins, 2002) (Рис. 6).
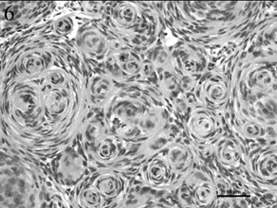
В отдельных случаях бывает сложно отличить менингиомы от других новообразований, например: астроцитом, олигодендроглиом, метастатического рака, опухолей из зародышевых клеток и опухолей влагалищ периферических нервов. В таких случаях для определения свойств менингиом собак и кошек предлагается базовый набор иммуногистохимических реактивов, включающий виментин, CD34 и E-кадгерин (Ramos-Vara et al., 2010).
| Собаки | Кошки | Источники |
| Границы на МРТ- и КТ-снимках | Четко выраженные, равномерные |
Реже – нечеткие
Hathcock et al. (1996), Thomas et al. (1996), Kraft et al. (1997, 1999), Snyder et al. (2006), and Sturges et al. (2008)
Snyder et al. (2006) and Rodenas et al. (2011)
Редко – изоинтенсивные, гипоинтенсивные или смешанный сигнал
Hathcock et al. (1996), Thomas et al. (1996), Kraft et al. (1999), and Sturges et al. (2008)
Hathcock et al. (1996), Thomas et al. (1996), Sturges et al.
(2008), Rodenas et al. (2011), and Martin Vaquero et al. (2010)
Кольцевое усиление встречается редко
Реже – неоднородное. Кольцевое усиление встречается редк
Kraft et al. (1997, 1999), Sturges et al. (2008), Snyder et al. (2006), and Rodenas et al. (2011)
Hathcock et al. (1996), Thomas et al. (1996), Snyder et al. (2006), and Sturges et al. (2008)
Kraft et al. (1997, 1999), Snyder et al. (2006), Rodenas et al. (2011)
Hathcock et al. (1996), Kraft et al. (1997, 1999), Sturges et al. (2008), Rodenas et al. (2011)
Mercier et al. (2007)
Troxel et al. (2004)
Troxel et al. (2004)
Все значения интенсивности при МРТ относятся к серому веществу.
Все значения плотности при КТ относятся к оставшейся части паренхимы мозга.
a Процентные значения есть только для МРТ.
| Техника визуальной диагностики | Описание | Применимость |
| Перфузионная КТ мозга | Дает информацию об объеме крови в мозге и средней длительности ее прохождения (соотношение между объемом крови в мозге и скоростью тока крови) при менингиомах у собак | Может быть полезна для диагностики и оценки степени злокачественности менингиом (Kishimoto et al., 2008) |
| Методы переноса намагниченности | Помогает обнаружению и определению свойств аномалий белого вещества | Позволяет значительно повысить контраст тканей и улучшить чувствительность обнаружения и определения характеристик при заболеваниях мозга (Vite and Cross, 2011) |
| Диффузионно-взвешенные изображения | Позволяет обнаружить цитотоксический отек | Ограниченное применение для прогноза гистологического типа внутричерепных опухолей у собак; например, низкие кажущиеся коэффициенты диффузии указывают на острый негеморрагический инфаркт, но также наблюдаются при менингиомах, опухолях из глиальных клеток и гранулематозном менингоэнцефалите (Sutherland-Smith et al., 2011) |
| Магнитно-резонансная спектроскопия | Оценивает биохимию мозга путем количественной оценки концентрации определенных метаболитов из спектров распределения метаболитов | Позволяет точнее оценить гибель нейронов, глиоз и скорость обновления мембран опухолевых клеток (Vite and Cross, 2011) |
| Динамическая МРТ с усилением контраста | Оценивает кинетические параметры усиления контраста между разными патологическими процессами в мозге | Возможна объективная оценка усиления контраста, которая может помочь дифференцировать опухоли мозга (Zhao et al., 2010) |
Классификация
Согласно действующей гистологической классификации ВОЗ (Koestner et al., 1999) менингиомы домашних животных можно отнести к двум основным группам:
Позднее у собак были идентифицированы другие подтипы, сходные с известными подтипами менингиомы у людей (микрокистозные, хордоидные, липоматозные и секреторные) (Louis et al., 2007). Однако система классификации степеней злокачественности не применяется к менингиомам домашних животных. Вместе с тем, в 2007 г ВОЗ создала более подробную систему классификации опухолей у людей (Louis et al., 2007) со стойкой корреляцией между гистологической картиной, биологическим поведением и прогнозом исхода (Таблица 4).
| Тип опухоли | Гистологическая классификация |
| Доброкачественная менингиома | Менинготелиоматоз Фиброзные (фибробластные) Переходные (смешанные) Псаммоматозные Ангиоматозные (ангиобластные) Папиллярные Зернистоклеточные Миксоидные |
| Злокачественная менингиома | Анапластическая (злокачественная), т. е. с высокой скоростью митозов, гиперклеточностью с непрерывным ростом без определенной картины, обширным некрозом, прорастанием в нервную ткань и метастазами. |
В связи с тем что в классификации опухолей домашних животных выявляется все больше ограничений, в последние годы был предпринят ряд попыток разработки улучшенной классификации на основании поразительного сходства патологических, иммунологических, молекулярных свойств и картины на МРТ при менингиомах у людей и собак. В литературе встречаются публикации, указывающие на преимущества медицинской системы классификации по сравнению с текущей схемой ВОЗ для животных (Sturges et al., 2008; Mandara et al., 2009, 2010). Эти исследования подтвердили, что распространенность атипичной менингиомы у собак (степени II) гораздо выше, чем у людей (Burger et al., 2002) (>40% и 8%), в то время как доброкачественные менингиомы у собак встречаются реже (от прибл. 40% до 57% в сравнении с 80%).
Кроме того, сообщалось, что митотический индекс ≥ митозов на 10 полей зрения при большом увеличении и прорастание опухоли в мозг могут быть достаточными критериями для отнесения менингиомы к II степени (Mandara et al., 2010), как уже предложено для людей (Louis et al., 2007). Кроме того, предлагалось, что видимые беспорядочные пласты сами по себе можно считать критерием II степени злокачественности менингиом у собак (Mandara et al., 2010). Интересно отметить, что у кошек менингиомы III степени злокачественности не описаны, что подтверждает менее агрессивное поведение менингиомы у кошек и позволяет предположить, что существующие системы классификации неприменимы к менингиомам кошек (Mandara et al., 2010).
Преимущества применения человеческой системы к животным заключаются в более подробном списке гистологических подтипов и в том, что в этой системе используется набор морфологических критериев для гистологической классификации. Это уменьшает субъективность при интерпретации степени злокачественности опухоли и может служить для подтверждения долговременного прогноза на основании клинических данных.
Биологическое поведение
В настоящее время существует проблема определения биологического потенциала менингиомы, что подчеркивает различия между цитологической и биологической злокачественностью. Однако что означает биологическая злокачественность применительно к менингиомам?
Метастазы менингиом домашних животных встречаются очень редко и, по-видимому, представляют собой спорадическое явление. У собак описаны редкие случаи метастазов внутричерепных менингиом в легкие и/или сердце (Geib, 1966; Schulman et al., 1992; Dugan et al., 1993; Pérez et al., 2005). Описаны метастазы менингиомы, подтвержденной гистологически, в почках и матке кошки (Dahme, 1957).
У людей менингиомы метастазируют менее чем в 1% случаев, но при злокачественных менингиомах эта частота достигает 43% случаев (Enam et al., 2005). Хотя вероятность менингиом у женщин в 2 – 4 раза выше, у мужчин метастазы образуются чаще, чем у женщин (соотношение 3:2) (Som et al., 1987). В 0,1% случаев описаны метастазы в присутствии менингиомы, классифицированной как доброкачественная при гистологическом исследовании (Fulkerson et al., 2008).
Чтобы объяснить такую низкую распространенность метастазов при менингиоме, выдвигались разные гипотезы. Менингиомы характеризуются выраженными переплетениями и соединениями десмосом соседних клеток; это должно снизить вероятность слущивания опухолевых клеток (Kepes, 1986). Кроме того, поскольку большинство менингиом доброкачественны по гистологическим признакам, незначительное количество клеток, которое может попасть в кровоток, не обладает способностью к колонизации и формированию отдаленных метастазов (Kepes, 1986). Однако показано, что скорость митоза в легочных метастазах выше, чем в первичной опухоли, это позволяет предположить присутствие клона с более агрессивным поведением, способного развиваться в отдаленных органах (Schulman et al., 1992). В отсутствие обнаружимых метастазов при оценке биологической злокачественности менингиомы следует учитывать отек вокруг опухоли и рецидивы.
Новые возможные стратегии лечения
По причине высокой распространенности и большого числа экспрессируемых морфо- и иммунофенотипов (Bernhart et al., 2002; Louis et al., 2007) менингиома представляет собой очень интересное новообразование, активно изучавшееся как в медицине, так и в ветеринарии. Общей целью текущих исследований является определение взаимоотношений между биологическим поведением менингиом, современными методами терапии и прогнозом.
Сейчас современные методы визуальной диагностики значительно облегчают выявление первичных (отек ткани опухоли или кистозные области) и вторичных эффектов (отек вокруг опухоли и инфильтрация, сдавливание и смещение средней линии, грыжа и метастазы) менингиомы до операции или перед гистологическим исследованием. Однако этих достижений все еще недостаточно для определения биологической злокачественности менингиом. Недавно был изучен ряд биологических маркеров менингиом животных в строгой связи со скоростью роста, митотической активностью, инфильтрацией, отеком тканей вокруг опухоли и васкуляризацией опухоли. До настоящего времени пролиферативная активность менингиом, оцененная иммуногистохимически с помощью антител MIB-1 к антигену Кi-67, коррелировала с гистологической степенью злокачественности клеток опухоли мозговых оболочек как у людей, так и у домашних плотоядных (Mandara et al., 2002; Devaprasath and Chack, 2003; Maes et al., 2005). В то же время у людей экспрессия Ki-67 была выше в рецидивирующих доброкачественных внутричерепных менингиомах, чем в опухолях пациентов без рецидива (Lanzafame et al., 2000; Takahashi et al., 2004). В противоположность этому, корреляции между экспрессией Ki-67 и выживанием у собак не обнаружено (Matiasek et al., 2009).
Ядерный антиген пролиферирующих клеток (PCNA) считается еще одним информативным показателем пролиферативного индекса менингиом у собак и кошек (Mandara et al., 2009) и может применяться для прогнозирования исхода при данном типе опухолей у собак (Theon et al., 2000). Однако при сравнении с Ki-67 возможны некоторые потенциальные проблемы, присущие технике мечения PCNA, включая концентрацию иммунореактивности в S-фазу клеточного цикла и/или длительное время полужизни молекулы PCNA (Matiasek et al., 2009).
Интересно отметить, что на протяжении длительного времени обнаружение рецепторов стероидов в клетках опухоли мозговых оболочек было основанием полагать, что опухолевый рост отражает гормональную стимуляцию. Первое доказательство гормонозависимого роста менингиом у людей было получено Cushing and Eisenhardt в 1938 г на основании наблюдения высокой предрасположенности к рецидиву менингиом у беременных. Несмотря на расхождение между разными методами и результатами, в настоящее время полагают, что большинство менингиом у людей имеет рецепторы прогестерона (РП) в отсутствии рецепторов эстрогена (РЭ) (Hsu et al., 1997). Кроме того, по-видимому, вероятность экспрессии РП более агрессивными и атипичными менингиомами у людей ниже (Theon et al., 2000; Mandara et al., 2002).
Согласно общепринятому мнению в ветеринарии, большинство менингиом собак и кошек обладает РП (Theon et al., 2000; Mandara et al., 2002; Adamo et al., 2003), но не РЭ. Кроме того, показано, что у собак, кошек и людей высокий пролиферативный индекс менингиом связан с низкой концентрацией РП; это дает основания полагать, что концентрация РП может быть достоверным прогностическим показателем (Mandara et al., 2002; Shayanfar et al., 2010). Считается, что отсутствие РП в опухолях с повышенным пролиферативным индексом косвенно влияет на прогноз после лучевой терапии (Theon et al., 2000). Эти исследования дают больше информации о биологическом поведении менингиом, особенно тех, которые не удается точно классифицировать гистологически. Кроме того, обнаружение РП в большинстве менингиом подтверждает возможность применения антипрогестиновых препаратов, которые могут дать благоприятный эффект при неоперабельных или рецидивирующих опухолях (Serfaty, 1995).
Позднее был исследован ряд дополнительных биологических маркеров менингиом собак, экспрессию которых сравнивали с таковой у людей. В частности, и в медицинской, и в ветеринарной онкологии предметом значительного интереса стало изучение активности теломеразы (TL) и металлопротеиназы (MMP), участвующих в образовании опухолей, их прорастании в ткани и метастазировании, соответственно.
Показано, что активность теломеразы высока в злокачественных менингиомах человека, однако низка или отсутствует в доброкачественных опухолях (Maes et al., 2007). Кроме того, по-видимому, экспрессия теломеразы сильнее в рецидивирующих опухолях, чем в нерецидивирующих доброкачественных (Maes et al., 2007).
Активность теломеразы показана также в менингиомах собак и кошек, однако информация о взаимоотношении между ее экспрессией и пролиферативным индексом опухоли до сих пор остается противоречивой (Long et al., 2006; Mandrioli et al., 2007). Поскольку теломераза экспрессируется при большинстве опухолевых процессов и не обнаруживается в большинстве нормальных тканей, этот фермент можно считать хорошей мишенью для терапии. В настоящее время разрабатывается несколько методов потенциальной противораковой терапии, в частности направленные на ингибирование теломеразы, действующие на промотор теломеразы, и иммунотерапия, направленная на теломеразу; возможно, они будут эффективны для людей и животных с раковыми заболеваниями (Nasir, 2008).
Данные литературы о степени экспрессии ММР менингиомами человека разной степени злокачественности противоречивы. Фактически, хотя некоторые исследования показали прогрессивное повышение экспрессии ММР-2 от степени I до степени II/III по классификации ВОЗ, MMP-9 усиленно экспрессируется в опухолях I и II степени, однако по мере прогресса со II до III степени экспрессия значительно снижается (von Randow et al., 2006). И наоборот, в других исследованиях реальная тенденция к повышению с увеличением степени злокачественности опухоли показана только для ММР-9 (Panagopoulos et al., 2008). В настоящее время данные о менингиомах собак и кошек подтверждают точку зрения об отсутствии корреляции экспрессии ММР с морфологическими критериями злокачественности, в противоположность данным медицинской онкологии (Okada et al., 2004). В менингиомах людей, собак и кошек экспрессия MMP, по-видимому, не зависит от пролиферативного потенциала (Okada et al., 2004; Mandara et al., 2009). Кроме того, попытки обнаружить какую-либо значимую корреляцию между экспрессией ММР, теломеразы и РП в менингиомах собак и кошек оказались безуспешными, что, вероятно, указывает на разные и независимые пути активации (Mandara et al., 2009). Независимо от корреляции между ММР и экспрессией других биологических маркеров, в настоящее время полагают, что у людей повышенное соотношение между ММР и тканевыми ингибиторами ММР играет большую роль в прогрессе злокачественности опухолей и что тканевые ингибиторы ММР в будущем могут стать дополнительным инструментом для новых стратегий лечения менингиомы (Kachra et al., 1999).
Доказательства участия молекул адгезии в прогрессе менингиом собак и кошек недостаточны (Ramos-Vara et al., 2010). Фактически, молекулы адгезии исследовались в качестве иммуногистохимических маркеров, а не фактических биологических маркеров (Ramos-Vara et al., 2010). С другой стороны, анапластические менингиомы у людей, по-видимому, не экспрессируют Е-кадерин (Panagopoulos et al., 2008). Гипотеза о том, что онкогенез при менингиоме может частично провоцироваться избыточной экспрессией циклооксигеназы-2 (СОХ-2), подробно описана и подтверждается медицинскими доказательствами (Buccoliero et al., 2007). Эти результаты поощряют использование новых многообещающих методов терапии селективными ингибиторами СОХ-2, такими как целекоксиб (Пфайзер). Кроме того, целекоксиб хорошо переносится людьми, поэтому он представляется очень привлекательным препаратом для долговременной терапии менингиом (Ragel et al., 2007). На данный момент показана избыточная экспрессия СОХ-2 в различных злокачественных новообразованиях собак, однако значимая связь со степенью злокачественности менингиом собак отсутствует (Rossmeisl et al., 2009). Исследований по оценке экспрессии СОХ-2 при менингиомах у кошек не проводилось.
Наиболее серьезными вторичными эффектами менингиом, которые следует учитывать, является отек тканей вокруг опухоли и инфильтрация соседних тканей. Чтобы лучше понять потенциал злокачественности менингиом и взаимоотношение с вторичными эффектами, были исследованы ММР и сосудистый эндотелиальный фактор роста (СЭФР) у людей и собак. У людей была выявлена связь ММР2 и ММР9 с отеком тканей вокруг опухоли (Panagopoulos et al., 2008), а также с рецидивом и инфильтрацией (Mizoue et al., 1999; Okada et al., 2004). Данных о менингиомах собак и кошек недостаточно.
Больше внимания уделялось способности СЭФР вызывать отек тканей вокруг опухоли и уменьшать время выживания собак с менингиомой. До настоящего времени не показано значимой корреляции между экспрессией СЭФР и отеком тканей вокруг опухоли или гистологической классификацией менингиом собак и кошек (Dickinson et al., 2008). В некоторых случаях избыточная экспрессия СЭФР коррелировала с меньшим временем выживания у собак (Platt et al., 2006b), позволяя предположить, что ангиогенез может быть более важным прогностическим показателем при менингиомах у собак, чем Ki-67.
Несмотря на доказательства связи усиленной васкуляризации с высоким пролиферативным индексом менингиом у людей, в менингиомах полости черепа собак не было выявлено связи между СЭФР и экспрессией Ki-67 (Matiasek et al., 2009). У людей избыточная экспрессия СЭФР в настоящее время считается маркером рецидива после хирургического лечения и злокачественного потенциала менингиом (Yamasaki et al., 2000). Хотя в менингиомах не обнаружено очевидного «ангиогенного выключателя» с участием СЭФР, как в глиомах, это дает основания полагать, что СЭФР может стать потенциальной мишенью для антиангиогенной терапии менингиом всех степеней злокачественности по классификации ВОЗ (Lamszus et al., 2000).
Исследований экспрессии СЭФР в менингиомах кошек не проводилось.
Медикаментозное лечение
В целом, традиционное лечение опухолей мозга, как у людей, так и у животных, заключается в комбинации хирургического уменьшения объема опухоли, химиотерапии и лучевой терапии (Таблицы 5 и 6). Хирургическое вмешательство и/или лучевая терапия у собак и кошек не всегда осуществимы из-за сочетания ряда факторов, например, глубокое расположение опухоли, возраст пациента, финансовые ограничения и этические причины, однако медикаментозное лечение позволяет облегчить клинические признаки при новообразованиях мозга, обеспечить собакам и кошкам хорошее качество жизни и продлить время выживания. Наиболее распространенные стратегии медикаментозного лечения включают сочетание кортикостероидных, противоэпилептических и/или разных химиотерапевтических препаратов. Эффективность кортикостероидов для уменьшения вазогенного отека, связанного с опухолями, подробно описана (Papadopoulos et al., 2004; Barnes, 2005). Кортикостероиды диффундируют через плазматическую мембрану и связываются с цитоплазматическим рецептором, позволяя комплексу стероид-рецептор перемещаться к ядру, где он влияет на транскрипцию генов, а также взаимодействует с другими факторами транскрипции (Barnes, 2005). Кроме того, коротикостероиды уменьшают проницаемость эндотелия, вызывая дефосфорилирование белков плотных контактов окклюдина и ZO1 (Papadopoulos et al., 2004).
Исследований по оценке противоэпилептических препаратов для лечения собак и кошек с новообразованиями мозга не проводилось.
Основной целью применения противоэпилептических препаратов для животных с судорогами, вызванными опухолью, является снижение частоты и тяжести судорожных припадков.
Наибольшей проблемой применения противоэпилептических препаратов для пациентов с опухолями мозга в медицине является взаимодействие метаболизма противосудорожных препаратов и кортикостероидов посредством системы цитохрома Р450 (противосудорожные препараты, индуцирующие ферменты) со многими распространенными противоопухолевыми препаратами (Dropcho and Soong, 1991). У людей профилактическое применение противосудорожных препаратов неэффективно и не должно применяться планово (Sirven et al., 2004).
| Без лечения | Кортико-стероиды и противо-судорожные | Химиотерапия | Только хирур-гическое | Только лучевая терапияa | Хирур-гическое плюс лучевая терапия | Эндо-скопическое уменьшение объема опухоли | Хирург-ическое уменьшение объема опухоли | |
| Собаки | 2,5, n =13 (Foster et al, 1988) | 2, n = 8 (Turrel et al, 1984) | Стероиды и гидрокси-мочевина – 14, n = 1 (Tamura et al, 2007) | 4,5 (медиана), n =4 (Kostolich and Dulisch, 1987); 6 (медиана), n = 10 (Niebauer et al,, 1991); 7 (медиана), n = 14 (Axlund et al,, 2002); 27 (медиана), n =11 (Gallagher e al,, 1993) 22 (медиана), n =34 (Troxel et al,, 2003) | 8 (медиана), n =22 (Spugnini et al,, 2000); 12,2 (медиана), n =35 (Brearley et al,, 1999) | 15,7 (медиана), n =6 (Brearley et al, 1999) | Менингиомы переднего мозга: 70,13 (медиана), n =21(Klopp and Rao, 2009); менингиомы каудальных отделов мозга: 23,4 (медиана), n =6 (Klopp and Rao, 2009) | 41,8(медиана) n =17 (Greco et al., 2006) |
| Стероид и ломустин – 13, n =1 (Jung et al,, 2006a,b) | 30 (медиана), n =20 (Theon et al,, 2000) | |||||||
| Нитро-силкобаламин– полная ремиссия ранее частично иссеченной менингиомы спинного мозга, n =1 (Bauer et al,, 2010) | 16,5 (медиана), n =12 (Axlund et al, 2002) | |||||||
| Кошки | Неизвестно | Неизвестно | Гидрокси-мочевина – получены доказательства In vitro, что гидрокси-мочевина замедляет или останавливает деление клеток менингиомы у кошек (Forterre et al, 2000) | Неизвестно | Неизвестно | Неизвестно | Неизвестно |
aЛучевая терапия проводилась собакам с экстрааксиальными новообразованиями мозга без гистологического подтверждения принадлежности к менингиомам.
| Химиотерапевтический препарат | Характеристики | Нежелательные эффекты |
| Гидроксимочевина | Антиметаболит, специфически воздействующий на S-стадию клеточного цикла. Этот препарат подавляет рост опухолей с низким митотическим индексом, таких как менингиомы (Hoshino et al., 1986) | У собак часто встречается токсические явления, но обычно не угрожающие жизни (Tamura et al., 2007) У кошек нежелательные явления не отмечались (Forterre et al., 2006, 2007) |
| Ломустин (1-[2-хлорэтил]-3-циклогексил-1-нитрозомочевина | Алкилирующий противоопухолевый препарат из группы нитрозомочевины | У собак часто встречается токсические явления, но обычно не угрожающие жизни (Jung et al., 2006a,b) У кошек исследований не проводилось |
| Нитросилкобаламин | Аналог витамина В12, включающий оксид азота в качестве осевого лиганда, действие которого основано на опосредованном рецептором захвате кобаламина и направленном апоптозе раковых клеток под действием нитросилкобламина (Bauer et al., 2002) | У собак нежелательных явлений не отмечено (Bauer et al., 2002) У кошек исследований не проводилось |
Хирургическое лечение, лучевая терапия и химиотерапия
У людей большинство менингиом лечат хирургическим методом, а при рецидивах назначают лучевую терапию и/или повторную хирургическую резекцию (Ropper and Brown, 2005).
Для удаления менингиом у собак и кошек успешно применялись разные хирургические техники (Parker and Cunningham, 1972; DeWet et al., 1982; Kostolich et al., 1987; Glass et al., 2000; Forterre et al., 2006, 2009; Barreau et al., 2010; Michal Altay et al., 2010).
Недавно был успешно применен у кошки надскуловой височно-базальный доступ для полного иссечения менингиомы в основании черепа с распространением в ростральную височную область (Forterre et al., 2009). Менингиомы в медиальной части мозжечкового намета у кошек можно полностью или частично иссечь через односторонний височный надмозжечковый транстенториальный доступ (Forterre et al., 2006).
Недавно было описано успешное применение техники хирургического доступа в виде «дверцы люка» для полного удаления ростротенториальной менингиомы с прикреплением к твердой мозговой оболочке и кости (Michal Altay et al., 2010).
У собак описаны модифицированные доступы к обонятельной луковице и лобным долям для резекции менингиомы (Parker and Cunningham, 1972; DeWet et al., 1982; Kostolich et al., 1987; Glass et al., 2000). Показано, что модифицированная техника двухсторонней краниотомии через лобную пазуху превосходно подошла для доступа к обонятельным луковицам и лобным долям трех собак с целью резекции и биопсии менингиом (Glass et al., 2000). По опубликованным данным, послеоперационные осложнения у собак, например: внутрижелудочковая напряженная пневмоцефалия и скопление воздуха в субарахноидальном пространстве шейного отдела, встречаются лишь спорадически (Garosi et al., 2002; Cavanaugh et al., 2008).
К послеоперационным осложнениям хирургического удаления менингиом у кошек относятся центральная слепота (Forterre et al., 2006), анемия (Gordon et al., 1994) и острая почечная недостаточность (Gallagher et al., 1993). Послеоперационная смертность кошек, перенесших операцию по уменьшению объема опухоли, варьирует от 19% (Gordon et al., 1994) до 17% (Gallagher et al., 1993).
Сообщалось, что лучевая терапия сама по себе эффективна для лечения собак с предположительным диагнозом менингиомы (Brearley et al., 1999; Spugnini et al., 2000). Это действенная процедура при неоперабельных опухолях, которая может быть предпочтительнее хирургической резекции при инфильтрирующем росте новообразования. При этом часто возникают легкие явления острого облучения нормальных тканей (например, сухой кератоконъюнктивит, наружный отит, мукозит ротоглотки и конъюнктивит), которые, по-видимому, не влияют на исход (Spugnini et al., 2000). Тем не менее, возможны отсроченные эффекты облучения, способные стать причиной смерти или эутаназии (Brearley et al., 1999). Кроме того, в исследовании Spugnini et al. (2000) сообщается, что около 76% собак, перенесших лучевую терапию для лечения внутричерепных новообразований, умерли, либо у них развилась рецидивирующая прогрессирующая невропатия, свидетельствующая о повторном росте или прогрессе опухоли. Исход у собак после сочетания хирургического лечения и лучевой терапии значительно лучше, чем только после хирургического лечения (Таблица 5).
Обычным методом выбора для кошек является хирургическая резекция менингиомы, так как эти опухоли у данного вида животных хорошо инкапсулированы и легко отделяются от нормальной ткани мозга (Рис. 7). Возраст, локализация внутричерепной менингиомы и наличие множественных менингиом значительно не влияли на выживание и исход у кошек после операции по уменьшению объема опухоли (Gordon et al., 1994). Ретроспективный анализ 34 кошек, перенесших хирургическое удаление внутричерепных менингиом, показал общую выживаемость 71% через 6 месяцев, 66% через год и 50% через 2 года (Gordon et al., 1994). В прочих исследованиях медиана времени выживания после резекции опухоли составила 22 и 27 месяцев (Gallagher et al., 1993; Troxel et al., 2003), по сравнению с 8 днями у кошек, которых лечили медикаментозно (Gordon et al., 1994). Хирургическая резекция с последующим лечением гидроксимочевиной позволяет добиться длительной ремиссии клинических признаков, связанных с одиночными или множественными менингиомами у кошек (Forterre et al., 2006, 2007; Tomek et al., 2008) (Таблица 5).
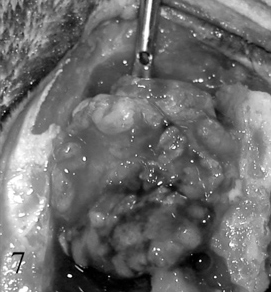
Сообщалось, что у кошек рецидив менингомы после хирургической резекции происходит примерно в 20% случаев (Gallagher et al., 1993; Gordon et al., 1994; Troxel et al., 2003), а крупное исследование показало, что медиана времени развития рецидива составляет 9,5 месяцев после операции (Troxel et al., 2003). Насколько нам известно, исследований по оценке частоты рецидивов после хирургической резекции менингиом у собак не проводилось. Кроме того, данные о наиболее эффективных терапевтических подходах при рецидиве менингиомы у собак и кошек отсутствуют.
Выводы и направление будущих исследований
Применимость современных медицинских клинических прогностических показателей к мелким животным ограничена из-за недостаточной корреляции биологического поведения опухолей у собак и кошек и действующей классификации ВОЗ. Недавно опубликованная информация о морфологических и биологических свойствах менингиом у домашних животных указывает на необходимость создания более совершенной классификации и оценки степени злокачественности, связанной с биологическим поведением, чтобы успешно использовать прогностические и современные терапевтические методики в ветеринарной онкологии. Кроме того, знание молекулярных механизмов, ответственных за прогресс неопластических процессов, является основой для разработки будущих стратегий лечения. Клинико-патологическое и иммунофенотипическое сходство между менингиомами собак и людей подтверждает необходимость в новых сравнительных исследованиях менингиом собак в качестве возможной экспериментальной модели этого новообразования у человека (Thomas et al., 2009).
Хотя окончательный диагноз менингомы требует гистологического анализа опухолевой ткани, необходимы дальнейшие исследования, основанные на корреляции между данными современной визуальной диагностики и гистологии, чтобы выяснить объективные параметры, которые можно использовать для:
Показано, что достижения в хирургической технике увеличивают время выживания собак и кошек с внутричерепными менингиомами, а для получения полезной и стандартизированной информации о наиболее подходящих хирургических техниках лечения этих первичных опухолей, а также практической ценности послеоперационной химиотерапии/ лучевой терапии, необходимы дальнейшие исследования на большой популяции собак и кошек.
Для выявления различий между морфологической и биологической злокачественностью и повышения прогностической ценности новой системы оценки менингиом домашних животных необходимы более полные и тщательно собранные данные последующего наблюдения. Этому будет способствовать тесное сотрудничество между клиницистами и патологами, а также получение как можно большего числа образцов опухолевой ткани от живых животных, в идеале с помощью малоинвазивных техник (Greco et al., 2006; Klopp and Rao, 2009; Klopp and Ridgway, 2009).
Заявление о конфликте интересов
Ни один из авторов этой статьи не состоит в финансовых или личных взаимоотношениях с другими людьми или организациями, которые могли бы повлиять на достоверность информации или содержание данной работы.