Макрофаги в молочной железе что это такое
Иммунные клетки помогают перестраиваться молочной железе
Когда молочной железе становятся ненужными некоторые протоки, образовавшиеся в период вскармливания, их съедают местные иммунные клетки.
Когда приходит время кормить молоком детёныша, молочные железы меняются – в них разрастаются молочные протоки, собирающие молоко от скоплений железистых клеток. Когда период вскармливания заканчивается, молочная железа снова меняется: разветвлённые многочисленные протоки исчезают, их клетки отмирают. Естественно, всё это подчиняется гормональным сигналам, однако в самой железе должны быть механизмы, обеспечивающие такие перестройки в структуре.
Исследователи из Медицинского института Уолтера и Элизы Холл вместе с коллегами из Мельбурнского университета сообщают в Nature Cell Biology, что им удалось обнаружить клетки, которые помогают избавиться молочной железе от лишних протоков. Это макрофаги – иммунные клетки, которые есть во многих органах и тканях; они активно ползают между другими клетками, образующими орган, и в буквальном смысле поедают всё подозрительное и ненужное: бактерий, вирусы, молекулярные обломки, оставшиеся от погибших клеток, и т. д. Макрофаги, обслуживающие конкретный орган, называют резидентными макрофагами – если не случается ничего чрезвычайного, они свой орган не покидают.
Авторы работы утверждают, что те макрофаги, которые обнаружились в молочной железе – это новая их разновидность, до сих пор никому не известная. Звездообразные макрофаги сидят в молочных протоках, они малоподвижны, стиснуты между двумя слоями клеток, и образуют что-то вроде сети. Когда клетки протоков начинают отмирать за ненадобностью, макрофаги протягивают к ним свои «руки»-отростки и поедают их. То есть новые макрофаги помогают молочной железе вернуться в некормящее состояние. Никакие другие иммунные клетки эту работу делать не могут: когда местные макрофаги удаляли из протоков молочной железы, ненужные клетки оставались несъеденными.
Притом макрофаги должны понимать, когда молочные протоки нужно уничтожать и когда не нужно. Рак молочной железы, одна из самых распространённых злокачественных опухолей, начинается с клеток протоков молочной железы, и, по словам исследователей, число макрофагов увеличивается по мере роста опухоли. Иммунитет должен уничтожать раковые клетки, но, возможно, макрофаги мешают другим иммунным клеткам делать своё дело, потому что полагают, что сейчас просто настало время молочной железе разрастаться.
Возможно, опухоли груди будет легче лечить, если найти способ если как-то подействовать на эти грудные макрофаги, сделать так, чтобы они мешали другим иммунным клеткам атаковать раковые клетки, а ещё лучше – чтобы они сами начали их уничтожать.
Макрофаги в молочной и щитовидной железе
Осмотр и пальпация (ощупывание) щитовидной железы 
В молочной и щитовидной железе при этом можно определить уплотнения и другие изменения, которые могут быть признаком растущей опухоли. Однако не всегда узел в тканях говорит о раке. Также это может быть киста, доброкачественное новообразование и т.д. Чтобы сделать предположение о диагнозе и запланировать лечение, делают биопсию желез – добывают кусочек ткани и под микроскопом изучают его клеточный состав. Если речь идет о молочной железе, то женщинам также могут провести исследование выделений из соска. В зависимости от результатов микроскопии устанавливают, что у человека за болезнь и как ее лечить. Наличие определенных клеток во взятой пробе указывает на наличие конкретного заболевания.
В этом посте мы не будем детально описывать разные картины биоптата щитовидной и молочных желез, разберем лишь частный вопрос: присутствие в этих органах клеток-макрофагов.
Макрофаги в молочной железе:

Совершенно правильная логическая цепочка. Если в ткани молочной железы и выделениях из соска много фагоцитов, это говорит о патологии. Так, когда в препарате присутствуют нейтрофилы, макрофаги и гистиоциты (это разновидность макрофагов, находящаяся в норме в соединительной ткани), то это прямо указывает на наличие воспалительного процесса.
Перед лаборантом, изучающим добытый от пациента образец, стоит задача не только обнаружить, но и изучить строение найденных макрофагов. В них всегда немало всякого «мусора», который представляет собой остатки и фрагменты перевариваемых или уже переваренных ими агрессоров. Если удается распознать, что именно находится внутри макрофагов, это помогает понять, против чего боролись эти фагоциты, а значит, сделать вывод, что за болезнь у пациента.
Так, иногда встречаются макрофаги в молочной железе с включениями «обломков» эритроцитов и гемосидерина (гемосидерин – один из конечных продуктов разрушения гемоглобина). Если макрофаги с гемосидерином находят в препарате, это говорит о присутствии в железе полости, внутри которой находится кровь. Последнее встречается при посттравматических изменениях, при некоторых формах мастопатии.
Макрофаги в щитовидной железе:
Макрофаги и нейтрофилы в щитовидной железе также в большом количестве обнаруживаются при заболеваниях. Довольно распространена такая патология этого органа как киста. Сделав пункцию (прокол) кисты, специалисты получают жидкость. В ней мало клеток, среди них преобладают макрофаги с гемосидерином – их еще называют сидерофагами.
Также макрофаги в щитовидной железе могут встречаться при других заболеваниях, например, при воспалительном процессе. Однако при аутоиммунном тиреоидите, который является основным воспалительным заболеванием этого органа, таких фагоцитов в биоптате немного – в железе преобладают лимфоциты, а другие иммунные клетки встречаются реже.
Итак, присутствие большого количества макрофагов в описанных 
Кстати, когда речь идет о выздоровлении, важно не только непосредственно воздействовать на причину болезни (онкологический, воспалительный, дисгормональный процесс), но и уделять внимание поддержке иммунной системы, частью которой являются пресловутые макрофаги. Прием препарата Трансфер Фактор позволяет нормализовать деятельность иммунитета и помочь макрофагам в осуществлении их благого дела – борьбы с возбудителями заболеваний и другими вредоносными факторами.
Регулярная терапия этим средством может помочь выздороветь от большинства заболеваний молочной и щитовидной желез, а при профилактическом приеме предупредить их появление. При устойчивой и слаженной работе всех звеньев иммунитета, что достигается благодаря Трансфер Фактору, риск заболеть аутоиммунными, воспалительными и даже онкологическими процессами этих органов многократно уменьшается.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
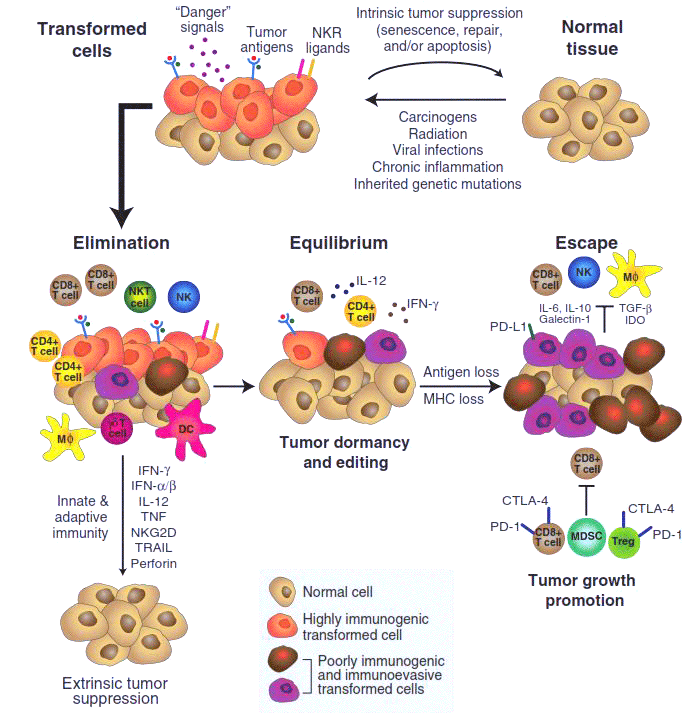
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
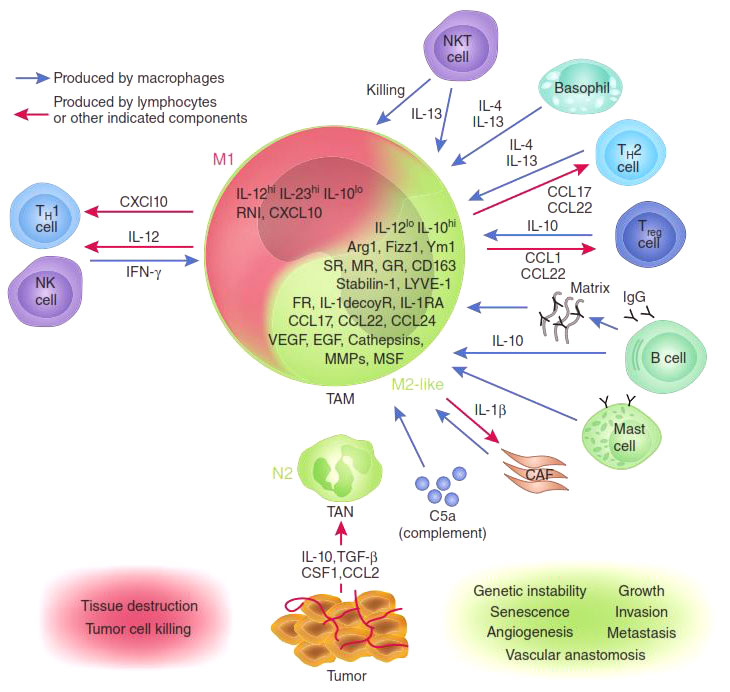
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Фиброзно-кистозная мастопатия – болезнь цивилизации

Врачи нередко при обращении к ним женщин с жалобами на боли, нагрубание молочных желез ставят диагноз мастопатии. Но далеко не всякий дискомфорт молочных желез является мастопатией.
Для обоснованной постановки данного диагноза женщина должна пройти всестороннее обследование:
Диагноз мастопатии ставят при обнаружении комплекса следующих патологических проявлений.
Классификация мастопатии
Предложено несколько классификаций мастопатии. В практике наиболее часто пользуются клинической классификацией, которая делит мастопатию на 3 формы.
1. Масталгия (мазоплазия, мастодиния). При этой форме преобладающим являются выраженные боли в молочных железах, которые требуют назначения обезболивающих препаратов.
2. Диффузная мастопатия. При этом в тканях молочных желез выявляются диффузные уплотнения и кисты. В свою очередь, диффузная мастопатия делится на 2 подтипа:
а) диффузная фиброзная мастопатия, преобладают фиброзные (соединительнотканные) участки уплотнений;
б) диффузная фиброзно-кистозная мастопатия, на фоне фиброзных уплотнений выявляются кисты.
3. Локализованная мастопатия (локализованный фиброаденоматоз).
При этом в каком-либо квадранте молочной железы выявляется четко отграниченный участок. Данную форму выделяют специально, так как при выявлении отграниченного узла в молочной железе необходимо исключить наличие рака. Поэтому при локализованном фиброаденоматозе обязательно проводят маммографию и исследование клеток или тканей из узла. Иногда природу узла в молочной железе можно выявить только во время операции. В таком случае женщине предлагают операцию, под наркозом проводят секторальную резекцию молочной железы с подозрительным участком, и направляют удаленную ткань на срочное гистологическое исследование.
Лечение мастопатии
Диффузная мастопатия лечится консервативным путем. При мастопатии рекомендуется ограничение в пище животных жиров, молочно-растительная диета, увеличение потребления овощей и фруктов, сои и других бобовых, пищевых волокон с отрубями злаковых; оптимизация веса тела; нормализация режима сна и бодрствования; увеличение двигательной активности и лечебная физкультура. Применяют в лечении мастопатии санаторно-курортное лечение, минеральные воды, физиотерапию, аутотренинг, психотерапию.
Применяемые лекарственные препараты можно разделить на 2 группы:
1. Гормональные средства: препараты на основе женских половых гормонов
2. Негормональные средства: витамины, адаптогены, мочегонные, успокаивающие, улучшающие работу печени, препараты калия, ферменты, обезболивающие, препараты йода. В лечении мастопатии используются фитотерапия и препараты на основе природных биологически активных веществ, биологически активные добавки к пище.
При сопутствующей патологии, вызывающей мастопатию, необходимо дополнительное лечение выявленных заболеваний: лечение гинекологических болезней, лечение заболеваний щитовидной железы, регулирование и стабилизация обменных процессов, лечение заболеваний печени и желчного пузыря, устранение венозного застоя в малом тазу, ликвидация синдрома дисбактериоза толстого кишечника и запоров.
Хирургическое лечение при мастопатии проводится лишь в нескольких случаях.
При наличии крупной кисты с жидким содержимым проводят пункцию кисты, отсасывают содержимое. Иногда для того, чтобы стенки кисты спались, внутрь нее вводят склерозирующие вещества. Подобные операции выполняются, как правило, в амбулаторных условиях. При локализованном фиброаденоматозе, как уже говорилось выше, нередко женщину приходится госпитализировать и с диагностической целью проводить секторальную резекцию молочной железы. При фиброаденоме молочной железы иногда в стационарных условиях проводят оперативное лечение: вылущивание опухоли молочной железы, секторальная резекция молочной железы. В большинстве случаев фиброаденому не удаляют, а проводят за ней динамическое наблюдение.
Занимайтесь самообследованием, запомните: положительный результат возможен лишь при очень аккуратном, последовательном и длительном лечении по схеме, рекомендованной врачом.
Функции макрофагов в различных условиях микроокружения опухоли
Связанные с опухолью макрофаги, как известно, стимулируют ключевые этапы прогрессирования опухоли. В этом обзоре рассказывается о многочисленных экспериментальных и клинических исследованиях, проведенных с целью изучения функций, регуляции и клинической значимости опухолевых макрофагов. В отношении клинической значимости наиболее интересны три участка инвазии раковых клеток: опухолевые гнезда, пограничная зона между стромой и опухолевыми клетками, а также области, близкие к сосудистой сети опухоли или удаленные от нее. Более полное понимание разнообразия опухолевых макрофагов может привести к разработке избирательных методов лечения, основанных на восстановлении противораковых функций этих клеток.
Вступление
Опухолевые макрофаги (ОМ) изобилуют в большинстве типов злокачественных новообразований, способствуют опухолевому ангиогенезу, выходу раковых клеток из опухоли в кровоток, способствуют их выживанию и постоянному росту в метастатических колониях, подавлению противоопухолевых иммунных механизмов. В то же время ОМ могут подавлять, дополнять или опосредовать противоопухолевые эффекты цитотоксических агентов, лучевой терапии, антиангиогенных препаратов и ингибиторов контрольных точек.
Происхождение этих клеток в настоящее время является предметом обсуждения. Недавние исследования показали, что макрофаги во многих тканях происходят не из циркулирующих моноцитов, как первоначально предполагалось, а из эмбриональных макрофагов (особенно из макрофагов желточного мешка), которые закладываются в тканях во время развития. Эти предшественники остаются в тканях взрослого организма и размножаются, таким образом, сохраняясь независимо от гемопоэтической системы взрослого человека. В некоторых органах, например, в кишечнике, основные популяции макрофагов развиваются путем рекрутирования моноцитов. Выборочное истощение каждого из этих двух подтипов ОМ показало, что только эмбриональные макрофаги поддерживают опухолевый рост.
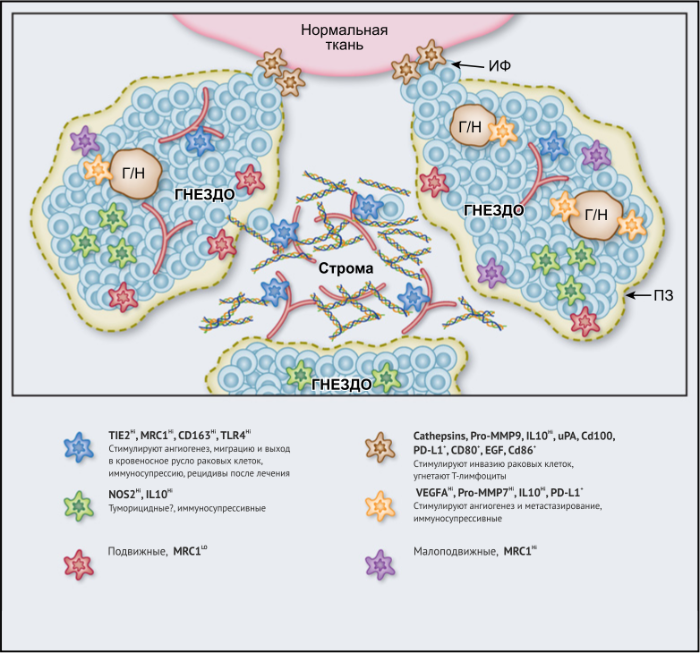
ОМ могут находиться в различных состояниях активации. Обычно они отклоняются от «классически» активированного, агрессивного по отношению к опухоли фенотипа (иногда называемого M1) в сторону «альтернативно» активированного опухолевого промотора (M2). Однако как и макрофаги во многих других тканях, ОM обладают замечательной функциональной пластичностью и часто экспрессируют маркеры, характерные для обоих состояний активации, что делает такой полярный подход к их классификации неточным. Предполагается, что функции ОМ могут, по крайней мере частично, регулироваться их расположением в опухоли; что они проявляют разные функции по меньшей мере в трех областях инвазии раковых клеток: области высокой плотности раковых клеток (так называемом «опухолевом гнезде»); периваскулярной (ПВ) нише; и плохо васкуляризованных гипоксических/некротических областях опухоли (Рис.1 и 2).
Области инвазии
Существует по крайней мере три основных локализации, в которых прогрессия опухоли была ассоциирована с повышенной инвазией клеток.
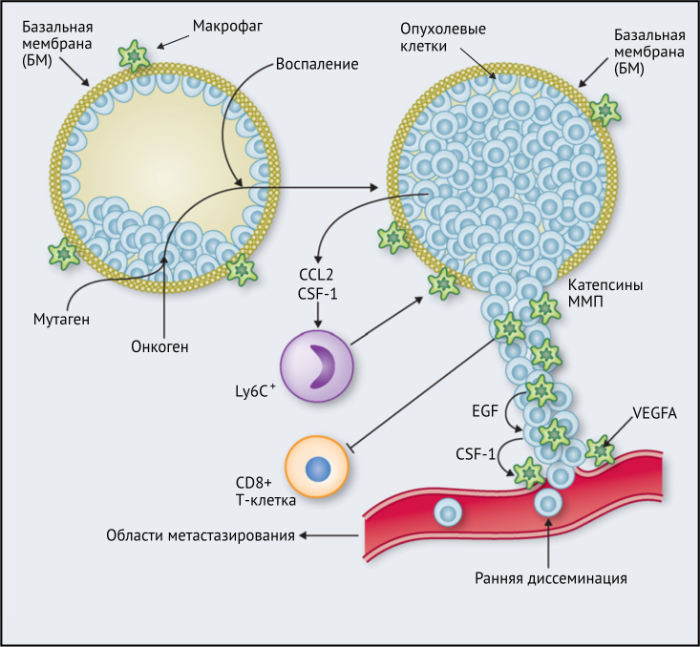
Результаты исследований, проведенных на мышах, показывают, что макрофаги способствуют развитию злокачественных опухолей различными способами: реконструируют внеклеточный матрикс, опосредуют разрушение базальной мембраны, увеличивают подвижность раковых клеток, и их способность к миграции, способствуют прогрессированию преинвазивных поражений, выделяют фактор роста эндотелия сосудов A (VEGF-A). Макрофаги вокруг преинвазивных поражений молочных желез у мышей высвобождают CXCR2-связывающие хемокины CXCL1 и CXCL5, которые способствуют миграции и инвазии соседних предростопластических (предраковых) эпителиальных клеток. В то же время подавление активности макрофагов вызывало замедление развития инвазии опухолевых клеток и развития опухоли в целом.
Недавнее исследование на модели рака легких Kras G12D показало, что нарушение регуляции онкогенов, таких как Myc, в раковых клетках вызывает трансформацию медленно прогрессирующей аденомы легкого в агрессивную аденокарциному. Это связано с тем, что изменения в Myc стимулировали увеличение экспрессии CCL9 и IL-23 эпителиальными клетками легких. CCL9 затем стимулировал накопление VEGFA + макрофагов и, следовательно, ангиогенез опухоли, а также PD-L1-зависимое вытеснение T- и B-клеток. Кроме того, IL-23 стимулировал гибель Т- и В-клеток и цитотоксических NK-клеток (Рис.1).
Следует отметить, что антитела против CD68 продолжают широко использоваться в качестве иммунных меток ОМ в опухолях (Таблица 1). Однако как и многие другие антитела, маркирующие отдельные типы клеток, человеческие анти-CD68 иногда маркируют клетки, отличные от ОM. Например, методом качественного анализа с помощью иммуноокрашивания удалось установить, что некоторые клетки CD68 + в опухолях молочной железы человека не экспрессируют рецептор к КСФ-1 (КСФ-1Р), CD45 или другие маркеры эпителиальных клеток, эндотелиальных клеток или клеток стенок сосудов (то есть гладкомышечных клеток, перицитов или фибробластов). Остается неизвестной как принадлежность этих клеток, так и то, маркируются ли они антителами к CD68 иного происхождения.
ОМ в ИФ опухоли поджелудочной железы RIP1-Tag2 мыши усиливают инвазивный потенциал раковых клеток посредством экспрессии катепсинов B и S, двух ферментов, регулируемых IL-4, высвобождаемым раковыми клетками и инфильтрирующими опухоль Т-клетками. Кроме того, было показано, что CD4 + Т-клетки в опухолях MMTV-PyMT увеличивают инвазивность раковых клеток благодаря IL-4, что затем стимулирует ОM экспрессировать эпидермальный фактора роста (EGF).
Эти экспериментальные данные хорошо согласуются с данными исследований, согласно которым ОM в ИФ опухолей желудка человека выделяют MMP9 — фермент, разрушающий матрикс, — и рецептор сериновых протеаз, урокиназный активатор плазминогена (УАП, урокиназа). Интересно, что ОМ вдоль ИФ первичной карциномы толстой кишки экспрессируют CD80 и CD86 (костимуляторные сигналы, необходимые для активации Т-клеток), что указывает на то, что они могут иметь потенциал для стимулирования противоопухолевого иммунитета при этом типе рака. Это может объяснить наблюдение, что повышенное количество CD68 + ОM в ИФ колоректальных опухолей человека коррелируют с более высокой выживаемостью без рецидива (RFS) (Таблица 1). Тем не менее, в ИФ опухолей могут присутствовать различные ОM-подмножества, причем некоторые из них являются иммуносупрессивными. Например, ОM в ИФ гепатоцеллюлярных карцином (ГЦК) экспрессируют более высокое количество лиганда иммуносупрессивной контрольной точки PD-L1, чем ОМ в других опухолевых гнездах, и связаны с плохой выживаемостью. Кроме того, было показано, что семафорин 4D (SEMA4D, CD100) — цитокин, экспрессия которого особенно выражена в ИФ опухоли толстой кишки Colon26, стимулирует ОM, которые экспрессируют иммуносупрессивный цитокин IL-10 в ИФ, и таким образом подавляют активированные CD8 + Т-клетки. Блокада антител SEMA4D подавляла ОМ в ИФ и повышала эффективность лечения ингибиторами контрольных анти-PD-1 и анти-CTLA4 (Рис.2).
Опухолевые гнезда
Возможные функции ОМ в непосредственной близости от раковых клеток в опухолевых «гнездах», по-видимому, варьируются в зависимости от типа опухоли. Например, ОM, экспрессирующие NOS2 — фермент, связанный с их цитотоксическим потенциалом, — обнаруживаются в тесном контакте с раковыми клетками в некоторых опухолях предстательной железы, а большое количество ОM в опухолевых гнездах коррелирует с улучшенным прогнозом при раке эндометрия, а также снижением количества рецидивов рака желудка (Таблица 1). Повышенное количество ОM коррелирует с уменьшенной общей выживаемостью и RFS при злокачественных меланомах, а также опухолях молочной железы и пищевода (Таблица 1). ОМ в гнездах ГЦК человека экспрессируют IL-10 и рекрутируют иммуносупрессивные клетки FoxP3 + Treg, хотя нет данных, что эти Treg влияют на исход заболевания (Рис. 2).
Интересно, что ОМ экспрессируют сигнальный регуляторный белок альфа (SIRP-α) на своей поверхности, который связывается с трансмембранным белком CD47 на злокачественных клетках. Когда это происходит, подавляется способность ОM обнаруживать и фагоцитировать опухолевые клетки. Различные исследования показали, что блокирование CD47 прерывает этот сигнал «не ешь меня» и вызывает разрушение опухолей при посредстве ОM у мышей, а высокая экспрессия CD47 обуславливает плохой прогноз рака мочевого пузыря, острого миелоидного лейкоза, неходжкинских лимфом и рака молочной железы. Так опухолевые клетки уклоняются от наблюдения ОМ.
Строма
В области стромы большинства солидных опухолей опухолевых клеток обычно мало либо нет вовсе. Она состоит из сложной сети макромолекул, формирующих внеклеточный матрикс(ВКМ), к которым относятся коллагеновые фибриллы, ламинин, фибронектин, тенасцин C и гиалуроновая кислоту (ГК). В нем часто находятся популяции различных клеток, включая фибробласты, эндотелиальные клетки, перициты, лимфоциты и миелоидные клетки. Ряд исследований показал, что компоненты ВКМ (и/или продукты его протеолиза), такие как фибронектин, ламинин-10, версикан (хондроитинсульфатсодержащий протеогликан) и фрагменты ГК, регулируют фенотип макрофагов. Пинто и его коллеги в исследованиях in vitro показали, что бесклеточный ВКМ, выделенный из колоректальных опухолей, стимулирует макрофаги экспрессировать IL-10, TGF-β и снижает экспрессию рецепторов хемокинов C-C 7 (CCR7), TNF-α и IL-6. Кроме того, повышенная экспрессия стромальными ОМ лигандов хемокинов C-C 18 (CCL18) связана с повышенным метастазированием и снижением выживаемости у пациентов при раке молочной железы. Это согласуется с рядом исследований, свидетельствующих о корреляции между большим количеством стромальных ОМ и низкой общей выживаемостью и RFS при опухолях молочной железы, пищевода, желудка, поджелудочной железы, орофациальных, кожных (Таблица 1). Существует зависимость от типа опухоли, поскольку такой корреляции при раке эндометрия, шейки матки и легких не выявлено, а при раке мочевого пузыря прослеживается уменьшение метастазирования в лимфатических узлах и улучшение выживаемости (Таблица 1).
Помимо описанных выше химических компонентов стромы опухоли, функции ОМ также регулируют ее биофизические свойства. Архитектоника и плотность ВКМ регулирует экспрессию различных провоспалительных генов макрофагами in vitro путем активации сигнальных путей TLR4 в этих клетках. Высокие уровни 22 общих составляющих матрикса («меток матрикса») положительно коррелируют как с плотностью опухоли, так и с инфильтрацией ОМ при метастазах рака яичников, хотя еще предстоит выяснить, есть ли причинно-следственная связь между инфильтрацией и структурой опухоли. Также следует отметить, что разные области стромы при данной опухоли могут различаться по своим химическим и биофизическим свойствам и влиять на ОМ по-разному (Рис. 2).
Периваскулярная ниша
Подмножество ОМ лежит близко или на поверхности кровеносных сосудов в опухолях мышей и человека. Эти клетки часто экспрессируют большое количество маркеров, связанных с M2: TIE2 (основной рецептор ангиопоэтина), MRC1 и CD163, — и играют ключевую роль в стимулировании ангиогенеза опухоли, метастазирования и рецидива после терапии первой линии. Из-за их относительно высокой экспрессии TIE2 эти клетки первоначально назывались «TIE2-экспрессирующие моноциты/макрофаги (TEM)». Частота TEM также положительно коррелирует с плотностью микрососудов (MVD) у некоторых типов опухолей человека (Табл. 1).
Генетическая делеция периваскулярных (ПВ) TIE2 + ОМ или фармакологическая блокада основного лиганда TIE2 — ангиопоэтина 2 (AGPT2), — продемонстрировали важную роль этого подмножества ОM в ангиогенезе опухоли и ее росте у различных мышиных моделей рака. Стимуляция экспрессии генов TEM, выделенных из опухолей мыши, привела к более высокой экспрессии ряда генов, способствующих развитию опухолей, включая Mmp9, Vegfa, Cxcl12, Tlr4 и Nrp1, чем TIE2- ОM из тех же опухолей.
ПВ TIE2 + ОM также участвовали в рецидиве первичных опухолей мыши после различных форм лечения. Они учащают рецидивы глиомы после местного облучения, а также при опухолях легких и молочной железы после химиотерапии. В такие моменты они экспрессируют большое количество CXCR4 и рекрутируются с помощью активированного CXCL12 в ПВ нише. Это подмножество ОМ затем стимулирует реваскуляризацию и рост опухоли посредством высвобождения VEGF-A. Позднее исследование подтвердило, что экспрессия TIE2 в ОМ необходима для стимуляции васкуляризации после химиотерапии у мышей. Кроме того, недавно рекрутированные моноциты также мигрируют вокруг опухолей, не подвергавшихся терапии, зависимым от CXCR4 образом. Меченые моноциты проникали в ПВ зону опухоли PyMT, где они затем подвергались воздействию TGFβ, выделяемого раковыми клетками, что стимулировало эти моноциты повышать свою экспрессию CXCR4 и мигрировать к CXCL12-экспрессирующим фибробластам вокруг опухолевых кровеносных сосудов в богатых коллагеном стромальных областях. Как только они примыкают к сосудам, моноциты дифференцируются в «метастаз-ассистирующие» ПВ ОM, участвующие в TMEM.
Наконец, в метастатических областях, таких, как легкие, подмножество макрофагов CCR2 + Ly6C + способствует выходу раковых клеток в кровеносное русло и образованию из них метастазов. Эти «метастаз-ассоциированные макрофаги» (MAM) были использованы в мышиных моделях опухолей, чтобы напрямую связать молекулу адгезии сосудистых клеток-1 (VCAM-1) с раковыми клетками через их α4-интегрины. Этот процесс впоследствии увеличивает выживаемость раковых клеток в таких метастатических областях. Кроме того, связывание CCL2 с CCR2 на MAM стимулирует высвобождение ими CCL3, который связывается с CCR1 на раковых клетках и облегчает их удержание в легких. Эти MAM также способствуют постоянному росту метастатических повреждений с помощью сигналов VEGFR1 и CSF-1R.
Гипоксические/некротические области
Гипоксия является отличительной чертой солидных опухолей и связана с увеличением инвазии и метастазов, сопротивлением терапии и плохим клиническим исходом. Гипоксические области обычно имеют парциальное давление кислорода (рО2) ниже 10 мм рт. ст. Они расположены более чем в 150 мкм от опухолевых кровеносных сосудов. Они образуются в опухолях, когда потребность клеток в кислороде опережает их снабжение плохо организованными опухолевыми сосудами. Эти области были идентифицированы в опухолевых срезах с использованием маркеров гипоксических клеток, например, пимонидазола, или иммуноблока для индуцируемой гипоксией альфа-субъединицы транскрипционных факторов HIF 1 и 2. Большое количество гипоксических ОМ ассоциируется с повышенным уровнем ангиогенеза опухолей, метастазами, сниженной RFS и/или снижением общей выживаемости при раке молочной железы, эндометрия и шейки матки (Таблица 1).
ОM в таких областях регулируют HIF 1 и 2 и различные гены-мишени HIF, такие как VEGF-A, GLUT1 и MMP7. Хемокины, усиливающие гипоксию, рекрутируют в гипоксические области ОМ, в том числе хемокин C-X-C 12 (CXCL12), полипептид-активирующий эндотелий-клеточный моноцит II (EMAP-II), эндотелин 2, VEGF-A и SEMA3A. Гипоксические ОМ иммобилизируются в этих областях прямым ингибирующим действием гипоксии на их подвижность и снижением экспрессии их рецепторов опухолевых хемокинов CCR2, CCR5 и NRP1.
Гипоксические ОМ способствуют ангиогенезу опухоли, уклонению от иммунитета и метастазированию в различных экспериментальных моделях. Например, они регулируют экспрессию большого количества проангиогенных и иммуносупрессивных цитокинов в гипоксических зонах опухоли, а когда их проникновение в гипоксические области опухолей затруднено сигнальной блокадой SEMA3A/NRP1, опухолевый ангиогенез заметно снижается и противоопухолевый иммунитет восстанавливается. Гипоксические ОМ также способны подавлять активацию Т-клеток различными способами, влияя на IL-10 и на контрольные точки, например, через лиганд PD-L1. Макрофаги, кокультивированные с клетками ГЦК в гипоксических условиях, увеличивают экспрессию индоламин 2,3-диоксигеназы (IDO), которая подавляет пролиферацию местных цитотоксических Т-клеток и увеличивает популяцию клеток Treg.
Хотя воздействие гипоксии само по себе не может изменить фенотип ОМ в отношении стимуляции роста опухоли, некоторые исследования показали, что низкий уровень рН и лактат (которые накапливаются в слабо васкуляризированных, гипоксических областях из-за плохого сосудистого питания) совместно индуцируют проангиогенный фенотип ОМ, который, в свою очередь, восстанавливает перфузию крови. Действительно, молочная кислота может стимулировать экспрессию VEGF-A макрофагами. Как упоминалось ранее, этот цитокин является не только проангиогенным в опухолях, но также способен стимулировать выход в сосуды раковых клеток.
Опухолевая гипоксия также может модулировать функции ОМ опосредованно, стимулируя раковые клетки выделить белок группы 1 с высокой подвижностью (HMGB1), который, в свою очередь, стимулирует продукцию IL-10 ОM. Гипоксия также индуцирует метаболические изменения в ОМ, которые затем непосредственно влияют на функции соседних клеток. Например, гипоксия стимулирует экспрессию REDD1, ингибитора mTOR и ключевого модулятора метаболизма в ответ на доступность питательных веществ и потребность в энергии. Ингибирование mTOR в ОM сильно снижает их поглощение глюкозы и активность гликолиза, оставляя больше глюкозы для соседних эндотелиальных клеток. Это повышает способность раковых клеток проникать в сосудистое русло, соответственно, приводит к формированию отдаленных метастазов.
Таблица 1. Опухолевые макрофаги в различных злокачественных новообразованиях человека: корреляция с клинико-патологическими проявлениями
Заключение
Ряд экспериментальных исследований на мышах подтвердил способность различных опухолевых популяций дифференцированно регулировать фенотип ОМ. Важность этого подчеркивается клиническими отчетами, показывающими, что число или фенотип ОМ в определенных областях опухоли коррелируют с RFS и выживаемостью (Таблица 1).
Имеются данные о роли подмножеств ОM в определенных областях опухолей, ограничивающих ответ опухолей на лечение. Например, облучение, сосудистые разрушающие агенты и цитотоксические препараты индуцируют пролиферацию ПВ ОM, что способствует ангиогенезу опухоли и рецидиву после терапии. Гипоксические ОМ также были вовлечены в устойчивость опухолей к противоопухолевой терапии и способствуют рецидиву.
Демонстрация того, что ОМ стимулируют ряд механизмов опухолеобразования на мышиных моделях опухолей, побудила к развитию терапевтических подходов к истощению или перепрограммированию ОМ. На сегодняшний день общие ингибиторы ОМ, включая те, которые нацелены на CSF-1-CSF-1R и CCL-CCR2, в значительной степени не показали эффективности в клинических испытаниях в качестве монотерапии рака, хотя они могут оказаться эффективными в сочетании с другими терапевтическими агентами. Ингибитор CSF-1-R PLX3397 показал значительную эффективность при лечении теносиновиальной гигантоклеточной опухоли, лечение также выявило побочное действие, вызванное долгосрочным истощением всех макрофагов.
Таргетная терапия в отношении определенных ОM-подмножеств в опухолях может стать отличным методом в качестве противоопухолевой терапии посредством истощения или перепрограммирования тех ОМ, которые способствуют с помощью различных механизмов опухолевой прогрессии, при этом она должна оставлять или усиливать те подмножества ОМ, которые способствуют противоопухолевому иммунитету. Прогресс в нашем понимании того, как фенотип подмножеств ОМ в различных областях опухоли зависит от их онтогенеза, статуса активации и сложного комплекса местных взаимодействий поможет разработать такой терапевтический подход. Раскрытие сложного массива влияний на поведение ОM потребует многогранного подхода к исследованиям, однако это может привести к появлению новых возможностей в лечении опухолевых заболеваний, появлению новых таргетных противоопухолевых препаратов.
Источник: Yang M. et al. Diverse Functions of Macrophages in Different Tumor Microenvironments //Cancer research. – 2018. – Т. 78. – №. 19. – С. 5492-5503.