Метаболизм нервной системы что это
Обменные процессы в ЦНС
В передаче сигналов от нейрона к нейрону участвуют протеинкиназы, нейромедиаторы, ионные каналы, G-протеины и некоторые другие передатчики сигналов. Алкогольное отравление в острой фазе влияет на кальциевые каналы нейронов, угнетая их активность и вследствие этого увеличивается число потенциалзависимых каналов при хроническом воздействии алкоголя. В случае же отмены воздействия этанола, происходит увеличение перехода кальция в клетку и повышение нейронной возбудимости.
Не так давно были приведены доказательства того, что при злоупотреблении алкоголем в ЦНС повышается уровень эндорфинов, что, безусловно, увеличивает мотивацию к приему алкоголя.
При абстинентном же синдроме уровень эндорфинов наоборот, уменьшается, а следовательно, ухудшается настроение и уменьшается болевой порог. Немалую роль в поддержании нормального уровня температуры тела, аппетита, сна и настроения играет серотонин. При отмене алкоголя, уровень серотонина в тканях мозга увеличивается. Считается, что при абстинентном синдроме именно увеличение активности серотонинергических рецепторов приводит к появлению психопатических нарушений, а также тошноте, рвоте.
Главным нейромедиатором вегетативной, а возможно, и центральной нервной системы является ацетилхолин. При алкогольном абстинентном синдроме уровень моноаминов и ГАМК-эргических процессов торможения понижается, а роль холинэргических процессов в ЦНС повышается.
Уровень кортизола в крови при абстинентном синдроме сильно повышается, следствием чего может стать гибель нейронов, нарушение метаболизма клеток, а также увеличение риска возникновения инфекционных заболеваний.
Итак, основой патогенеза абстинентного синдрома, по мнению современных ученых, можно назвать межмедиаторные нарушения. Именно за счет этих нарушений во время алкогольного абстинентного синдрома процессы возбуждения ЦНС всегда преобладают над процессами торможения, хотя симптоматика может в различных ситуациях отличаться по срокам и тяжести протекания, а также клиническим проявлениям.
Одна из функций, больше всего подверженная влиянию алкоголя – функция системы ГАМК и NMDA рецепторов.
Важнейшим тормозным нейромедиатором ЦНС является гамма-аминомасляная кислота (ГАМК), которая снижает уровень чувствительности нейронов. При однократном приеме алкоголя активность ГАМК-рецепторов повышается, а при постоянной интоксикации – снижается, к тому же уровень ГАМК в ценральной нервной системе уменьшается. Таким образом, при абстинентном синдроме происходит возбуждение ЦНС.
Глутамат – один из главных возбуждающих нейромедиаторов, который участвует во взаимодействии с рецепторами трех типов, в числе которых N-метил,D-аспартат (NDMA) рецептор. Этот рецептор участвует в процессе обучения, а также принимает непосредственное участие в развитии судорожных припадков. Прием алкоголя один раз подавляет активность этих рецепторов, а хроническое употребление – увеличивает количество рецепторов NDMA. Во время абстинентного синдрома глутамат оказывает более активное влияние на нейроны.
Текст проверен врачами-экспертами:
Заведующей социально-психологической службы МЦ «Алкоклиник», психологом Барановой Ю.П., врачом психиатром-наркологом Серовой Л.А.
Проконсультируйтесь
со специалистом
Причины психических расстройств ( дисфункция энергетического метаболизма )
Многие исследования были проведены на посмертной мозговой ткани пациентов, страдающих психоневрологическими расстройствами. Протеомные исследования имеют то преимущество, что дают ценную информацию о том, какие белки присутствовали во время течения заболевания и каков был уровень их экспрессии.
Анализ образцов крови пациентов с шизофренией выявил повышенный уровень инсулина и повышенную резистентность к инсулину. Кроме того, была обнаружена более высокая распространенность гипергликемии и нарушения толерантности к глюкозе у пациентов с шизофренией по сравнению со здоровыми людьми.
Шизофрения также ассоциируется с дисфункцией митохондрий и наличием мутаций и полиморфизмов в митохондриях. Митохондриальная гипоплазия также наблюдалась в дополнение к существенным изменениям ферментативной активности Комплекса I, расположенного во внутренней мембране митохондрий, которые вместе указывают на дисфункцию системы окислительного фосфорилирования и снижение производства АТФ у больных шизофренией. Нарушения, связанные с признаками окислительного стресса, проявляются при шизофрении, например, такие как более высокие уровни активности супероксиддисмутазы (SOD) и глутатионпероксидазы (GSH-Px) показывают более высокие уровни активности по сравнению со здоровыми людьми.
Другим важным клеточным процессом, связанным с митохондриями, является поддержание гомеостаза кальция, и исследования показали нарушение гомеостаза кальция и передачи сигналов при шизофрении. Все вышеупомянутые процессы, измененные при шизофрении, вовлечены в синаптическое ремоделирование, и их дисфункция может вызывать широкий спектр вредных воздействий и, следовательно, влиять на пластичность мозга.
Подход к фармакологически модели шизофрении в клеточной культуре заключается в лечении клеток МК-801, который действует на глутаматергическую систему. Обработка культивируемых нейронов, олигодендроцитов и астроцитов МК-801 способствовала значительному изменению уровня ферментов, связанных с гликолизом в трех типах клеток.
Некоторые факторы, связанные с метаболическим синдромом, включая ожирение, диабет и гипергликемию, связаны и с наличием депрессии; а также в литературе имеются сообщения об инсулинорезистентности у пациентов с большим депрессивным расстройством. Измерения ПЭТ у пациентов с большой депрессией выявили снижение как кровотока, так и метаболизма глюкозы в хвостатом ядре, передней поясной извилине и префронтальной коре во время тестов, которые проводились как в состоянии покоя, так и в стрессовых ситуациях. Однако, анализ орбитальной коры, медиального таламуса и миндалины показал усиление кровотока и метаболизма глюкозы.
Биполярное аффективное расстройство
Пациенты с биполярным аффективным расстройством имеют более высокую частоту метаболического синдрома по сравнению с населением в целом. Было отмечено, что частота метаболического синдрома варьировала от 17 до 67% у пациентов с биполярным аффективным расстройством. Этот синдром является фактором высокого риска сердечно-сосудистых заболеваний и сахарного диабета 2 типа. Исследования показали, что больные биполярным аффективным расстройством более подвержены гипергликемии, сахарному диабету 2 типа и резистентности к инсулину, чем население в целом.
Протеомика и нейропсихиатрия
Митохондриальная дисфункция связана с депрессией и может объясняться недостатками как концентрации, так и активности белков, необходимых для правильного функционирования цепи переноса электронов. Согласно клиническим исследованиям, взрослые, а также дети, у которых диагностировано первичное заболевание OXPHOS, чаще страдают от тяжелой депрессии. Кроме того, у пациентов с большим депрессивным расстройством наблюдалось значительное снижение показателей продукции митохондриальной АТФ и соотношений митохондриальных ферментов.
Антидепрессанты, такие как циталопрам и венлафаксин, способствуют изменениям NADH-дегидрогеназы и цитохром с-оксидазы, что указывает на то, что эти комплексы с транспортной цепью электронов являются желательными лекарственными мишенями и потенциальными маркерами для MDD.
mTOR
Протеомный анализ мозолистого тела, самой большой структуры белого вещества в мозге человека, богатой глиальными клетками, показал, что некоторые белки были дифференцированно фосфорилированы. Среди них была мишень рапамицина (mTOR) млекопитающих, киназы, которая является компонентом пути mTORC1 и играет роль в регуляции синтеза белка, главным образом путем прямого и непрямого фосфорилирования, а также является важным регулятором внутриклеточных коммуникативных процессов в глиальных клетках. AMP-активированная протеинкиназа (AMPK) является клеточным сенсором энергии и сигнальным преобразователем, который регулируется широким спектром метаболических стрессов, и AMPK напрямую фосфорилирует множественные компоненты в пути mTORC1. Взаимосвязь между сигнальными путями mTOR и AMPK делает mTOR чувствительным даже к самому низкому истощению АТФ. Следовательно, наблюдение за изменениями профиля фосфорилирования в mTOR подчеркивает нарушение выработки энергии в глиальных клетках пациентов с шизофренией.
Липидомика и нейропсихиатрия
Несколько исследований показали влияние антидепрессантов, антипсихотиков и стабилизаторов настроения на активность PLA2. Сообщалось, что антипсихотический препарат клозапин повышает уровень AA и докозагексаеновой кислоте (DHA) эритроцитов у пациентов с шизофренией. Это может указывать на дополнительный механизм, который способствует терапевтическому действию клозапина. Было показано, что литий в терапевтических концентрациях сильно ингибирует активность PLA2. Тем не менее, важно попытаться оценить, является ли нарушение метаболизма мозга причиной или следствием возникновения психических расстройств. Фактически, большая депрессия была описана как начальный симптом митохондриальной болезни в большом размере выборки взрослых пациентов. Было показано, что митохондриальная функция и энергетический обмен играют важную роль в регулировании социального поведения. Кроме того, ограниченное производство энергии может нарушать адаптивную нейронную способность и вносить вклад в качестве одной из причин развития психопатологий, таких как шизофрения, биполярное расстройство и большая депрессия при стрессе.
Общая дисрегуляция энергетического метаболизма
Ферменты
Ферменты, такие как пероксиредоксины (1,2,5,6), глутатион-S-трансфераза и супероксиддисмутаза, участвуют в защите клеток от окислительного повреждения и, как было установлено, изменяются при психических расстройствах. В ситуациях, когда образование свободных радикалов превосходит способность антиоксидантной защиты клетки, окислительный стресс может вызвать прямые повреждения клеточных липидов, ДНК и белков, что влияет на нормальное функционирование клеток. Было высказано предположение, что окислительное повреждение головного мозга может в некоторой степени способствовать развитию этих расстройств, и ассоциирование соединений с антиоксидантными свойствами с существующим лечением может быть возможным подходом в дополнение к фармакологическому лечению шизофрении и биполярного аффективного расстройства.
Транскетолаза и 6-фосфоглюконолактоназа связаны с окислительно-восстановительным процессом и были изменены при шизофрении. Они являются ключевыми ферментами в пентозофосфатном пути (PPP), который синтезирует восстановленную форму никотинамидадениндинуклеотидфосфата (NADPH) и рибозо-5-фосфата. Изменения в уровнях NADPH и потенциальный дисбаланс в соотношении NADP + / NADPH были зарегистрированы у пациентов с шизофренией. Это свидетельство, наряду с более низкими уровнями пирувата, указывает на то, что гликолиз является ключевым путем в патогенетических процессах шизофрении. Кроме того, было обнаружено, что аконитаза, изоцитратдегидрогеназа, малатдегидрогеназа и оксоглутаратдегидрогеназа изменяются при шизофрении и связаны с циклом TCA. Это указывает на изменения в митохондриальных путях, которые согласуются с концепцией, что широкие митохондриальные процессы затрагиваются при этом психическом расстройстве.
Диагностика патологий клеточного метаболизма при нейродегенеративных заболеваниях
Диагностика патологий клеточного метаболизма при нейродегенеративных заболеваниях
Нейродегенеративные заболевания характеризуются постепенной потерей нейронов в различных структурах центральной нервной системы. Одной из причин гибели нейронов могут быть нарушения работы митохондрий.
Автор
Редактор
Нейродегенеративные заболевания — это большая группа неврологических расстройств, связанная с постепенным уменьшением количества нервных клеток из-за специфических изменений их метаболизма. К числу этих недугов относят болезни Альцгеймера, Паркинсона и ряд других, более редких патологий (например, хорею Гентингтона). Современные методы лечения имеют ограниченную эффективность и в лучшем случае помогают замедлить их прогрессирование. Если существующие подходы к решению проблемы не работают, значит нужно подойти к ней с другой стороны. И новые данные могут оказаться полезными для разработки более эффективных методов лечения.
Биоэнергетика
Спецпроект о клеточном энергетическом метаболизме, работе митохондрий и АТФ, а также о заболеваниях, связанных с нарушениями функций клеточных «батареек».
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Статья, которую вы сейчас читаете, является частью спецпроекта «Биоэнергетика», которую «Биомолекула» делает совместно с компанией «БиоХимМак». В цикле уже вышел обзор о болезнях и изменениях клеточного метаболизма [1] и статья, посвящённая нарушению работы митохондрий при онкологических заболеваниях [2]. В них обсуждается роль митохондрий в здоровых клетках и клетках, которые подвержены патологическим изменениям. Эта, последняя статья цикла, рассказывает о митохондриальной дисфункции при нейродегенеративных заболеваниях — болезнях Альцгеймера, Паркинсона и других неврологических расстройствах. Сначала мы обсудим, как при этих болезнях меняется функционирование митохондрий. Затем рассмотрим существующие методы исследования их работы в нервных клетках и использование получаемой при этом информации.
Клетка с севшими батарейками
Каждое из нейродегенеративных заболеваний связано с изменениями разных метаболических путей внутри нервной клетки. Исследования выявили биохимические маркеры, соответствующие каждой из болезней (табл. 1) [3].
| Болезнь | Биохимические маркеры болезни |
|---|---|
| Болезнь Альцгеймера | Aβ1—42 пептид в плазме и цереброспинальной жидкости (ЦСЖ) Тау-белок в ЦСЖ Фосфорилированный тау-белок |
| Болезнь Паркинсона | Снижение уровня дофаминового транспортёра (DAT) Тельца Леви |
| Боковой амиотрофический склероз | Цитокины Глутатион 8-гидрокси-2’-деоксигуанозин Супероксиддисмутаза-1 Метаботропный рецептор к глутамату 2-го типа |
| Болезнь Гентингтона | Гормоны роста Цитокины Глутатион 8-гидрокси-2’-деоксигуанозин Супероксиддисмутаза-1 Метаботропный рецептор к глутамату 2-го типа |
Углубленный анализ метаболических изменений в нервных клетках определил, что в патологии каждого нейродегенеративного заболевания в той или иной степени задействованы митохондрии. Митохондрии — это органеллы, которые, несмотря на свой небольшой размер, являются активными участниками ключевых биохимических процессов, протекающих в клетках [1]. Основная функция митохондрий заключается в поддержании энергетического баланса клеток. Эти органеллы поддерживают окислительно-восстановительный баланс клетки и регулируют гомеостаз кальция. С работой митохондрий напрямую связаны процессы запрограммированной и не запрограммированной клеточной смерти.
Обсуждая вопрос энергетического обеспечения, надо вспомнить, что мозг потребляет до 20% всей энергии, вырабатываемой в организме. И если энергетическая функция митохондрий будет нарушена, это быстро скажется на работе центральной нервной системы. Важности митохондриям добавляет то, что нейроны в сравнении с другими типами клеток обладают меньшей способностью самостоятельно получать энергию за счет гликолиза. Получается, изменения в работе митохондрий приведут к тому, что нейрон перестает полноценно выполнять свои функции.
Правила движения митохондрий
Митохондриальная дисфункция при нейродегенеративных заболеваниях хорошо изучена [4]. Одной из ее причин может быть изменение нормальной динамики этих органелл. В нервной клетке с митохондриями постоянно что-то происходит [5]. Они:
Чтобы наглядно представить себе эти процессы, сравним митохондрию с комочком теста на столе при приготовлении пирожков. Если комочек большой, то из него можно сделать два комочка поменьше. Если теста мало, то можно взять другой комочек и слепить их вместе. Когда теста в комке достаточно, он отправляется туда, куда нужно — в угол доски, где его ждет дальнейшее включение в пекарский «метаболизм».
Изменение числа и положения митохондрий в клетке помогает нейрону адаптироваться к изменению функций. Транспорт митохондрий в аксон является реакцией на повышение потребности в энергии. Число митохондрий также меняется в ответ на изменение условий. Если нужно меньше энергии, число митохондрий снижается, а вслед за этим снижается и энергопродукция клетки.
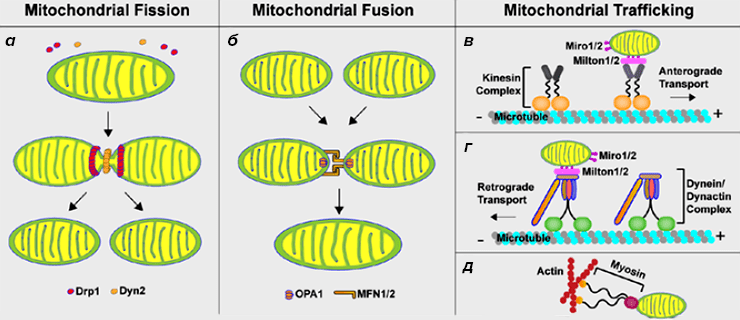
Нарушение динамики митохондрий изменяет их функциональное состояние и приводит к нарушениям в работе нервной клетки (рис. 1).
Рисунок 1. Динамика митохондрий в клетках животных. Митохондрии в нейронах могут разделяться (а) и сливаться (б). Кроме этого, в соответствии с энергетическими потребностями клетки митохондрии могут перемещаться в область аксона и покидать ее (в—д).
Нарушение динамики митохондрий при нейродегенеративных заболеваниях
Мутации в генах, которые кодируют факторы разделения, и дефицит самих факторов приведут к избыточному слиянию митохондрий. При дефектах в белках, ответственных за слияние митохондрий, мы будем наблюдать их избыточную фрагментацию. Нарушение слияния митохондрий в конечном счете может привести к мутациям в митохондриальной ДНК и появлению органелл с измененной функцией. Прежде всего, это касается процессов окислительного фосфорилирования.
Нарушения в динамике митохондрий при отдельных нейродегенеративных заболеваниях:
Все изменения в функции митохондрий нельзя объяснить исключительно нарушениями их динамики. Первичные метаболические нарушения при нейродегенеративных заболеваниях (см. табл. 1) могут вмешаться в работу митохондрий и сами по себе.
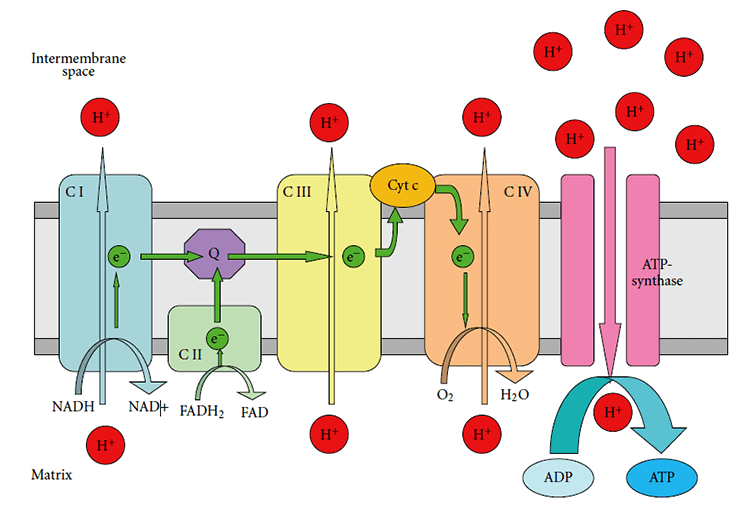
Ключевой «цех» митохондрий, который активно производит АТФ — это дыхательная цепь переноса электронов (рис. 2). Она состоит из четырех комплексов, расположенных на внутренней мембране митохондрии [17].
Рисунок 2. Строение дыхательной цепи в митохондриях. C I — комплекс I (NADH-дегидрогеназный комплекс); C II — комплекс II (сукцинатдегидрогеназа); C III — комплекс III (цитохром-bc1-комплекс); C IV — комплекс IV (цитохром-с-оксидаза); Cyt C — цитохром C.
При нейродегенеративных заболеваниях нарушения распространяются не на всю дыхательную цепь, а на отдельные ее элементы, снижая эффективность их работы [18]:
Итогом сбоя в одном элементе становится нарушение работы всей цепи.
Заглянуть внутрь батарейки
В настоящее время существует множество способов, которые позволяют оценить работу митохондрий [19]. Все их можно условно поделить на три группы: изучение изолированных митохондрий, изучение митохондрий в целых клетках и изучение синаптосом.
Изучение изолированных митохондрий
Этот метод позволяет прицельно изучить саму органеллу, но при этом мы не можем полностью оценить воздействие цитозольных факторов на функцию митохондрий. Как правило, выделение митохондрий проводят центрифугированием при низких температурах (0–2 градуса по Цельсию) [20]. Функцию митохондрий оценивают по их способности поглощать кислород, по соотношению окисленных и восстановленных метаболитов. Также отдельно можно изучить активность ферментов дыхательной цепи и синтез АТФ в митохондриях. Эти данные дают подробное представление о том, какие метаболические процессы нарушены внутри органелл, и указывают на возможные пути коррекции нарушений функции митохондрий.
Изучение митохондрий в целых клетках
Здесь трудность кроется в том, что часть веществ, необходимых для оценки работы митохондрий, не проникает через мембрану клетки. Частично это ограничение может быть снято при помощи увеличения проницаемости клеточной мембраны, но это повышает риск повреждения клетки. Для оценки митохондриальной функции у живых клеток измеряют концентрацию и парциальное давление кислорода в ткани или культуре клеток, скорость его потребления.
Изучение синаптосом
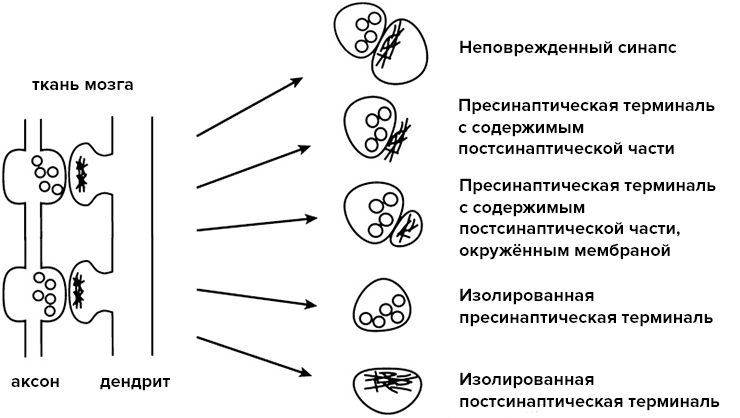
В каком-то смысле синаптосома занимает промежуточное положение между целой клеткой и отдельной митохондрией. Выделение синаптосом происходит из гомогенизированной ткани мозга, и она представляет собой изолированный участок аксона нервной клетки с пресинаптическим участком. Синаптосома содержит в себе везикулы с нейромедиатором и митохондрии. Также целой остается пресинаптическая мембрана с комплексом ионных каналов и рецепторов. Активная часть постсинаптической мембраны тоже может попасть при выделении в состав синаптосомы (рис. 3).
Рисунок 3. Варианты синаптосом, которые могут быть получены в ходе их выделения.
Синаптосома — это удобный объект для изучения синаптических нарушений при нейродегенеративных заболеваниях. Изучение синаптосом не заменяет другие методы, но дополняет их и уточняет полученные ими данные. Синаптосома — уникальный объект для изучения клеточной функции нейронов и позволяет отдельно оценить роль митохондрий в поддержании работы синапса: при исследовании синаптосом можно оценить концентрацию метаболитов, связанных с активностью митохондрий.
Исследование синаптосом при заболеваниях нервной системы началось в конце 70-х годов XX века [21]. В 1980-х гг. при изучении синаптосом у пациентов с болезнью Альцгеймера был обнаружен дефицит ацетилхолиновой [22], глутаматергической [23] и ГАМК-ергической [24] трансмиссий (передач сигнала). Исследование болезни Альцгеймера оказалось подходящим для разработки основных подходов в изучении синаптосом. Во-первых, количество пациентов, страдающих этим расстройством, велико, что позволяет собрать большое количество материала для исследования. Во-вторых, прогрессирование расстройства в бóльшей степени связывают с нарастающим снижением количества синапсов в мозге [25].
Однако анализ синаптосом может помочь не только в изучении болезни Альцгеймера. При помощи этого метода обнаружили, что мутантный белок HTT при болезни Гентингтона подавляет транспорт митохондрий [26]. Изучение синаптосом приложимо и в случае деменции с тельцами Леви [27].
Все три традиционных метода диагностики метаболической функции митохондрий дают много полезной информации, но при этом обладают рядом недостатков:
Эти сложности подтолкнули индустрию к поискам новых решений.
Тест-драйв митохондрий
Одним из самых перспективных методов для исследования митохондриальной функции является их изучение анализатором внеклеточных потоков (extracellular flux, XF). Такой прибор позволяет оценить показатели митохондриального дыхания и гликолиза в отдельных митохондриях, в синаптосомах и в целых клетках с применением пермеабилизующих (повышающих проницаемость мембраны) реагентов.
Оценка митохондриального дыхания методом XF
Оценку проводят по четырем параметрам:
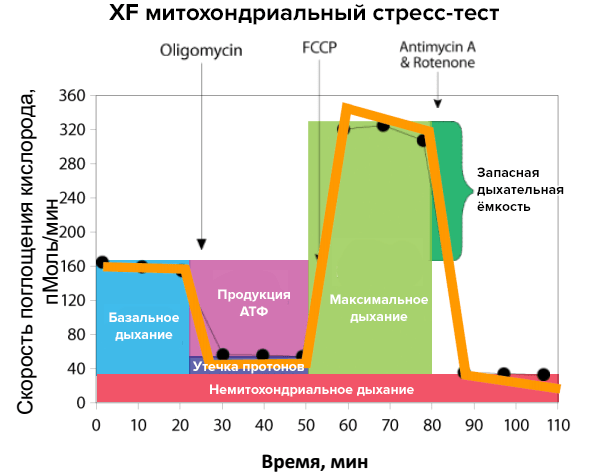
Митохондриальное дыхание оценивается по скорости поглощения кислорода (oxygen consumption rate, OCR). Существует представление о стрессовом профиле митохондриального дыхания (рис. 4). Для его формирования в исследуемые образцы поэтапно добавляют вещества-разобщители дыхательной цепи, или митохондриальные ингибиторы (см. врезку). При нормальном функционировании митохондрий они выявят метаболические резервы органелл. Например, добавление ротенона и антимицина нарушает работу комплексов I и III соответственно, заставляя работать другие элементы цепи в полную силу. В этом и есть исследовательская ценность метода XF: мы можем точно узнать, в какой части дыхательной цепи случилась «поломка», проверяя на прочность каждый из участков. Если же ингибиторы дыхания добавлять к образцам, где есть митохондрии, затронутые патологическим процессом, это позволит выявить «слабые» места метаболических реакций. Без дополнительной стимуляции эти нарушения трудно обнаружить, но стресс-тест для митохондрий выявит его. Получаемый при исследованиях тестовых культур профиль сравнивают со стандартным, чтобы получить данные о дефектах клеточного дыхания.
Рисунок 4. Исследование митохондриального дыхания. На рисунке представлен стандартный стрессовый профиль реакции при изучении митохондриального дыхания, которая контролируется по скорости поглощения кислорода. Добавление различных разобщителей дыхательной цепи и метаболически активных веществ в течение опыта позволяет оценить параметры митохондриального дыхания. Желтая линия показывает изменения скорости поглощения кислорода при разных условиях, а цветные столбики являются производными от этих изменений.
Например, добавление карбонилцианид-4-(трифлуорометокси)фенилгидразона (FCCP) нарушает синтез АТФ. За счет «контрабанды» протонов мимо АТФ-синтазы из межмебранного пространства в матрикс электрохимический потенциал исчезает, и синтез АТФ постепенно снижается до нуля. Это разрывает процесс окислительного фосфорилирования, «заставляя» митохондрии работать на полную мощность. Они вынуждены «выталкивать» избыток протонов в межмембранное пространство, что приводит к увеличению потребления кислорода до максимума. Олигомицин нарушает фосфорилирование АДФ и его введение в образец снижает синтез АТФ. На рисунке это отражается как уменьшение скорости поглощения кислорода митохондриями. Запасная дыхательная емкость рассчитывается как разница между максимальным и базальным дыханиями.
рисунок предоставлен компанией «Биохиммак»
Митохондриальные ингибиторы, применяемые в стресс-тестах
Например, при добавлении в исследуемые образцы синаптосом нейронов ингибиторов комплексов I и II (ротенона и 3-нитропропионовой кислоты соответственно) отмечали резкое снижение показателей максимального дыхания, что моделировало болезни Паркинсона и Гентингтона [28]. Следовательно, нарушения в работе этих комплексов являются важным компонентом в развитии указанных нейродегенеративных заболеваний.
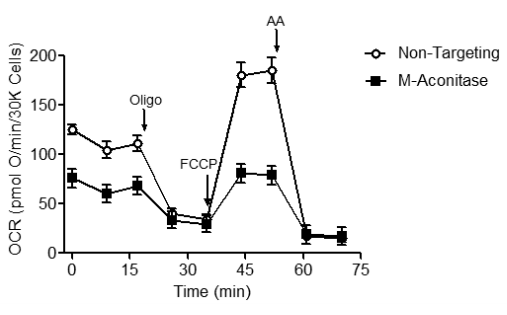
Также митохондриальную функцию можно оценивать и у целых клеток. Для создания модели болезни Паркинсона у модельных клеток подавляли продукцию митохондриальной аконитазы (m-аконитазы) [29]. Mитохондриальная аконитаза участвует в цикле Кребса, превращая цитрат в изоцитрат. Кроме этого она ответственна за поставку электронов (в виде NADH) для дыхательной цепи. Снижение функции m-аконитазы приводит к дефициту электронов. Как следствие, кислород не переходит в связанное состояние в комплексе IV, и его потребление снижается. При сравнении двух дыхательных профилей (рис. 5) становится очевидно, что у модельных клеток снижено базальное дыхание (часть графика до добавления олигомицина) и респираторная емкость (часть графика между добавлением FCCP и антимицина А (AA).
Рисунок 5. Тестовое определение базального дыхания и дыхательной емкости у контрольной группы клеток в сравнении с модельными клетками при болезни Паркинсона (пояснения в тексте).
Если мы возьмем клетки реальных пациентов с болезнью Паркинсона, проведем их исследование с добавлением тех же реактивов в том же порядке и получим такие же результаты, то сможем сказать, что нарушения в работе этих нейронов, возможно, связаны с дисфункцией m-аконитазы. Здесь у нас открывается возможность для тестирования препаратов: мы можем исследовать образцы нейронов с потенциальными препаратами, добавляя к ним олигомицин, FCCP и антимицин A. Потенциально успешные препараты будут демонстрировать эффект в виде приближения кривой к нормальным показателям.
Такие эксперименты уже проводят. Например, метод XF позволил оценить нейропротекторный эффект меклизина при его использовании на клеточных моделях болезни Гентингтона [30]. Меклизин относится к противорвотным препаратам с антигистаминовой и антихолинергической активностью. Добавление меклизина к клеточным культурам с мутантным белком, отвечающим за развитие болезни Гентингтона, увеличило выживаемость клеток. При этом эффект реализовывался именно за счет нормализации процессов клеточного дыхания: меклизин может уменьшать образование эндогенных окисленных продуктов [31] и препятствовать высвобождению цитохрома C из митохондрий [32].
Оценка гликолиза методом XF
Кроме оценки митохондриального дыхания, методом XF можно оценить различные показатели гликолиза (рис. 6):
Ситуация здесь схожа с той, что обсуждалась при изучении митохондриального дыхания. Гликолитическую активность митохондрий оценивают по скорости внеклеточного закисления (extracellular acidification rate, ECAR).
Рисунок 6. Исследование показателей гликолиза (стандартный стрессовый профиль реакции). Гликолиз косвенно оценивают по изменению pH среды. Добавление метаболически активных веществ, как и в случае с митохондриальным дыханием, позволяет изменять интенсивность процесса гликолиза, что и фиксируют при исследовании. Черная кривая с точками демонстрирует эти изменения, а цветные столбики являются производными от них. Добавление к исследуемым образцам 2-дезокси-D-глюкозы (2-DG) подавляет гликолитическую активность, в то время как раствор глюкозы и олигомицин значительно усиливают ее.
рисунок предоставлен компанией «Биохиммак»
Добавление различных субстратов проверяет на прочность метаболическую активность митохондрий, выявляя уязвимые места. Где тонко, там и рвется — метод XF ищет «тонкие» места в метаболизме митохондрий, потенциально указывая на то, что они могут быть усилены при помощи лекарств. Допустим, мы нашли, что при определенной патологии поражается комплекс III дыхательной цепи. Значит, поиск лекарства будет связан с выбором вещества, которое усиливает активность этого компонента и приводит к повышению выживаемости клеток, как это было показано выше в примере с миклезином и болезнью Гентингтона.
Инструмент для мастера
Качественное исследование в молекулярной биологии требует современного оборудования. Метод XF, изобретенный в 2006 году, используется в анализаторах компании Seahorse Bioscience (a part of Agilent Technologies, США). Оборудованием для анализа клеточного метаболизма, которое производит эта компания, пользуются ведущие мировые лаборатории. Счет исследованиям, при проведении которых использовали эти анализаторы, идет на сотни. В анализаторах Seahorse можно изучать параметры гликолиза и клеточного дыхания в 3D-культурах клеток, отдельных клетках, митохондриях и синаптосомах. Кроме того, для анализа могут быть использованы целые инсулярные островки поджелудочной железы.
Процедура исследования автоматизирована: необходимо только поместить изучаемые образцы в специальную планшетку и заполнить отделение для реагентов. Анализ метаболических показателей проводится благодаря твердофазным оптическим сенсорам, которые не повреждают клеточную культуру, и она может быть использована повторно в экспериментах. Те части прибора, которые контактируют с исследуемыми образцами, являются одноразовыми и не требуют отмывки. На саму процедуру анализа прибором уходят минуты, но получаемая информация обладает высокой точностью. Колебания давления кислорода оцениваются с чувствительностью в 0,67 mmHg (миллиметров ртутного столба); также прибор фиксирует изменение содержания ионов водорода на уровне пикомолей. При этом аппарат способен одновременно оценить клеточное дыхание и обмен глюкозы. Клеточное дыхание измеряется по уровню потребления кислорода, а обмен глюкозы — по уровню продукции протонов водорода в изучаемых образцах. Двух этих параметров достаточно, чтобы полноценно оценить метаболическую функцию клетки и ее нарушения.
Благодаря системе автоматических инъекционных портов в ходе измерений может быть добавлено до четырех веществ, влияющих на метаболизм — ингибиторы клеточного дыхания, различные токсины и цитопротекторы. Учитывая то, что в одном планшете одновременно можно тестировать до 96 образцов, исследовательские возможности прибора становятся просто колоссальными. О производительности и качестве приборов говорит и то, что их использовали в Национальной программе США по исследованию токсических веществ, где анализу подвергли более 1300 химических соединений [33].
Если говорить о компонентах для анализа, то готовые реагенты поставляет сама компания Seahorse, в том числе и реагенты для контроля состояния приборов. Расход реагентов при процедуре анализа методом XF ниже, чем при традиционных методах. Это достигается за счет того, что клеток для работы требуется в 10–20 раз меньше.
Если сравнивать XF-анализаторы митохондриального метаболизма с приборами на основе других методов, то можно отметить ряд несомненных преимуществ. Одним из способов измерения концентрации кислорода при исследовании митохондрий является использование электродов Кларка или автоматизированной аппаратуры на их основе — оксиграфов. Главный их недостаток — необходимость большого количества материала для исследования, что исключает изучение синаптосом. Масс-спектрометрия и газовая хроматография дóроги и требуют длительной подготовки анализируемого материала. Это усложняет их применение на практике. Еще одно преимущество XF-анализиторов — это способность одновременно измерять динамику pH и концентрацию кислорода в пробах, что дает исследователю комплексное представление о метаболизме глюкозы и митохондриальном дыхании.
Заключение
Как показывает множество исследований, при нейродегенеративных заболеваниях происходит значительное нарушение функции митохондрий. Может нарушаться их движение внутри нейрона, а также процессы их слияния и разделения. Такие изменения приводят к нарушению метаболических процессов, протекающих внутри этих органелл: клеточного дыхания и гликолиза. Их можно косвенно оценить по колебаниям концентрации кислорода и pH. В этом поможет высокоточный и надежный метод анализа внеклеточных потоков — XF (extracellular flow). Он позволяет изучать как живые клетки, так и отдельные митохондрии и синаптосомы. Исследование метаболической активности митохондрий дает информацию, которая позволяет не только пролить свет на патогенез заболевания, но и выяснить, какие лекарственные средства будут эффективны для их лечения.
ЗАО «БиоХимМак» — спонсор спецпроекта по биоэнергетике
Отдел молекулярной диагностики (Life Science MDx) «БиоХимМак» предлагает высокотехнологичные инструменты для решения научных и диагностических задач в областях молекулярной и клеточной биологии, генетики и биотехнологии. В сферу наших интересов входят:
Наши сотрудники оказывают помощь
Мы осуществляем
Мы работаем
Анализаторы Seahorse (Agilent Technologies, США)
Seahorse — один из самых передовых исследовательских инструментов, «золотой стандарт» в изучении клеточного метаболизма:
Материал предоставлен партнёром — компанией «БиоХимМак»