Мезоректальная фасция интактна что это значит
Пресс-центр
Роль магнитно-резонансной томографии в оценке местной распространенности рака прямой кишки
Балясникова С.С., Сураева Ю.Э., Долгушин Б.И., Барсуков Ю.А, Мамедли З.З., Полыновский А.В., Кузьмичев Д.В.
ФГБУ «РОНЦ им.Н.Н. Блохина», РАМН, г. Москва (директор – академик РАМН и РАН, профессор М.И. Давыдов
ВВЕДЕНИЕ
Совершенствование хирургической техники и современные данные о результатах лечения рака прямой кишки (MERCURY Study Group) диктуют необходимость персонализированного подхода в назначении неоадьювантной химиолучевой терапии с учетом критериев риска рецидивирования рака в зависимости от местного распространения опухоли. В связи с этим, роль специалистов лучевой диагностики в планировании предстоящего лечения и оценки его эффективности стала критически значимой. Информация, получаемая при интерпретации изображений (с высоким разрешением) органов малого таза, дает детализированное представление о местной распространенности опухолевого процесса, что позволяет более грамотно определять тактику лечения больных и улучшать, тем самым, отдаленные результаты.
Магнитно-резонансная томография (МРТ) на сегодня является методом выбора для оценки местной распространённости рака прямой кишки 4. Обладая высоким мягкотканным контрастом, МРТ дает возможность визуализировать эндофитное и экстрамуральное распространение опухоли, в частности, определять нарушение зональной структуры кишечной стенки, распространение опухоли в мезоректальную клетчатку и вовлечение в опухолевой процесс мезоректальной фасции, а также органов малого таза, костных и мышечных структур; изменения в лимфатических узлах (ЛУ), расположенных как экстрафасциально так и в параректальной клетчатке.
Было доказано, что использование контрастных препаратов, как внутривенных, так и трансректальных, не улучшает диагностическую точность 7. Введение внутривенных МР-контрастных препаратов не дает клинически значимой дополнительной информации. Для опухолей прямой кишки характерно интенсивное накопление контрастного препарата (за исключением муцинозных опухолей – где кистозный компонент преобладает над солидным). Однако, столь же интенсивное накопление контрастного препарата может наблюдаться в отечной окружающей клетчатке при развитии десмопластической реакции (состояния, при котором отмечается разрастание соединительной ткани без элементов опухолевого роста) и неправильная интерпретация результатов в этом случае, будет приводит к завышению стадии экстрамуральной распространенности [4, 11-13]. По данным работ ряда авторов, динамическое МР-контрастирование может быть использовано в качестве метода, позволяющего оценить эффективность предстоящего неоадъювантного лечения. Получаемые в ходе этого вида исследования данные (такие показатели, как степень и интенсивность накопления контрастного препарата) отображают ангиогенез опухоли, ключевой фактор опухолевого роста и диссеминации, и дают возможность рассчитывать эффективность использования препаратов ингибиторов ангиогенеза в будущем [14].
В начале своей работы некоторым больным (у которых отсутствовали противопоказания) мы выполняли исследования с трансректальным введением ультразвукового геля. Следует отметить, что растяжение кишечной стенки при введении геля трансректально позволяло легко определять внутрипростветное распространение опухоли, но не увеличило точность оценки внутристеночной или трансмуральной глубины инвазии. Наоборот, перерастяжение кишечной стенки приводило к сокращению истинного пространства мезоректальной клетчатки и не позволяло определять фактическое расстояние от латерального края опухоли до мезоректальной фасции 12.
В исследовании MERCURY было доказано, что на Т2-изображениях можно визуализировать глубину инвазии мезоректальной клетчатки с точностью до 0,5 мм [15]. Но, несмотря на столь высокие показатели, стандартные режимы МРТ имеют свои диагностические ограничения в определении изменений лимфатических узлов, оценке эффективности проводимой терапии и диагностике локорегионарных рецидивов 17. В литературе существует ряд работ, оправдывающих использование диффузионно-взвешенного режима с целью улучшения диагностических возможностей МРТ в оценке местной распространенности рака прямой кишки и его рецидивов.
Давно известный в нейрорадиологии, но сравнительно недавно применяемый в онкодиагностике метод диффузионно-взвешенной МРТ (ДВ-МРТ) позволяет быстро и более точно проводить первичное стадирование опухолей и оценивать эффективность предоперационного лечения [11, 15-17].
Методика ДВ-МРТ основана на оценке степени подвижности молекул воды в исследуемых тканях. Неопластический процесс приводит к увеличению количества клеток и соответствующему уменьшению межклеточных пространств, что отображается на ДВ-изображениях с высоким b-value, в виде зон гиперинтенсивного сигнала в участках самой опухоли и пораженных Л/У. С физической точки зрения в диффузионно-взвешенном режиме изображения получают, благодаря применению двух равных по силе и длительности диффузионных градиентов, используемых перед (дефазирующий градиент) и после (рефазирующий градиент) 180 ° радиочастотного импульса в последовательности spin-echo T2. Таким образом, если молекулы воды в той или иной мере статичны, то действие на них дефазирующего градиента будет минимизировано за счет применения рефазирующего градиента, и такие молекулы будут иметь яркий сигнал на изображениях. И наоборот, если молекулы воды подвижны, то на них не сможет подействовать рефазирующий градиент, направленный в ту же точку пространства, что и дефазирующий и, следовательно, такие молекулы не будут в фазе, и это приведет к снижению сигнала на Т2-изображениях.
В-фактор (b value) отображает силу, продолжительность и время между используемыми диффузионными градиентами. В большинстве онкологических протоколов используются 2 и более b-факторов, один низкий b-value, равный 0 с/мм2, один – средний, порядка 50/100 с/мм2, и один или несколько высоких b-value 500/800/1000 с/мм2, в зависимости от зоны исследования. В процессе постобработки “сырых” данных возможно получение карт истинного коэффициента диффузии (ИКД (ADC) карт), на которых могут быть посчитаны значения ADC (apparent diffusion coefficient).
С целью определения роли магнитно-резонансной томографии в оценке местной распространенности рака прямой кишки были изучены результаты МР исследований, проведенных 110 пациентам (60 мужчин, 50 женщин), получавшим лечение в хирургическом отделении колопроктологии ФГБУ РОНЦ им Н.Н. Блохина, с 2011 по 2014 гг. Восемнадцать больных (19,8%) не получали неоадъюватной терапии, а только хирургическое лечение, и поэтому МР исследование им было проведено один раз с целью__местного стадирования опухоли. Остальным 92 больным (80,2%) исследование проводилось дважды: с целью первичного стадирования опухоли и повторно, для оценки эффективности проводимого лечения.
Рисунок 1. T2 cor. Красными линиями обозначено поле исследования и угол наклона сагиттальных срезов
Методика лапароскопической тотальной мезоректумэктомии
Знание нормальной и топографической анатомии органов брюшной полости и таза является принципиальным условием выполнения сложных лапароскопических вмешательств, к каковым, безусловно, относятся операции на толстой кишке.
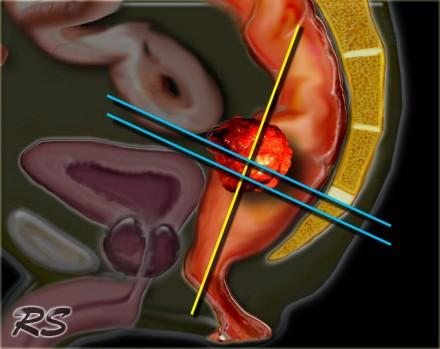
Кровоснабжение прямой кишки подробно указано на рис.1. Верхняя прямокишечная артерия является непосредственным продолжением нижней брыжеечной артерии, направляется в ретроректальное пространство полости малого таза, разветвляясь позади прямой кишки и в ее стенках. Артерия кровоснабжает верхние отделы прямой кишки, ее ветви анастомозируют между собой и с ветвями средней и нижней прямокишечной (геморроидальной) артерии.
Средние прямокишечные артерии с обеих сторон с одноименными венами подходят к боковым стенкам прямой кишки в толще боковых связок прямой кишки. Они чаще отходят от подчревной артерии, реже – от внутренней срамной артерии.
Рис.1. Артериальное кровоснабжение прямой кишки
Рис. 2 Лимфоотток от прямой кишки.
Рис.3. Симпатическая нервная система таза.
Рис.4. Топография фасций прямой кишки (полусхематично).
Рис. 5.1. Расположение хирургов во время операции ТМЭ
Рис. 5.2. Расположение операционной бригады во время операции ТМЭ
Рис.6. Выделение прямой кишки по задней полуокружности.
Рис. 7. Пересечение прямой кишки аппаратом ENDO-GIA-60.
Рис.8. Формирование анастомоза.
Рис. 9. Границы резекции кишки.
Рис.10. Границы лапароскопической аорто-подвздошной лимфаденэктомии.
Венозная кровь от прямой кишки до участка над аноректальной линией оттекает в систему воротной вены, а дистальнее этого участка – в систему нижней полой вены. В прямой кишке различают три основных венозных сплетения: верхнее, средне и нижнее.
Венозный путь, по данным многих авторов, является основным в диссеминации раковых клеток. Поэтому рекомендуется начинать операцию с лигирования основного венозного, а не артериального ствола. С этой точки зрения весьма важным является рассмотрение различных вариантов архитектоники вен. Основные венозные стволы толстой кишки весьма изменчивы в своем строении. Наиболее отличающиеся друг от друга формы могут иметь или сетевидное строение, или характеризоваться разобщенным ходом вен.
Лимфатическая система толстой кишки включает в себя лимфоорганные лимфатические сети и выносящие лимфатические сосуды.
Отток лимфы от прямой кишки осуществляется следующим образом (рис.2). Экстрамуральные лимфатические сосуды подразделяются на три группы. Первая (верхняя) группа представлена лимфатическими узлами, расположенными у бифуркации верхней прямокишечной артерии (восходящий путь лимфооттока). Боковые лимфатические сосуды отводят лимфу от среднеампулярного отдела прямой кишки (латеральный путь лимфооттока). Расположенные на уровне крестцового мыса лимфатические сосуды и узлы являются своеобразным коллектором, куда устремляется лимфа из зоны средней прямокишечной и боковых крестцовых артерий и др. По третьей (нижней) группе лимфатических сосудов осуществляется лимфоотток от нижнеампулярного отдела прямой кишки и анального канала в паховые узлы (нисходящий путь лимфооттока). Кроме того, существующее множество анастомозов между лимфатическими сосудами прямой кишки способствует ретроградному оттоку лимфы.
Вегетативная нервная система прямой кишки представлена симпатической и парасимпатической нервными системами. Симпатические нервные волокна начинаются от центральных корешков 11 и 12 грудных и 1-3 поясничных сегментов спинного мозга. При выходе из спинного мозга они образуют поясничные внутренностные нервы, которые, соединяясь над аортой, формируют верхнее гипогастральное сплетение (рис.3). Следуя вдоль верхней прямокишечной артерии в малый таз, верхнее гипогастральное сплетение делится на 2 части, которые, достигая тазового сплетения на латеральной стенке таза, формируют нижнее гипогастральное сплетение.
Парасимпатическая иннервация прямой кишки осуществляется ветвями блуждающего нерва, а также нервными волокнами, начинающимися из вентральных корешков 2, 3 и 4 крестцовых сегментов. Они входят в полость таза через крестцовые отверстия кзади от париетальной фасции и направляются вниз и латерально к тазовому сплетению. Таким образом, тазовое сплетение представляет собой переплетение симпатических и парасимпатических нервных волокон. Понятие тазового сплетения тесно связано с понятием боковой связки прямой кишки с проходящими в ней средними прямокишечными артериями. В последнее время рядом японских исследователей показано, что боковая связка прямой кишки представляет собой не что иное, как тазовое нервное сплетение с проходящей в ней средней прямокишечной артерией. Радикальность оперативного вмешательства при раке нижнеампулярного отдела прямой кишки требует неизбежного пересечения указанных нервных структур. Следует отметить, что гипогастральное нервное сплетение редко бывает представлено только одним тяжем, поэтому одностороннее его пересечение редко сопровождается тазовыми расстройствами. Иногда радикальность вмешательства требует двустороннего пересечения симпатических и парасимпатических волокон, которое почти сопровождается урогенитальными расстройствами (нарушение мочеиспускания, аменоррея у женщин и отсутствие эякуляции у мужчин).
Фасции таза
Висцеральная фасция (собственная фасция) таза (рис.4), окружает прямую кишку со всех сторон, переходя внизу в париетальную фасцию таза, представляя собой заполненный жировой тканью рукав, что, с одной стороны, обеспечивает прямой кишке необходимую подвижность, а с другой – выполняет роль фиксирующего аппарата. Было отмечено, что с передней стороны собственная фасция плотно сращена с брюшинно-промежностным апоневрозом (фасция Денонвилье). Было показано, что этот футляр отграничивает сосудистую и отчасти лимфатическую системы прямой кишки от париетальных сосудов таза, вследствие чего раковая опухоль сравнительно редко распространяется за пределы собственной фасции прямой кишки.
Данные анатомические исследования были положены в основу хирургической техники лечения рака прямой кишки под названием тотальная мезоректумэктомия.
В 1982 г. английский хирург Richard John Heald впервые опубликовал в журнале British Journal of Surgery описание техники тотальной мезоректальной эксцизии (ТМЭ) при хирургическом лечении больных раком прямой кишки. Основу концепции техники ТМЭ составляло острое выделение прямой кишки под контролем зрения в бессосудистой зоне между висцеральной фасцией (собственной фасцией) прямой кишки и париетальной фасцией таза в, так называемом, священном слое («holy plane» по R.J. Heald). Именно в клетчатке, заключенной в собственную фасцию (мезоректум) расположены лимфатические узлы, большая часть из которых, как правило, имеют метастазы опухоли. При использовании традиционного способа выделения прямой кишки (прием «лодочка») часть этой жировой клетчатки отрывается и остается в малом тазу, что, в большинстве случаев, приводит к возникновению, так называемых «сателлит-метастазов», частота которых может достигать 25%.
В 1998 г., в журнале Archives of Surgery в статье-отчете об опыте применения ТМЭ за период 1978-1997 гг. профессор R.J. Heald представил фантастические результаты применения тотальной мезоректумэктомии (ТМЭ) при раке прямой кишки. У 405 пациентов, которым выполнены «curative» (радикальные) резекции местный рецидив развился через 5 лет у 3%, а через 10 лет у 4%. При этом 5-летняя безрицидивная выживаемость была 80%, а 10-летняя 78%.
В последующем высокую эффективность тотальной мезоректумэктомии в сравнении с традиционной хирургией прямой кишки, убедительно продемонстрировали два известных исследованиях: Swedish Rectal Cancer trial и Dutch Rectal Cancer TME Trial. Так, местный рецидив в 5-летний период при применении только традиционной хирургии развились у 27% пациентов при 5-летней выживаемости – 48%, тогда как после применения только хирургии с техникой ТМЭ частота местных рецидивов составила 11%, а 5-летней выживаемость 64%. Кроме того, эти исследования также продемонстрировали, что применение предоперационной лучевой терапии достоверно снижает частоту местного рецидивирования.
Прошло почти 30 лет с момента первого упоминания о ТМЭ. Тем не менее «слепое» выделение прямой кишки с помощью руки до сих пор остается в арсенале многих практикующих хирургов, а аргументами в его защиту служат простота и быстрота исполнения. При этом платой за такой выбор служит высокая частота местных рецидивов. Мы неоднократно на своих мастер-классах говорим об этом и учим хирургов правильной хирургической технике, позволяющей снизить количество локальных рецидивов с 45 до 5 %.
Лапароскопическая техника тотальной мезоректумэктомии в лечении рака прямой кишки
Пациент укладывается на спину с приподнятыми и разведенными ногами в положении Тренделенбурга.
Введение троакаров
Для выполнения лапароскопической резекции прямой кишки обычно используется 4-5 троакаров (рис.5):
Хирургическая техника ТМЭ
Основные этапы удаления прямой кишки с применением техники ТМЭ:
1) высокая перевязка нижнебрыжеечных сосудов;
2) отсепаровка нижнебрыжеечных сосудов от преаортального верхнего гипогастрального сплетения;
3) межфасциальная острая (с помощью ультразвуковых ножниц или энергетической платформы Force Triad) препаровка в корректном слое («holy plane» по H.J. Heald) в дистальном направлении до тазового дна и до полного отслоения от пресакральной фасции, окутанного фасцией Waldeyer, мезоректума (Рис.6);
4) острое выделение (с помощью ультразвуковых ножниц или энергетической платформы Force Triad) боковых поверхностей мезоректум;
5) острое выделение (с помощью ультразвуковых ножниц или энергетической платформы Force Triad) вентральной поверхности прямой кишки путем рассечения переходной складки брюшины с последующей отсепаровкой от семенных пузырьков или влагалища;
6) выделение прямой кишки с мезоректумом во всех плоскостях под визуальным контролем целостности мезоректальной фасции и сохранности нижних гипогастральных (правого и левого) и сакральных (справа и слева) нервов, формирующих в совокупности тазовое сплетение;
7) если операция заканчивается формированием анастомоза, то в дистальном отделе прямой кишки, состоящем исключительно из слизистого, подслизистого и мышечного слоев, наложение специального зажима (изоляция новообразования) с обязательным промыванием дистального отдела прямой кишки 0,02% раствором хлоргексидина;
8) наложение линейного степлера ENDO-GIA-60 дистальнее пережатого участка кишки с пересечением прямой кишки между ними (рис.7);
9) в левой подвздошной области (в области троакара) послойно рассекается брюшная стенка, в рану выводится петля приводящей кишки в зоне проксимального края резекции и выделяется необходимый для наложения анастомоза участок кишки. В этом месте кишка пересекается между двумя зажимами, удаляется резецированный препарат в пластиковом контейнере. На проксимальный конец кишки накладывается кисетный шов, который затягивается после введения в просвет кишки головки циркулярного степлера, далее кишка погружается в брюшную полость и брюшная стенка ушивается;
10) после обработки культи прямой кишки раствором антисептика, трансанально вводится базовая часть циркулярного степлера, острой частью перфорируется культя в средней части шва, наложенного аппаратом ENDO-GIA-60. Затем головка аппарата вставляется в базовую часть, выполняется прошивание и извлечение аппарата (рис.8).
11) по показаниям формирование превентивной илео- или трансверзостомы;
12) если пациенту выполняется брюшно-промежностная экстирпация прямой кишки, то промежностный этап выполняется второй хирургической бригадой.
Границы резекции при ТМЭ и экстирпации прямой кишки схематически представлены на рисунке (Рис.9).
Если имеется местно распространенная опухоль или относительно небольшая карцинома, прорастающая висцеральную фасцию, то мобилизацию следует проводить за пределами париетальной фасции. С целью сохранения вегетативной нервной системы, такую расширенную мезоректумэктомию проводят в 2 этапа: сначала выполняется резекция прямой кишки в пределах висцеральной (собственной) фасции, а уже затем удаляется клетчатка совместно с париетальной фасцией. Для этого после лигирования верхней брыжеечной артерии необходимо идентифицировать симпатический n. hypogastricus примерно в 2 см медиальнее левого мочеточника. Билатерально сохраняя гипогастральный нерв, выполняется аорто-подвздошная лимфаденэктомия. Границы аорто-подвздошной лимфаденэктомии следующие: латерально – мочеточники, сверху – нижняя горизонтальная ветвь двенадцатиперстной кишки, нижняя граница при раке ободочной и верхнеампулярного отдела прямой кишок ограничивается удалением подвздошной клетчатки (Рис.10). На уровне крестца при выделении задней стенки прямой кишки данный нерв необходимо аккуратно выделить и сохранить с обеих сторон.
Начинается удаление фасции с задней полуокружности с последующим переходом на боковые стенки. В области бифуркации аорты сохраняется верхнее гипогастральное сплетение, от которого отходят правый и левый гипогастральные нервы. Последние направляются латерально и вниз и на боковых стенках таза, совместно с парасимпатической нервной системой, участвуют в формировании тазового сплетения. Рассматриваемые нервные образования нередко имеют «рассыпной» тип строения, поэтому сохранить их удается далеко не всегда. Следует отметить, что данный этап операции представляет наибольшие технические трудности и опасность вследствие интимной взаимосвязи с мочеполовыми органами и венами таза, из которых при повреждении возникают обильные кровотечения.
Oбъемы резекции и лимфодиссекции при лапароскопических вмешательствах не уступают традиционным лапаротомным.
Посмотреть видео операций в исполнении профессора Вы можете на сайте «Видео операций лучших хирургов мира».
Список опубликованных работ по теме лапароскопического лечения рака прямой кишки (ТМЭ)




Рак прямой кишки
МРТ методика и МРТ стадирование рака прямой кишки
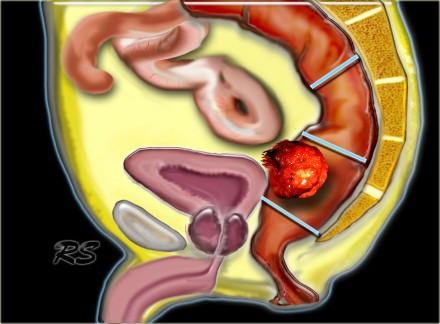
Основным направлением в лечении колоректального рака в настоящее время является иссечение прямой кишки вместе с эмбриологически связанным с ней фасциальным футляром и параректальной клетчаткой содержащей лимфатические узлы, total mesorectal excision (TME). Другим направлением является переход от адъювантной к неоадъювантной химиолучевой терапии. Оба подхода кардинально изменили частоту местных рецидивов и выживаемость пациентов. Полная ремиссия может достигать до 30% у пациентов получающих неоадьювантную химиотерарию. Вопрос состоит в том, является ли пациент с раком прямой кишки кандидатом на TME или же необходима предоперационная химиолучевая терапия с последующей TME. МРТ, как наиболее точный метод для стадирования рака прямой кишки, может ответить на этот вопрос.
Radiology Departement of the Maastricht University Hospital and the Rijnland Hospital in Leiderdorp, the Netherlands
Введение
Ранние методы хирургического лечения рака прямой кишки заключались в резекции опухоли с окружающей параректальной клетчаткой. Однако при использовании данных методик частота местных рецидивов достигала 40%. В 1982 году хирургом Richard John Heald была предложена техника TME. Широкое внедрение данной техники позволило снизить частоту местных рецидивов с 40% до 11% (1,2). Роль МРТ заключается в определении возможности TME операции, а в случае значительной распространенности опухолевого процеса назначения химиолучевой терапии как первого этапа лечения, с последующей TME.
Total mesorectal excision
TME техника является методом выбора при лечении колоректального рака при условии налиичия свободного края опухоли. Прямая кишка с опухолью «единым блоком» удаляется вместе с мезоректумом под контролем зрения до уровня анального канала острым путем в бессосудистой зоне. Собственная фасция остается неповрежденной. Сохраняются в целостности расположенные кнаружи пресакральная прослойка жировой ткани, париетальная фасция боковых стеной таза, предстательная железа у мужчин и влагалище у женщин вместе с нервными сплетениями. Это сводит к минимуму вероятность неполного удаления опухоли.
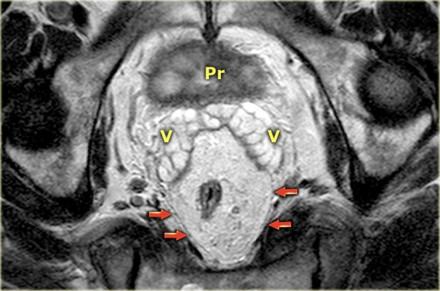
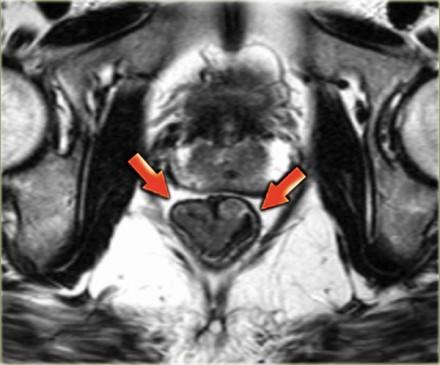
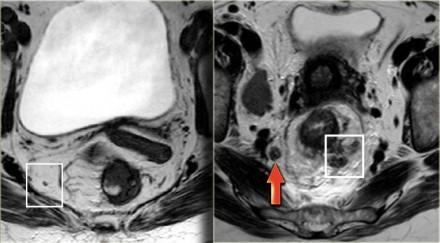
На МР изображениях параректальная клетчатка имеет высокую интенсивность сигнала на Т1 и Т2 взвешенных изображениях. Параректальная клетчатка отграниченна мезоректальной фасцией, которая виднка как тонкая линия с низкой интенсивностью МР сигнала (красные стрелки).
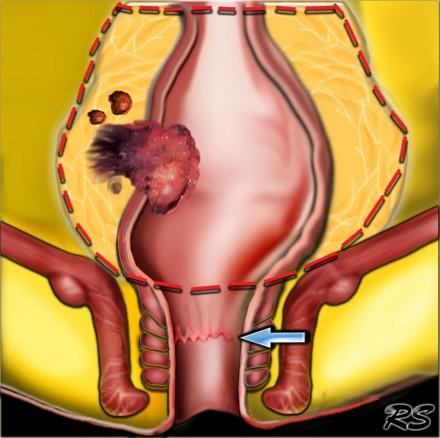
Роль мезоректальной фасции при планировании TME.
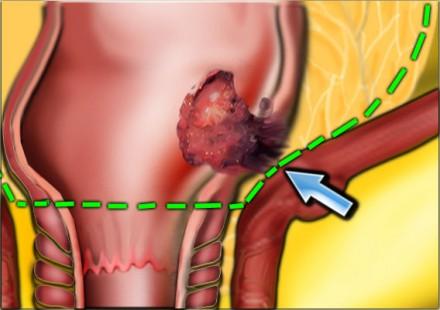
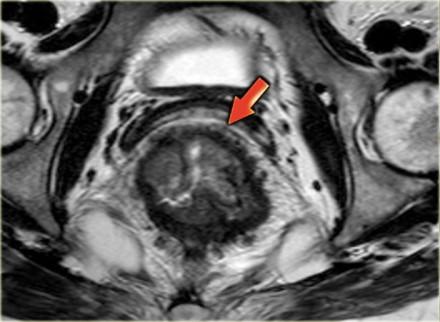
Наименьшая дистанция от края опухоли или лимфатических узлов называется circumferential resection margin (CRM/циркулярный край резеции/ проксимальный, дистальный и латеральный края резекции). Она является одим из главных факторов риска местного рецидива. Вовлеченный латеральный край резекции является отдельным прогностическим фактором общей и безрецидивной выживаемости, расстояние > 2 мм позволяет говорить о том, что мезоректальная фасция интактна, 1-2 мм с возоможной инвазией, и вовлечена в процесс если это расстояние ⩽1 mm.
Сircumferential resection margin / циркулярный край резеции / латеральный край резекции
На иллюстрации слева:
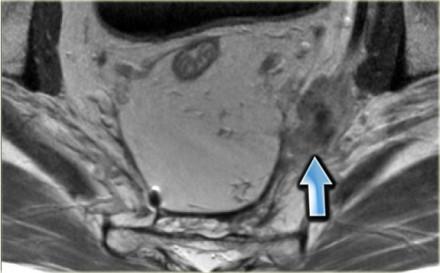
При наличии визуализируемых лимфатических узлов и «отсевов» опухоли в 2 мм от мезоректальной фасции, всегда необходимо отражать это в описании, так как они могут отражать вовлечение латерального края резекции (синяя стрелка).
МРТ исследование должно определить следующее:
Локализация опухоли
Прямой кишкой называется сегмент толстой кишки к низу от сигмовидной ободочной кишки и до заднепроходного отверстия. Ректосигмоидный переход условно определяется на 15 см выше анального отверстия. Опухоли с локализацией более 15 см выше анального отверстия рассматриваются и рассматриваться как опухоли сигмовидной кишки. Поскольку на МР изображениях мы не можем обнаружить анального отверстия, лучше измерять это расстояние от аноректального угла. Таким образом опухоли на 15 см выше аноректального угла рассматриваютсякак опухоли сигмовидной кишки.
Рак прямой кишки может быть разделен на:
Нижнеампулярный рак прямой кишки
Нижнеампулярный рак прямой кишки имеет более высокую частоту местных рецидивов. Дистальное сужение параректальной клетчатки предрасполагает к тому, что нижнеампулярный рак прямой кишки более легко проникает в окружающие структуры и более трудоемок для получения свободного края резекции хирургом (см рисунок).
T-стадия и мезоректальная фасция.
Следующим шагом после определения локализации опухоли, необходимо определить Т-стадию. МРТ не может определить отграниченна ли опухоль подслизистым слоем или есть инвазия мышечного слоя, и следовательно, не может разграничить T1 и T2 стадию. Чтобы избежать рисков, тяжелых осложнений, связанных с обширными операциями, для ранних опухолей прямой кишки Т1 применяется трансанальное местное иссечение. Этот метод требует тщательной предоперационной диагностики с участием трансанального УЗИ, как более точного в дифференцировке на T1 и T2 стадиях.
T1 и T2
T1 и T2 опухоли ограничены стенкой кишечника и имеют хороший прогноз в лечении.
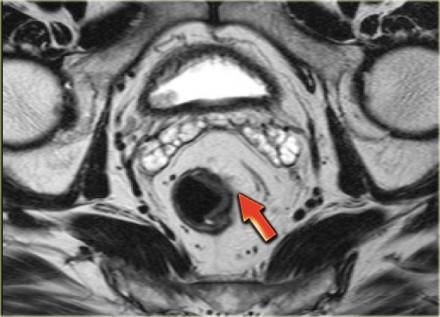
Они могут быть достаточно точно определены на МРТ, так как неизмененная стенка прямой кишки будет иметь вид линии с МР-сигналом низкой интенсивности, что означает что наружный мышечный слой окружает опухоль (3). На изображении, опухоль прямой кишки полностью окружена черной полоской наружной мышечной стенки. Это Т2 опухоль.
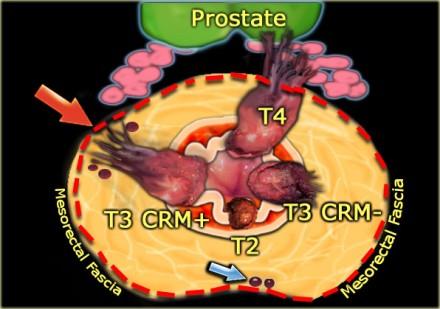
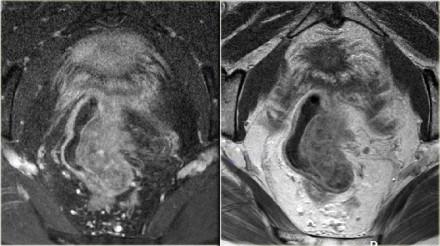
T3 MRF-
Чувствительность МРТ в диагностике инвазии в периректальную клетчатку составляет 82%. Видимая лучистая инфильтрация периректальной клетчатки, может быть ловушкой, так как может быть как результатом опухолевого прорастания, так и местной десмопластической реакции. Что бы избежать неправильной трактовки, опухоли с инфильтрацией периректальной клетчатки рекомендуется стадировать как Т3. Степень экзофитного распространения является прогностическим фактором. На МР изображениях слева предствалены две опухоли со схожей МР картиной. На изображении А была выявленая инвазия периректальной клетчатки. На изображении В опухоль была отграничена стенкой кишечника, Т2 стадия, периректальная инфильтрация клетчатки в данном случае была результатом десмопластической реакции. На выбор лечебной тактики данный признак, при дифференцировке между T2 MRF- и T3 MRF- опухолями, не оказывает значимого влияния. Обе опухоли будут подвергнуты ТМЕ или предоперационному курсу низкодозной лучевой терапии 5х5 Гр с последующим TME
T3 MRF +
Слева опухоль с инвазией параректальной клетчатки и инвазией переднего края резекции (стрелка). Такая опухоль классифицируется как Т3 MRF +. Данный пациент будет проходить курс химиолучевой терапии, при положительном ответе на которую по результатам МРТ контроля будет проведено рестадирование с последующей ТМЕ.
Т4 — опухоль инфильтрирует окружающие органы (влагалище, простату, семенные пузырьки или мочевой пузырь) и ткани. Пациенты с данной стадией требуют длительного курса химиолучевой терапии и обширной операции. Для определяется инвазии в окружающие органы все диагностические методы показывают схожую чувствительность: 70% для ТРУЗИ, 72% для КТ и 74% для МР-томографии. Слева T4-опухоль с инвазией предстательной железы.
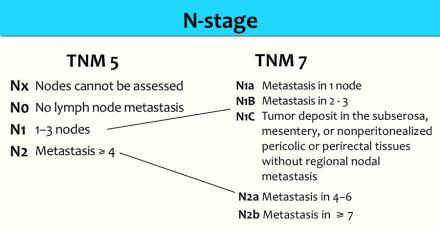
N-стадия
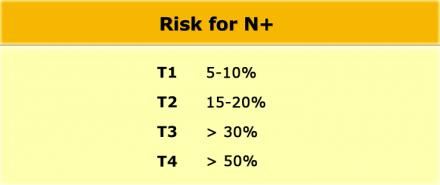
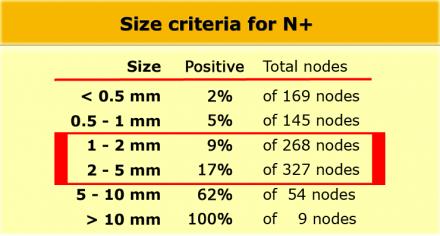
Наличие N-стадии является важным фактором риска развития локорегионарного рецидива. К сожалению МРТ, как и большинство других методов визуализации, имеет низкую чувствительность и специфичность для обнаружения метастазов в лимфатических узлах. Пораженными считаются лимфатические узлы с размерам по короткой ось > 5 мм, изменением формы, с лучистыми контурами и нечеткими границами или гетерогенной структурой. Однако не все пораженные лимфатические узлы отвечают этим критериям.
Более часто используется классификация TNM5 для определения N-стадии. N-стадии в TNM7 схожи с TNM5, но N1 и N2-стадии более дифференцированы.
Даже в T1 и T2 стадии опухолевого процесса имеют значительный риск метастатическго поражения лимфоузлов (см. таблицу).
Низкая чувствительной использования для оценки только размеров, может быть объяснена тем фактом, что при колоректальном раке широко распространено наличие злокачественных изменений даже в мелких лимфатических узлах, до 9% в узлах размерами 1-2 mm nodes и до 17% у узлах размерами 2-5 mm (11). Как показано в таблице слева, большинство изменений выявляется в лимфатических узлах размерами 1-5 mm. Чтобы не занижать стадию все визуализируемые лимфатические узлы можно рассматривать как малигнезированные.
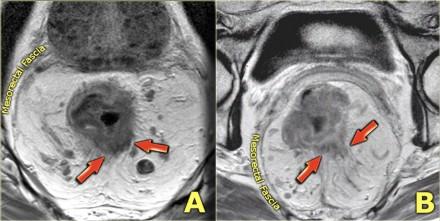
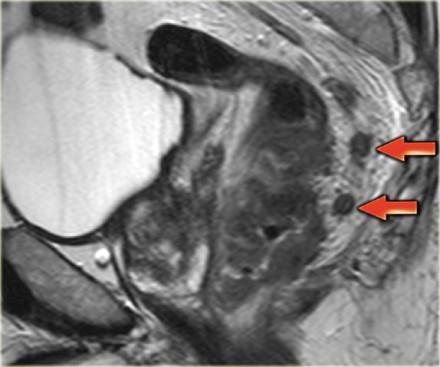
На изображении слева нижнеампулярный рак прямой кишки с множественными лимфатическими узлами в периректальной клетчатке кзади от ампулы. Это имеет огромное влияние на прогноз у пациента, основанное на MRF+ и N+ статусе, по этому пациент будет получать более агрессивное лечение с неоадъювантной химиолучевой терапией.
Важно обращать внимание на лимфатические узлы задней мезоректальной клетчатки (стрелка). Данные мезоректальные лимфатические узлы важны, так как могут быть причиной местных рецидивов. При их обнаружении с помощью МРТ, лучевая терапия и хирургическое планирование будут адаптированы.
Слева пациент после TME с рецидивом в узлах мезоректальной клетчатки (стрелка). Эти мезоректальные лимфатические узлы не были резецированы во время стандартной ТМЕ операции.
Определение малигнезированных мезоректальных лимфатических узлов как минимум влечет за собой более расширенную хирургическую тактику, так как необходимо удалить все опухолевые узлы или увеличение дозы лучевой терапии в зоне риска.
На аксиальных Т2-взвешенных изображениях слева представлены два пациента с раком прямой кишки. Эти примеры иллюстрируют сложности определяется N-статуса. На крайний слева определяется небольшой эктрамезоректальный лимфатический узел.
На изображении справа визуализируются многочисленные крупные мезоректальные лимфатические узлы, а также в правых отделах эктрамезоректальной клетчатки определяется лимфатический узел с нечеткими границами (красная стрелка). Хотя лимфатические узлы этих пациентов имеют разные характеристики по размерам, границам и гетерогенному внешнему виду, все они оказались малигнезированными.
Рак прямой кишки характеризуется метастатическим поражением мелких лимфатических узлов.
МР протокол
Только T2 FSE изображения, нет контрастное усиления.
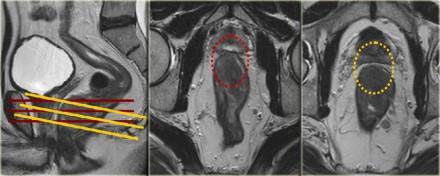
Аксиальные изображения должны быть под правильным углом, перпендикулярно оси опухоли, чтобы избежать усреднения объема.
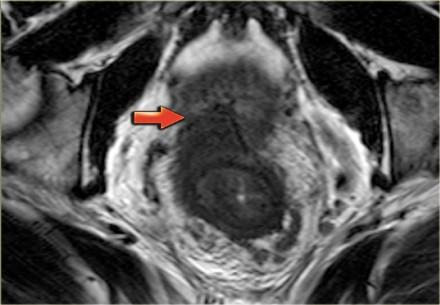
На примере слева первое планирование аксиальных изображений было выполнено под неправильным углом, что создало ложное впечатление о вовлечении мезоректальной фасции (MRF, выделено красным кругом), при правильном изменении угла перпендикулярно оси опухоли видно, что мезоректальная фасция (MRF) не вовлечена в процесс (желтый круг).
Не используйте программы с подавлением сигнала от жира и ректальное контрастирование
Подавление сигнала жира не улучшает визуализацию границ опухоли. Пациенты не нуждаются в подготовке кишечника. Использование ректального контраста не рекомендуется, потому что растяжение стенок кишечника может привести ложноположительным результатам при отсутствии инвазии в мезоректальную фасцию.
Кроме того, это затрудняет оценку дистальных мезоректальных лимфатических узлов.
Описание исследования
Описание исследования
А. Первичное исследование
Радиологический отчет должен содержать следующие пункты:
Б. Оценка ответа на неоадъювантную химиолучевую терапию
Контрольное исследование выполняется аналогичным образом как и первичное исследование, с добавлением префикса Y.
Например YT3 означает, что пациент с опухолевой инвазией в мезоректальную фасцию получает неоадъювантую терапию.
Лечение
Существуют различные подходы в лечении рака прямой кишки в разных странами и разных учреждениях. Общепринято, что TME является лучшим методом радикального лечения для всех опухолей со свободным краем резекции. В Нидерландах, как и в большинстве европейских стран, большинству пациентов до TME проводится краткий курс лучевой терапии 5×5 Гр. В отдельных учреждениях, при наличии хороших прогностических факторов (верхнеампулярные раки T1N0 и T2N0), предоперационный курс лучевой терапии не проводится. Короткие курсы лучевой терапии непосредственно перед TME не снижают распространенность и поэтому не подходят для местно распространенных опухолей.Все пациенты с Т4-опухолями, опухолями с инвазией края резекции, а так же опухолями с малигнезацией лимфатических узлов вблизи или за пределами края резекции, сначала получают высокодозную химиолучевую терапию. Дальнейшая тактика зависит от ответа на проводимое предоперационное лечение. В случае регрессии опухоли выполняется менее обширная резекция. В случаях уменьшения размеров опухоли и стерилизации узлов (yN0) следующим шагом выполняется TME. При полном исчезновение опухоли и лимфатических узлов может рассматриваться выжидательная тактика. Однако этот подход остается спорным и не является стандартным.