Младенческое у детей что это такое
Спинальная мышечная атрофия 1 типа
Может ли донор банка половых клеток оказаться носителем тяжелого генетического заболевания?
У людей, решивших воспользоваться услугами банка половых клеток, обычно возникает множество вопросов и переживаний. Часто пара беспокоится о том, что донор может оказаться носителем серьезных наследственных болезней. Например, многие слышали, что есть такая тяжелая болезнь, как спинальная мышечная атрофия. Поговорим о том, что это за патология, и как в Репробанке выявляют кандидатов в доноры, являющихся ее носителями.
Спинальная мышечная атрофиия 1 типа, или младенческая форма СМА (англ. SMA), или болезнь Верднига-Гоффмана – тяжелое наследственное заболевание, которое проявляется в нарушении работы мышц, дыхания, глотания.
Заболевание развивается из-за дефекта в гене SMN1, который находится в длинном плече пятой хромосомы. В нём возникает делеция – выпадение участка генетического материала, которая приводит к некорректной работе гена и отсутствию выработки белка, отвечающего за поддержание двигательных нейронов, являющихся нервными клетками головного и спинного мозга, отвечающими за управление движением мышц.
Спинальная мышечная атрофия 1 типа наследуется аутосомно-рецессивно. То есть для того, чтобы родился больной ребенок, он должен получить генетический дефект сразу в двух копиях гена SMN 1, расположенных на сестринских хроматидах, пришедших от обоих родителей.
Если это происходит, то в организме не синтезируется белок SMN, необходимый для нормальной работы двигательных нейронов (нервных клеток), из-за чего возникают мышечные расстройства.
Внимательный читатель тут задаст вопрос: коль скоро существует первый тип спинальной мышечной атрофии, то должен быть второй и т. д.? Действительно, всего существует пять типов заболевания. Они различаются по характеру генетических нарушений, времени возникновения и тяжести симптомов. Первый тип самый распространенный и один из самых тяжелых.
Частота носительства дефектных генов оценивается, по разным данным, от 1:38 до 1:70. Иными словами, каждый 38–70-й человек имеет одну дефектную копию гена SMN1, на одной из дочерних хроматид, но сам при этом здоров. Если два таких человека решат завести ребенка, вероятность того, что малыш получит оба дефектных гена и родится больным, составляет 25%. Но, как считается, такая тяжелая патология нередко приводит к прерыванию беременности на ранних сроках, поэтому распространенность заболевания не так высока, как должна бы получиться по расчетам: в реальности она составляет 1 случай на 11 000 новорожденных.
Как проявляется младенческая форма СМА?
Симптомы спинальной мышечной атрофии возникают с рождения либо до 6 месяцев. У таких детей отмечается гипотония – сильное ослабление мышечного тонуса, особенно в ручках и ножках. Из-за поражения нервных клеток их мышцы ослаблены, поэтому у таких малышей не формируются основные навыки: они не могут держать головку, сидеть, ползать, стоять. У них нарушено дыхание и глотание, утеряна способность самостоятельно принимать пищу, и их приходится кормить через зонд. Такие дети нуждаются в специальном уходе с участием команды врачей-специалистов.
При этом когнитивные (познавательные) способности больного ребенка обычно не нарушены.
Для выявления болезни Верднига-Гоффмана проводят электромиографию (регистрацию электрических импульсов в мышцах), биопсию мышц (получают небольшой образец мышечной ткани и исследуют под микроскопом). Самый точный метод диагностики – исследование структуры ДНК (для анализа берут кровь).
Каков прогноз? Существует ли эффективное лечение?
Прогноз при спинальной мышечной атрофии неблагоприятный. Большинство детей, родившихся с этим заболеванием, не доживает до 2 лет. Средняя продолжительность жизни составляет 1 год.
Лечения, направленного на причину заболевания, на данный момент не существует, хотя предпринимаются попытки его создать. Большинство детей получают лишь соответствующий уход и симптоматическую терапию. Симптомы постепенно нарастают, и ребенок погибает, как правило, от дыхательной недостаточности.
В 2016 году американским Управлением по контролю качества лекарственных препаратов и продуктов питания (FDA) был одобрен препарат Спинраза (Spinraza), модифицирующий течение спинальной мышечной атрофии. Дело в том, что помимо гена SMN1, в клетках человека есть ген SMN2, который тоже кодирует белок SNM, но его вырабатывается меньше, и он быстрее разрушается. Спинраза заставляет ген SMN2 работать активнее, в результате чего улучшается состояние больного ребенка и увеличивается продолжительность жизни.
В 2019 году FDA одобрило инновационный препарат для генной терапии спинальной мышечной атрофии – Золгенсма (Zolgensma). Это лекарство – по сути искусственно созданный «вирус», который доставляет рабочую копию гена SMN1 в нервные клетки.
В августе 2019 года состоялась регистрация препарата Спинраза (Spinraza ) в РФ.
Несмотря на эти достижения, до победы над СМА еще далеко, а инновационные препараты стоят очень дорого, и к сожалению, доступны не многим, болеющим СМА детям. Поэтому врачи Репробанка тщательно обследуют кандидатов в доноры половых клеток и информируют пациентов банка о необходимости уточнения их статуса носительства частых аутосомно-рецессивных заболеваний, к которым относится СМА, что позволяет значительно снизить риски рождения детей с генетической патологией.
Какие меры принимаются в Репробанке?
Репробанк тщательно проверяет всех доноров половых клеток:
Пользуясь услугами Репробанка, вы максимально снижаете риски передачи наследственных заболеваний от доноров репродуктивных клеток.
Существуют некоторые причины для остаточного риска рождения ребенка с заболеванием, но они крайне малы:
Все эти ситуации встречаются достаточно редко. Для того чтобы дополнительно снизить риски, мы рекомендуем провести генетический анализ на данную патологию второму родителю.
Зиновьева Юлия Михайловна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Республиканская детская клиническая больница
Единый Всероссийский детский Телефон Доверия для детей, подростков и их родителей (бесплатный) 8-800-2000-122
г. Симферополь
г. Симферополь
Режимы работы:
Стационар: (круглосуточно)
Приемное отделение (круглосуточно)
Консультативно-диагностический центр
Телефоны
Приемное отделение
Колл-центр Справочной службы КДЦ( Консультативно-диагностический центр ):
Регистратура КДЦ:
Платные услуги:
Приемная главврача:
КДЦ( Консультативно-диагностический центр ):
НЕЭПИЛЕПТИЧЕСКИЕ СОСТОЯНИЯ У ДЕТЕЙ. ДОБРОКАЧЕСТВЕННЫЙ НЕЭПИЛЕПТИЧЕСКИЙ МИОКЛОНУС МЛАДЕНЧЕСТВА.
В настоящее время увеличивается количество судорожных состояний у детей. Чаще всего они провоцируются тяжелыми поражениями головного мозга, генетическими аномалиями, обменными нарушениями. Данные состояния требуют обязательного назначения противосудорожных препаратов и наблюдения детского невролога.
Наряду с этим, все чаще встречаются у детей приступы, вызывающие волнение родителей, но не нуждающихся в медикаментозной коррекции. Это неэпилептические приступы, связанные с неспецифическими реакциями незрелого мозга.
Синдром Феджермана – доброкачественные неэпилептические спазмы младенчества, внешне практически неотличимые от эпилептических приступов, таких как инфантильные судороги или миоклонические приступы.
Синдром Феджермана диагностируется на основании типичных клинических проявлений в виде кратковременных кивков или вздрагиваний при условии отсутствия очаговой неврологической симптоматики и нормального психомоторного развития у детей в период младенчества, при этом не должны регистрироваться эпилептиформные изменения на ЭЭГ как в период судорожного эпизода, так и в межприступный период. Доброкачественный неэпилептический миоклонус младенчества возникает обычно на первом году жизни (чаще в 6 месяцев), совпадая с возрастом дебюта эпилепсии Веста. Обычно приступы кратковременны (1-2 сек), но возможны и более длительные эпизоды обычно за счет возникновения повторяющихся приступов. Хаотические изолированные движения могут наблюдаться несколько раз в день, но необязательно ежедневно. Двигательный компонент приступов может быть различным. Часть событий проявляется короткими тоническими спазмами конечностей или шеи, другие – эпизодами «дрожания», короткими вздрагиваниями, кивками. Движения практически всегда симметричны. Характерно возникновение приступов в состоянии бодрствования, чаще при волнении, страхе, иногда при дефекации и мочеиспускании, однако у 15% пациентов они могут наблюдаться и во сне.
Причина возникновения синдрома Феджермана неизвестна. По данным Maydell (2001), двигательные проявления синдрома представляют собой физиологические спазмы мышц. По сообщению Caraballo и соавт. (2009), интересной особенностью большинства обследованных семей пациентов с синдромом Феджермана является наличие хотя бы у одного из родителей университетского образования. Имеет ли это значение – покажут будущие исследования.
Прогноз синдрома Феджермана благоприятный с полным излечением к двух-трехлетнему возрасту (чаще приступы прекращаются на втором году жизни). Нарушений психоречевого развития не отмечается ни у одного пациента. Сочетание синдрома Феджермана с идиопатической фокальной эпилепсией (оба возрастзависимых состояния) может свидетельствовать о наличии единого механизма патогенеза – врожденного нарушения процессов созревания мозга.
Проявления – доброкачественного миоклонуса младенчества следует оличать в первую очередь, в первую очередь, от младенческих спазмов и эпилептических приступов, однако следует помнить и о других неэпилептических судорожных состояниях. Это дистонические феномены, характерные для пароксизмальных дискинезий, синдрома Сандифера, пароксизмальной кривошеи, пароксизмального хореоатетоза. Дрожание может наблюдаться при медикаментозных отравлениях, судорогах младенцев, а также в рамках доброкачественного тремора. Кивки и вздрагивания следует отличать от доброкачественных судорог новорожденного и других эпилептических приступов. С тоническими вытягиваниями могут быть сходны доброкачественный поворот глазных яблок, изменение позы при испуге и вздрагиваниях.
С учетом жалоб родителей, данных осмотра, нормального психомоторного развития, отсутствия в неврологическом статусе очаговой симптоматики, а также неизмененной возрастной ЭЭГ устанавливается диагноз: доброкачественный неэпилептический миоклонус младенчества. Рекомендовано воздержаться от назначения длительной противосудорожной терапии. Дальнейшее наблюдение за детьми показало постепенное исчезновение указанных состояний. При возникновении у ребенка насильственных вытягиваний, вздрагиваний, складываний, вычурных поз, поворотов головы и глаз – необходимо обратиться к врачу для своевременного определения причины данных состояний и решения вопроса о назначении лечения.
Номеровская А.А.,
ГБУЗ РК РДКБ «Психоневрологическое отделение»
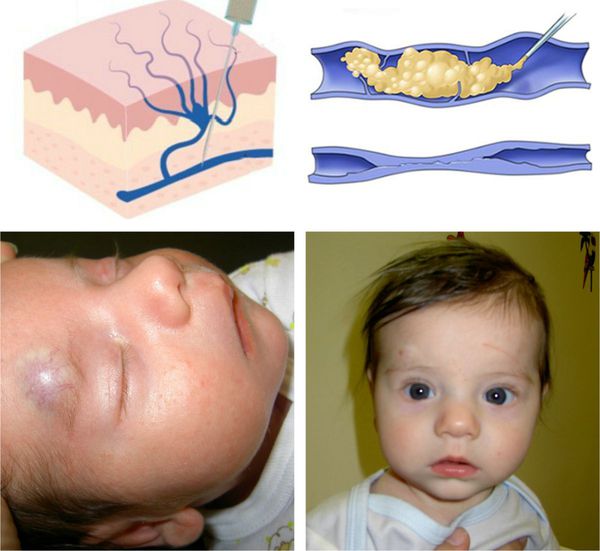
Что такое гемангиома у детей? Причины возникновения, диагностику и методы лечения разберем в статье доктора Подшивалова О. А., детского хирурга со стажем в 14 лет.
Определение болезни. Причины заболевания
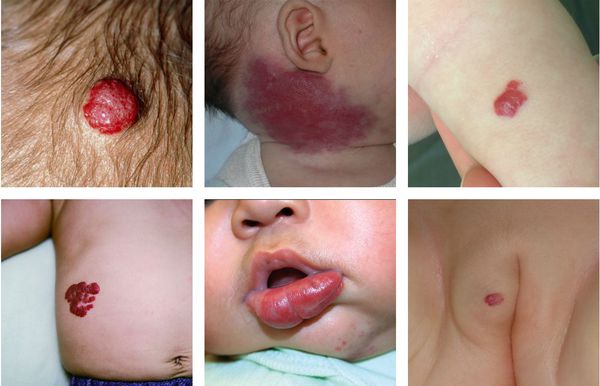
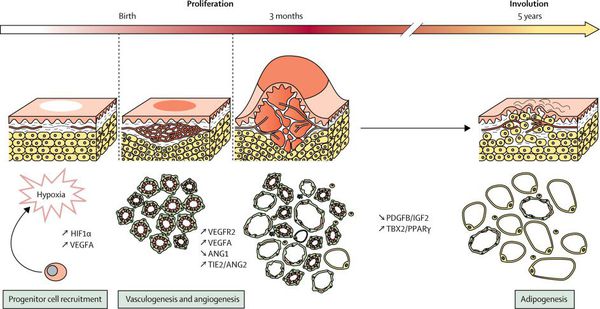
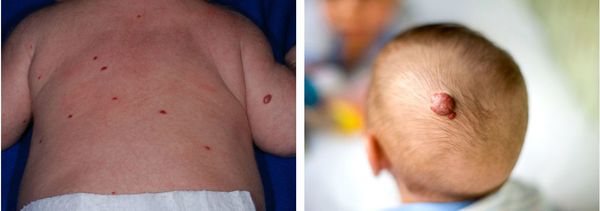
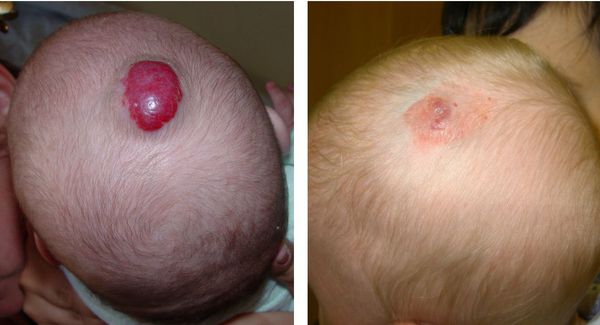
Младенческая гемангиома — это доброкачественная опухоль, возникающая в первые месяцы жизни ребёнка. Она состоит из самостоятельно инволюционирующих клеток, которые формируют кровеносные сосуды. Для неё характерны определённые фазы развития — пролиферация (рост), стабилизация и инволюция (обратное развитие).
Хотя гемангиома проходит самостоятельно, в ряде случаев она может стать причиной артериального кровотечения и менее опасных осложнений, таких как косоглазие, язвы, разрушение хрящей в области век, носа, губ или ушных раковин. Иногда она может быть признаком других заболеваний, например синдромов PHACE или LUMBAR. А при расположении на видимом участке тела (например, на лице) гемангиома может значительно усложнить социализацию ребёнка в коллективе, что приведёт к психологическому дискомфорту, трудностям в общении со сверстниками и депрессии.
Именно поэтому не следует ждать, пока гемангиома пройдёт сама, а показать ребёнка специалисту. После осмотра врач подберёт оптимальный метод лечения, если оно необходимо, а при подозрении на сопутствующие заболевания назначит дополнительные методы исследования.
Наличие более 4-5 младенческих гемангиом на коже при отсутствии очагов в печени, селезёнки или других внутренних органах определяется как «доброкачественный неонатальный гемангиоматоз». Наличие таких очагов не только на коже, но и во внутренних органах (прежде всего в печени) определяется как «диффузный неонатальный гемангиоматоз».
К возможным провоцирующим факторам образования гемангиомы относят:
По статистике, дети с младенческими гемангиомами чаще рождаются у первородящих молодых мам (до 30 лет).
Симптомы гемангиомы у детей
Некоторая часть младенческих гемангиом у детей обнаруживается при рождении в виде единичных сосудистых образований кожи или подкожно-жировой клетчатки. Но большинство гемангиом возникают вскоре после рождения, в основном в первые недели жизни ребёнка, растут, но со временем постепенно инволюционируют.
Патогенез гемангиомы у детей
Младенческая гемангиома возникает на 6-10 неделе беременности, когда происходит нарушение закладки тканей (сосудов). Существует около 10 теорий развития младенческих гемангиом: фиссуральная, неврологическая, травматическая, эмбриональная, гипоксическая и пр. Среди современных теорий можно выделить теорию циркулирующих эндотелиальных клеток-предшественников, плацентарную теорию (нарушение плаценты во время беременности) и др. Однако в настоящее время нет ни одной общепризнанной, подтверждённой теории, которая могла бы достоверно объяснить появление младенческих гемангиом.
Патогенез младенческой гемангиомы изучен не до конца, проводится дальнейшее изучение данного процесса. Есть теория клеточного происхождения из собственных внутренних эндотелиальных клеток-предшественников (endothelialprogenitorcells — EPCs) или ангиобластов плаценты. Также считается, что имеет значение воздействие внутренних (ангио- и васкулогенез) и внешних факторов (тканевая гипоксия и нарушения тканевого развития).
После возникновения младенческая гемангиома претерпевает ряд изменений, которые можно разделить на несколько этапов:
Рост опухоли происходит за счёт быстрой клеточной пролиферации (разрастания) эндотелиальных клеток. Капиллярный эндотелий этих опухолей приобретает способность к неоангиогенезу (формированию новых кровеносных сосудов) в присутствии абиогенных факторов, которые секретируются клетками самой гемангиомы. К таким факторам относится фактор роста фибробластов (FGF-2, bFGF) и эндотелия сосудов (VEGF), коллагеназы IV типа, урокиназы и антигена пролиферации клеток.
Классификация и стадии развития гемангиомы у детей
По классификации Международного общества по изучению сосудистых аномалий (ISSVA) 2018 года заболевание относится к сосудистым опухолям. Оно делится на следующие виды:
Также младенческие гемангиомы разделяют п о объёму поражения кожи:
Гемангиоматоз бывает двух видов:
До настоящего времени по отношению к заболеванию используются устаревшие термины, такие как «кавернозная», «капиллярная», «утёсовидная» гемангиома, «клубничное врождённое пятно» и другие. Использование этих неверных терминов усложняет процесс диагностики и вносит определённую путаницу в общение между специалистами. Например, под термином «капиллярная гемангиома» может скрываться как младенческая гемангиома, так и капошиформная гемэндотелиома.
Гемангиома может быть одним из симптомов различных синдромов:
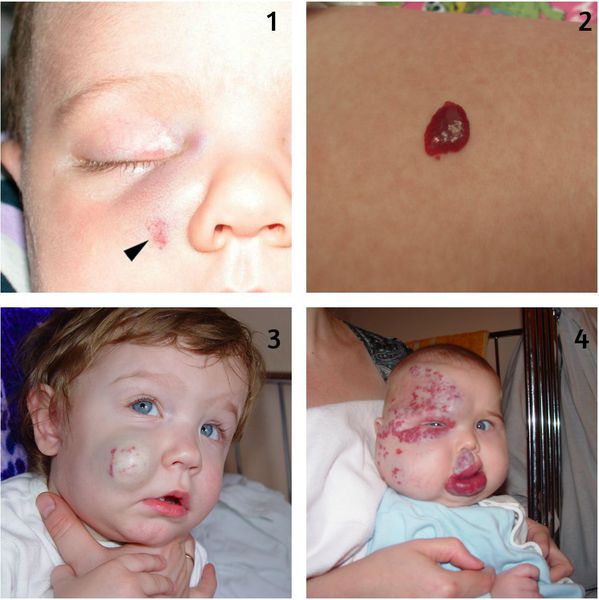
PHACE(s) — это синдром, при котором наличие сегментарной младенческой гемангиомы в области иннервации тройничного нерва сочетается с одной или более аномалиями: патологией задней черепной ямки, артериальной цереброваскулярной патологией, пороком сердца или магистральных сосудов, сердечной недостаточностью, глазными или эндокринными патологиями, расщелиной грудины или грыжей белой линии живота.
Осложнения гемангиомы у детей
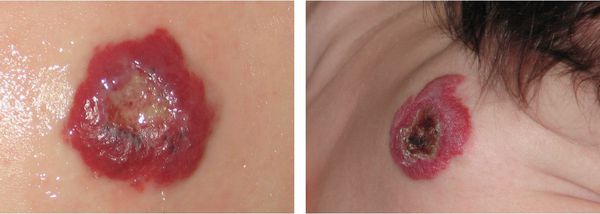
Кровотечение из гемангиомы является вторым по частоте осложнением, которое возникает вследствие травмирования или на фоне появления раневого дефекта (изъязвления). Оно может быть обильным и трудно останавливаемым. В некоторых случаях не помогает даже гемостатическая губка.
Если опухоли располагаются в зонах сложной анатомической локализации, то при быстром росте они могут нарушить работу близлежащего органа:
У детей с обширными младенческими гемангиомами и большим артериовенозным шунтированием (сбросом) может возникнуть застойная сердечная недостаточность. При обширных младенческих гемангиомах, расположенных в области лица, может возникнуть гипотиреоидизм (недостаточная функция щитовидной железы, сопровождающаяся снижением выработки гормонов).
Диагностика гемангиомы у детей
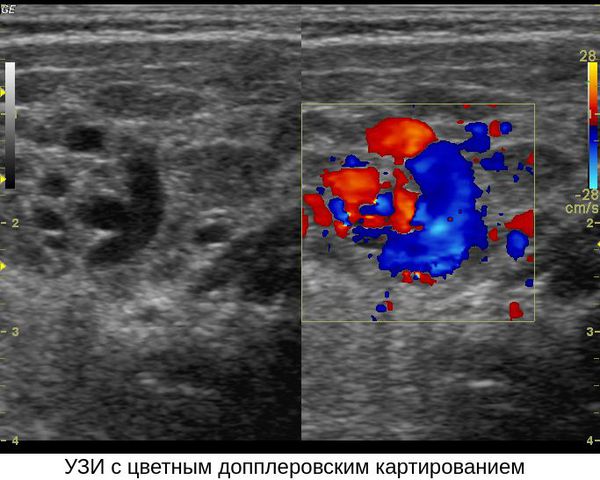
Для постановки диагноза «младенческая гемангиома» достаточно проведения специалистом грамотного осмотра и ультразвукового исследования (УЗИ).
Также для подтверждения диагноза возможно выполнение магнитно-резонансной томографии (МРТ), иногда с внутривенным контрастированием. Но поскольку данный метод требует проведения наркоза, его также не следует использовать рутинно для диагностики младенческой гемангиомы.
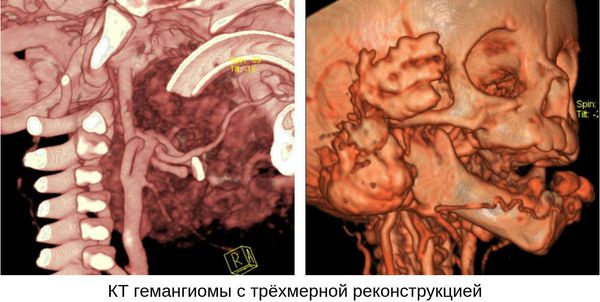
Проведение компьютерной томографии (КТ) и ангиографии для диагностики младенческой гемангиомы является избыточным, поскольку КТ связано с высокой лучевой нагрузкой. Кроме того, для проведения КТ нужно выполнить внутривенное контрастирование. Маленьким детям КТ также проводится под наркозом.
Лечение гемангиомы у детей
В настоящее время есть различные способы лечения младенческих гемангиом. Многие из них уже утратили своё значение, другие успешно используются и в настоящее время. Основной вектор лечения — активное наблюдение или проведение того или иного вида терапии уже с момента установки диагноза.
При выборе тактики лечения следует руководствоваться несколькими факторами:
Оценочная шкала для определения показаний к системному медикаментозному лечению младенческих гемангиом бета-адреноблокаторами
Врач проводит осмотр пациента, оценивает указанные критерии и суммирует баллы. При наборе от 9 до 14 баллов показано системное медикаментозное лечение, а при наборе от 4 до 8 баллов медикаментозная терапия не требуется.
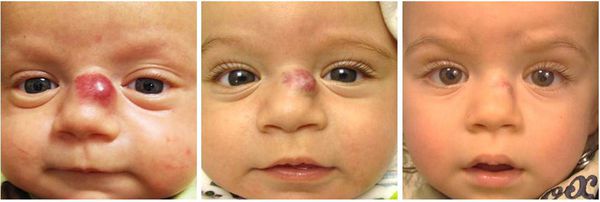
Во время оценки расположения гемангиомы необходимо учитывать не только косметический дефект, но и риск появления различных осложнений. К таким «критическим зонам» относятся область ушей, носа, губ и век (орбиты глаза). Например, при разрушении хряща уха возникнет стойкая деформация ушной раковины, для коррекции которой потребуется пластическая операция. При расположении младенческих гемангиом в области промежности и ягодиц часто появляются изъязвления, которые трудно заживают, поэтому такая локализация также является критической.
Большой размер опухоли указывает на активный процесс пролиферации, что сопровождается риском дальнейшего роста гемангиомы и высокой вероятностью появления различных осложнений.
В тактике лечения младенческой гемангиомы также необходимо учитывать наличие глубокого (подкожного) компонента опухоли. Он не поддаётся местному лечению и воздействию лазера, что приводит к прогрессии опухоли в глубоких слоях подкожно-жирового слоя. Поэтому в данном случае рекомендуется прибегать к медикаментозной терапии.
Чем больше количество гемангиом на коже, тем сложнее проводить местную терапию. Наличие более пяти сосудистых опухолей существенно повышает риск появления гемангиомы во внутренних органах (диффузного неонатального гемангиоматоза).
Все методы лечения младенческих гемангиом условно можно разделить на две категории:
Консервативное (неинвазивное) лечение
Данное лечение широко практиковалось до появления бета-адреноблокаторов. Сейчас к данному методу также можно прибегать, но необходимо учитывать: чем младше ребенок, тем выше риск роста опухоли. Выжидательная тактика требует частых и систематических контрольных осмотров для определения возможного роста гемангиомы.
Медикаментозное лечение
Бета-адреноблокаторы. В 2008 году французский дерматолог Лате-Лабрез (C. Leaute-Labreze) открыла действие пропранолола на младенческие гемангиомы. С этого периода начался «золотой век» бета-адреноблокаторов в терапии младенческих гемангиом. Учитывая низкий риск побочных эффектов и высокую эффективность лечения, они стали «первой линией» лечения данной болезни.
До настоящего времени неизвестен точный механизм действия бета-адреноблокаторов. Предположительно, он включает сужение сосудов, подавление VEGF-A (фактора роста эндотелия сосудов), стимуляцию апоптоза (естественного «разбора» патологических тканей). Исследования выявили наличие β2-адренергических рецепторов и VEGF-A в капиллярах разрастающейся младенческой гемангиомы, которые уменьшаются при подавлении β2-адренергических рецепторов.
Сравнение фармакологической активности препаратов Пропранолол и Атенолол.
Стероидные гормоны — о дин из самых старых способов медикаментозного лечения младенческих гемангиом. Данный метод используется с 1960 года по настоящее время и является «второй линией» терапии. До 2008 года он был основным способом лечения гемангиом, особенно при активном росте опухоли.
Механизм влияния глюкокортикостероидов на младенческую гемангиому до сих пор до конца не ясен. Однако известно, что стероидные гормоны оказывают влияние на адипогенез, угнетают образование новых сосудов и снижают выработку проангиогенных белков (VEGF-A и пр.).
Стероидные гормоны в таблетках можно применять в виде системного медикаментозного лечения. У читывая высокий риск побочных эффектов глюкокортикостероидов и появление бета-адреноблокаторов, данный метод стал применяться гораздо реже. Основные показания к его назначению — осложнённые гемангиомы и невосприимчивость образования к лечению бета-адреноблокаторами. Средний курс лечения — от 4 до 12 недель (максимальная доза). Иногда терапия стероидными гормонами может продолжаться до 9-12 месяцев жизни ребёнка.
Цитостатики (Цитоксан, Винбластин и Авастин), как утверждают зарубежные авторы, способствуют прекращению деления опухолевых клеток в метафазе. Однако в России этот метод не нашёл применения, так как Цитоксан действует на рост чувствительных, быстро пролиферирующих клеток, тем самым угнетая эритроцитарный росток крови и развитие яйцеклетки. Также существует мнение, что после применения Цитоксана возникает риск развития вторичной злокачественной опухоли — ангиосаркомы.
Винкристин — это цитостатический препарат, алкалоид растения розовый барвинок (Vincarosea). Он вызывает апоптоз (регулируемый процесс клеточной гибели) эндотелиальных клеток, уменьшает выработку их факторов роста. Как правило, лечение Винкристином проводится при сосудистой патологии, которая не является истинной младенческой гемангиомой, а сопряжена с капошиформной гемэндотелиомой или пучковой ангиомой с синдромом Казабаха — Мерритта. Лекарство вводится еженедельно через центральный катетер.
Данный метод лечения может быть полезен при отсутствии эффекта терапии стероидными гормонами. Его назначение проводится при непосредственном участии онкологов. К побочным действиям препарата относятся раздражение кожи и появление сыпи, нейротоксичность, запоры, параличи черепных нервов, боль в костях, алопеция, мышечная слабость. Как правило, побочные эффекты кратковременны.
Интерфероны (Интерферон-альфа-2а, Интерферон-альфа-2b и Имиквимод — 5% мазь Алдара) стимулируют секрецию интерферонов, которые подавляют факторы роста эндотелия и фибробластов, а также способствуют некрозу опухоли. Они применяются при неэффективности стероидной терапии. Действие этих препаратов заметно только после четырёх месяцев применения.
Поскольку интерфероны вызывают массу осложнений (анемию, нейтропению, гипотиреоидизм, лихорадку, нейроплегию), их применение при лечении детей младшего возраста не оправданно.
Лазерная коррекция
Для лечения сосудистой патологии используются лазеры с длиной волны 532 и 585 нм, реже 1064 нм. Данные лазеры не повреждают кожный покров, поэтому относится к консервативному лечению.
Работа лазеров основана на теории селективного фототермолиза, которая была описана в 1980 году. Лазерное излучение имеет постоянную длину волны, но поглощается тканями по-разному. Это объясняется наличием в коже хромофоров (воды, меланина и гемоглобина). Результатом такого поглощения энергии является нагревание ткани. Например, длина волны 532 и 585 нм лучше всего поглощается оксигемоглобином, за счёт чего происходит изолированное нагревание сосуда, приводящее к повреждению его эндотелия без вреда для окружающих тканей. В результате происходит закрытие сосуда.
После лазерной обработки не остаются шрамы и рубцы.
Оперативное (инвазивное) лечение
Склерозирование гемангиомы
Криодеструкция (удаление жидким азотом)
Разрушить очаг опухоли можно благодаря жидкому азоту температурой −195,6 °C. Он представляет собой жидкость без цвета и запаха, которая стерильна, нетоксична, инертна по отношению к биологическим тканям и не воспламенима. Во время прижигания гемангиомы жидким азотом чётко отграничивается очаг опухоли, который к 21-30 дню после криовоздействия замещается органотипическим регенератом.
Хирургический метод лечения
Хирургическому удалению подлежат не все гемангиомы: его следует использовать только при наличии жизнеугрожающих состояний, например, при кровотечении или при перекрытии дыхательных путей, но чаще всего к нему прибегают на завершающей стадии инволюции, когда кровотока в гемангиоме уже почти нет — чаще всего в 4-5 лет.
Устаревшие методы лечения
Лучевая терапия (БФРТ)
Суть данного метода заключается в облучении участка кожи рентгеновскими лучами с небольшого расстояния. Такое излучение поглощается преимущественно в поверхностных тканях и эффективно только при младенческих гемангиомах, расположенных исключительно на поверхности кожи.
Прогноз. Профилактика
Детям с младенческими гемангиомами медотвод от проведения вакцинации не даётся. Такие пациенты должны получать прививки согласно национальному календарю. До настоящего времени нет доказательств влияния вакцины на рост гемангиомы.