Монобутиловый эфир этиленгликоля что это
Монобутиловый эфир этиленгликоля что это
NIOSH также запрещает контакт с кожей всех 4 этих веществ.
а) Синонимы:
2-Этоксиэтанол: ЭГЭЭ (этилцеллозольв), Cellosolve
2-Бутоксиэтанол: ЭГБЭ (бутилцеллозольв)
2-Метоксиэтанол: ЭГМЭ (метилцеллозольв)
б) Применение. Эти производные этиленгликоля используются в качестве растворителей для полимеров, антифризов, а также как компоненты типографской туши, промышленных покрытий (протрав для дерева, эпоксидных составов, лаков, красок) и чистящих средств.
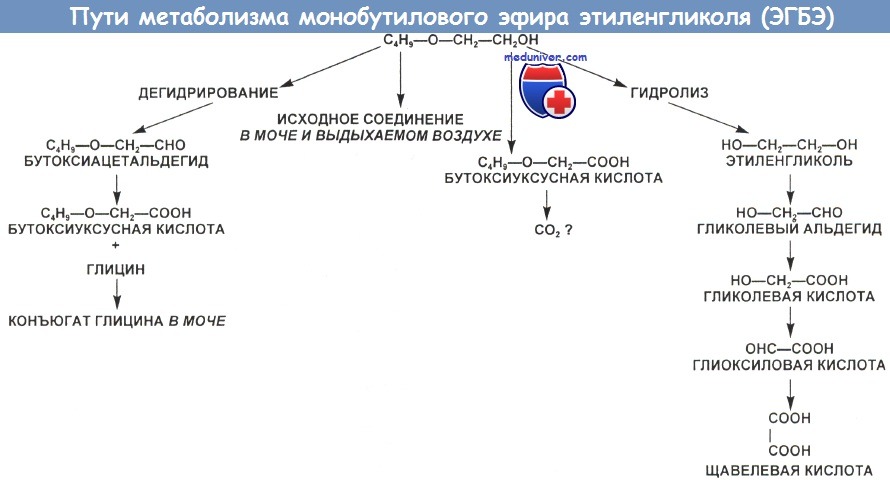
в) Патофизиология. В моче человека и животных, в организм которых попал 2-метокси-, 2-этокси-, 2-изопронокси- или 2-бутоксиэтанол, обнаруживаются соответствующий алкоксиуксусный метаболит или его глициновый конъюгат. По-видимому, многие токсические эффекты этих короткоцепочечных алкоксиэтанолов опосредованы их кислотными производными.
г) Клиника отравления производными этиленгликоля:
— Монобутиловый эфир этиленгликоля. Один взрослый, выпив за 3 дня 1 л средства для мытья окон, содержащего монобутиловый эфир этиленгликоля (ЭГБЭ), впал в коматозное состояние с гипервентиляцией. Гемодиализ привел к его выздоровлению.
Главным симптомом после приема внутрь большого количества ЭГБЭ является выраженный метаболический ацидоз, обусловленный окислением этого вещества до бутоксиуксусной кислоты. Прием внутрь менее 1 мл коммерческого средства для мытья стекол/окон, содержащего менее 17 % ЭГБЭ, по-видимому, не требует специфического лечения.
— Монометиловый эфир этиленгликоля (ЭГМЭ). В случае хронической экспозиции к ЭГМЭ основной мишенью является, по-видимому, кровь (макроцитарная анемия, лейкопения, повышение доли лимфоцитов). После прекращения экспозиции гематологические изменения нормализуются.
У двух пациентов, принявших внутрь 100 мг ЭГМЭ, после бессимптомного периода длительностью 8 — 18 ч развились помрачение сознания, тошнота и слабость. Затем у них были отмечены тяжелый метаболический ацидоз, тахипноэ, повышенный сывороточный уровень креатинина и выраженная оксалурия.
Оба выздоровели после внутривенного введения бикарбоната натрия и этилового спирта. В другом случае производственный контакт кожи с ЭГМЭ в течение примерно 6 мес привел работников к энцефалопатии, сопровождавшейся анемией, лейкопенией и тромбоцитопенией.
— Моноэтиловый эфир этиленгликоля (ЭГЭЭ). Примерно 23 % всосавшегося ЭГЭЭ выводится с мочой. Экспозиция к ЭГМЭ и ЭГЭЭ на рабочем месте приводила к некоторому уменьшению размера семенников у людей без заметных изменений плодовитости.
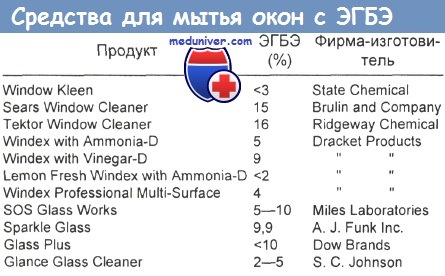
— Бутиловый эфир этиленгликоля (ЭГБЭ). Бутиловый эфир этиленгликоля (ЭГБЭ) входит в состав коммерческих средств для мытья стекол. Все дети в возрасте от 7 мес до 9 лет, выпившие от 5 до 300 мл жидкости, содержащей ЭГБЭ (0,5—9,9 %), выздоровели.
Прием внутрь ЭГБЭ чреват комой, гипотензией, метаболическим ацидозом, поражением почек, гематурией, гемолизом, оксалурией и некардиогенным отеком легких. Пациенты выздоравливают, получая симптоматическое и поддерживающее лечение.
ЭГБЭ всасывается через кожу, легкие и в пищеварительном тракте. Период полувыведения короткий (40 мин). С участием алкогольдегидрогеназы ЭГБЭ окисляется в печени. Основной его метаболит — бутоксиуксусная кислота, вызывающая метаболический ацидоз и, возможно, гемолиз. Терапия этанолом или 4-метилпиразолом бывает полезной, поскольку эти вещества ингибируют алкогольдегидрогеназу.
Прием внутрь 5—10 мл содержащей ЭГБЭ (0,5—9,9 %) жидкости для мытья стекол/окон детьми в возрасте от 7 мес до 9 лет лечили на дому пероральным введением жидкостей. Пациенты были бессимптомными. Двоим детям, выпившим более 15 мл, провели промывание желудка и госпитализировали их на 24 ч. Гемолиза, угнетения центральной нервной системы, ацидоза и почечной дисфункции не наблюдалось. Судя по накопленным данным, прием внутрь до 10 мл содержащей менее 10 % ЭГБЭ жидкости для мытья стекол/окон можно безопасно лечить простым разведением в домашних условиях. В одном случае взрослый выпил около 500 мл жидкости для мытья окон с 12,7 % по объему ЭГБЭ и 3,2 % по объему этанола. Всосалось у него примерно 200— 250 мл, что соответствует дозе 25—30 г ЭГБЭ.
Пиковый уровень в моче его главного метаболита, бутоксиуксусной кислоты, отмечен приблизительно через 24 ч после экспозиции. Период полужизни ЭГБЭ составил 210 мин. Пострадавший поступил в медицинское учреждение в коме с мидриазом, брадикардией, гипотензией и метаболическим ацидозом с большим анионным дефицитом. На второй день у пациента развились анемия и гематурия, совпавшие с максимальным уровнем бутоксиуксусной кислоты, но оксалурии не отмечалось. Лечение было поддерживающим (интубация, вспомогательная вентиляция, активированный уголь, промывание желудка, форсированный диурез, дофамин); для устранения метаболического ацидоза и удаления токсина и его производных потребовался гемодиализ.
Другой взрослый выпил 250 — 500 мл жидкости для мытья окон, содержащей 12 % ЭГБЭ. После этого у него наблюдались кома, метаболический ацидоз, гипокалиемия, повышенный сывороточный уровень креатинина, заметное усиление экскреции кристаллов оксалата с мочой, анемия и гемоглобинурия.
— Монофениловый эфир этиленгликоля (ЭГФЭ). Чрескожное всасывание в ходе ежедневной экспозиции к примерно 500 мл 2-феноксиэтанола (ЭГФЭ) чревато головной болью, головокружением, невнятной речью, эйфорией, состоянием опьянения, ослаблением чувствительности и силы в пальцах и кистях, забывчивостью и раздражительностью. Может наблюдаться непереносимость алкоголя.
д) Лабораторные данные отравления производными этиленгликоля. Мониторинг выведения с мочой соответствующих алкоксиуксусных кислот может служить полезным индикатором экспозиции человека к эфирам этиленгликоля. У трех мужчин, контактировавших с ЭГЭЭ, максимальное выведение этоксиуксусной кислоты наблюдалось через 3 — 4 ч, а период биологической полужизни вещества в моче составил 21 — 24 ч.
— Аналитические методы. Применяемый сейчас чувствительный метод определения бутоксиуксусной (БУК) и других алкоксиуксусных кислот основан на экстракции ионных пар с капиллярной газовой хроматографией и детекцией путем захвата электроном. Нижний предел выявления вещества этим методом составляет около 0,05 ммоль/л, а практической количественной оценки его содержания — примерно 7 мкмоль/л.
Для анализа на БУК достаточно одной пробы мочи объемом 0,2 мл. Существенное повышение уровня ЭГБЭ в крови и моче с выраженным ослаблением экскреции БУК наблюдается после введения этанола до его концентрации в крови выше 0,3 % перед экспозицией к парам ЭГБЭ концентрацией 20 млн-1 в течение 2 ч.
е) Лечение отравления:
1. Диагноз ставят по анамнезу и клинической картине. Характерные признаки острой интоксикации эфиром этиленгликоля — угнетение центральной нервной системы и метаболический ацидоз, сходные с симптомами отравления метанолом, этиленгликолем, паральдегидом, железом, изониазидом, салицилатами, цианидом, сероводородом и угарным газом, а также диабетического и алкогольного кетоацидоза, почечной недостаточности и лактат-ацидоза.
2. Эфиры этиленгликоля быстро всасываются. Если промывание желудка не провести в кратчайшие сроки после приема токсина внутрь, оно будет неэффективным.
3. Сироп ипекакуаны противопоказан в связи с возможностью быстрого развития комы и риском аспирации.
4. Активированный уголь, вероятно, неэффективен в плане связывания эфиров этиленгликоля в пищеварительном тракте, поскольку он вообще плохо адсорбирует спирты и гликоли низкой молекулярной массы.
6. К применяемым по показаниям поддерживающим мерам относятся обеспечение проходимости дыхательных путей, вспомогательное дыхание и стимуляция сердечно-сосудистой функции инфузионной терапией и сосудосуживающими средствами.
7. При тяжелом некупируемом ацидозе или почечной недостаточности может быть полезен гемодиализ, однако исследований с контролем для подтверждения этого предположения не проводилось.
8. Вероятность летального исхода низка. Токсичные производные ЭГБЭ, возникающие при его окислении алкогольдегидрогеназой, могут привести к поздней интоксикации. Поэтому лицам, принявшим внутрь высокую дозу ЭГБЭ, надо как можно быстрее начать этанолотерапию. Если симптомов отравления не развивается, а анионный и осмоляльный дефициты остаются нормальными, ее можно прекратить. При интоксикации ЭГБЭ осмоляльный дефицит обычно в пределах нормы. Чтобы произошло его заметное повышение, необходимы крайне высокие, клинически маловероятные концентрации эфиров этиленгликоля.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
МОНОИЗОБУТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ (БУТИЛЦЕЛЛОЗОЛЬВ): характеристики, ПДК, методики
Характеристики вещества в каталоге загрязняющих веществ от группы компаний «Лаборатория».
Химическое название вещества по IUPA : 2-бутоксиэтанол.
Структурная формула : С4Н9OC2H4OH
Синонимы : монобутиловый эфир этиленгликоля; бутилгликоль; 2-Butoxyethanol; Ethanol, 2-butoxy-; Butoxyethanol, 2-; Ethylene glycol monobutyl ether.
Код загрязняющего вещества : 1110
Агр.состояние : жидкость/газ
Класс опасности : 1110
ОБУВ (ориентировочный безопасный уровень воздействия): –
ЛОС : –
РПОХВ : ВТ-000374
CAS : 111-76-2
RTECS : KJ8575000
EC : 203-905-0
ПДК м.р. (предельно допустимая концентрация в атмосферном воздухе максимальная разовая): 0,500 (ОБУВ) мг/м³
ПДК с.с. (предельно допустимая концентрация в атмосферном воздухе среднесуточная): 0,500 (ОБУВ) мг/м³
Лимитирующий показатель : 0,500 (ОБУВ)
Класс опасности : 0,500 (ОБУВ)
ПДК р.з. (предельно допустимая концентрация в воздухе рабочей зоны максимальная разовая): 5 мг/м³
Класс опасности : 3
Особенности действия на организм : –
Применяется на производствах : химическая, металлургическая, нефтегазовая промышленность. Лабо- раторное дело.
Диапазоны определения вещества «МОНОИЗОБУТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ (БУТИЛЦЕЛЛОЗОЛЬВ)» в промышленных выборсах, воздухе рабочей зоны, атмосферном воздухе различаются и определяются методиками исследования. Список методик смотрите ниже.
Бутилдигликоль
 | Растворители Европейского производства | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вещество: | бутилдигликоль | |||||||||||||||||||||||||||
| Синонимы: | ||||||||||||||||||||||||||||
| Молекулярный вес: | 162,2 г/моль |
| Температура кипения: | 230 °С при 760 мм рт.ст |
| Температура вспышки (закрытый тигель): | 99 °С |
| Температура самовоспламенения: | 228 °С |
| Температура замерзания: | -68 °С |
| Плотность: | 0,952 г/см3 при 20 °С |
| Вязкость: | 4,9 мПа.с при 25 °С |
| Поверхностное натяжение: | 30,0 Дин/см при 25 °С |
| Давление паров: | 0,04 мбар при 20 °С |
| Растворимость: | Растворитель в воде: полная Вода в растворителе: полная |
| Теплота испарения: | 276 Дж/г |
| Теплота сгорания: | 28,7 кДж/г |
| Показатель испарения: | (н-бутилацетат = 1): 0,004 (диэтиловый эфир =1) >1200 |
| Пределы взрываемости: | Нижний (измеренный при 170 °С): 0,85 % в воздухе Верхний (измеренный при 180 °С): 24,6 % в воздухе |
Опасность для человека
Практически не токсичен при однократном оральном приеме. Практически не токсичен при
однократном контакте с кожей.
LD50 крыса (орально): > 2.000 mg/kg
LD50 кролик (кожный): > 2.000 mg/kg
Первичное раздражение слизистой оболочки кролик: не раздражает (Test-BASF)
Пожарная опасность
Бутилдигликоль не относят к классу легковоспламеняемых жидкостей, продукт поддерживает горение в атмосфере.
Оценка водной токсичности
С большой степенью вероятности продукт не является сильно опасным для водных организмов. При правильном введении незначительных концентраций в адаптированные биологические очистные установки можно избежать снижения разлагающего действия активного ила.
| Токсичность для рыб: | LC50 (96 h) 1.300 mg/l, Lepomis macrochirus Библиографическая ссылка. |
| Водные беспозвоночные: | (48 h) > 100 mg/l, дафния/Daphnia magna Библиографическая ссылка. |
| Водные растения (водоросли): | EC50 (96 h) > 100 mg/l, зеленые водоросли Библиографическая ссылка. |
| Микроорганизмы/ воздействие на активный ил: | EC50 (18 h) 1.170 mg/l, Pseudomonas putida Библиографическая ссылка. |
| Оценка биораспада и элиминации (H2O): | — |
При правильном введении незначительных концентраций в адаптированные биологические очистные установки можно избежать снижения разлагающего действия активного ила.
EC10 (30 min) > 1.995 mg/l, (аэробный)
Описание
Медленноиспаряющийся гидрофильный гликолевый эфир с превосходной связывающей и коалесцирующей способностью.
Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт .
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
Строение этиленгликоля
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Получение этиленгликоля
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).