Моносомия по хромосоме 16 что это такое у эмбриона
Моносомия по хромосоме 16 что это такое у эмбриона
Проблема невынашивания беременности является актуальной и социально значимой. Причины невынашивания беременности многочисленны. Они могут быть вызваны генетическими (генные, геномные и хромосомные мутации, иммунологическая несовместимость) и негенетическими (заболевания матери, химические и физические воздействия) факторами [5]. Известно, что 10–15 % клинически диагностированных беременностей останавливаются в развитии на ранних этапах эмбриогенеза. Около 50 % случаев ранней остановки развития и внутриутробной гибели эмбриона обусловлено хромосомными аномалиями, такими как аутосомные трисомии, полиплоидия, моносомия Х хромосомы и несбалансированные структурные перестройки [5,9]. Большинство из этих отклонений являются спорадическими и возникают de novo. Генетический анализ тканей плода имеет большое значение для установления основной причины невынашивания беременности, выбора дальнейшей тактики обследования женщины, планирования и наблюдения последующих беременностей [4,8].
В настоящей работе для определения хромосомного статуса эмбриона при репродуктивных потерях использован метод метафазной сравнительной геномной гибридизации (comparative genomic hybridization – CGH), который также называют «молекулярным кариотипированием». Этот метод позволяет провести анализ всего генома в рамках одного исследования.
CGH-анализ основан на одновременной гибридизации опытной и контрольной (полученной от нормального индивидуума) ДНК, меченных двумя разными флюорохромами, на хромосомный препарат из культуры лимфоцитов здорового донора. Путем сравнения относительной интенсивности флюоресценции двух флюорохромов по всей длине каждой хромосомы выявляется геномный дисбаланс в виде дупликации или делеции [1,2]. Ограничением применения CGH для анализа тканей плода при репродуктивных потерях является неинформативность этого метода при кратном увеличении генома (триплоидия, тетроплодия). Чтобы преодолеть это ограничение и повысить эффективность анализа, в дополнение к CGH мы использовали интерфазную флуоресцентную in situ гибридизацию (FISH) с ДНК-зондами на центромерные районы хромосом 18, Х и Y в интерфазных ядрах для определения плоидности [3,9].Такой подход позволяет выявить практически все числовые и несбалансированные структурные хромосомные перестройки размером более 4 м.п.н., в том числе ассоциированные с репродуктивными потерями, а также избежать трудности, связанных с получением хромосомных препаратов для цитогенетического анализа.
Оценка эффективности выявления и определение спектра ХА методами молекулярного кариотипирования.
Материалы и методы
Исследовано 146 образцов ткани хориона (плаценты), полученных после прерывания беременности. Показаниями для прерывания являлись: неразвивающаяся беременность (n=131), анэмбриония (n=8) и врожденные пороки у плода, ВПР (n=7) в сроке от 4 до 20 недель беременности. Средний возраст женщин составил 32,3±4.6 года.
Во всех случаях хорион был визуально оценен, тщательно отобран от материнских тканей и отмыт от примесей крови.
От каждого образца 5–10 мг ворсин хориона использовали для получения отпечатков ткани с последующей обработкой [6]. Из остального материала выделяли ДНК методом экстракции фенол-хлороформом для проведения сравнительной геномной гибридизации.
ДНК плода (опытная) и референсная ДНК (контрольная) мечены в реакции ник-трансляции SpectrumGreen dUTP и SpectrumRed dUTP (AbbottMolecular, США) по стандартному протоколу [2]. Платформой для совместной гибридизации опытной и референсной ДНК служили хромосомные препараты из культуры лимфоцитов периферической крови доноров – мужчин с нормальным кариотипом. Реакцию сравнительной геномной гибридизации и постгибридизационную отмывку проводили по протоколу фирмы производителя (AbbottMolecular, США). Для контрокрашивания хромосом использовали DAPI I (AbbottMolecular, США) в растворе Vectashield (VectorLabs, США) в соотношении 1:20.
Анализ изображений метафазных хромосом проводили на эпифлуоресцентном микроскопе «Eclipse90i» (Nikon, Япония), оборудованном CCD камерой «ProgResMF» (JENOPTIK) и программой обработки изображения «LuciaCGH» (Чехия). Для каждого образца анализировали 10–15 метафазных пластинок.
FISH анализ интерфазных ядер с ДНК зондами: SE2 (D2Z2), SE4 (D4Z1), SE10 (D10Z1), SE 15 (D15Z4), SE 16 (D16Z2), SE18 (D18Z1), SE 20 (D20Z1), SE (XY18), SE (X,Y), PN13 (13q14), PN 21 (21q22), Sub-Telomere5qter (D5S2006), Sub-Telomere 6qter (D6S2523), Sub-Telomere9pter (D9S917), Sub-Telomere9qter (D9S1838), Sub-Telomere11qter (D11S4437), Sub-Telomere20pter (D20S1156), Sub-Telomere 20qter (RH44234), Sub-Telomere22qter (D22S1056) (Kreatech, Нидерланды) проводили по протоколам фирмы – производителя. Анализ осуществляли на эпифлуоресцентном микроскопе «AxioImagerM.1» (CarlZeiss, Германия) c соответствующим набором светофильтров и с использованием компьютерной программы обработки цифровых изображений «Isis» (MetaSystems, Германия).
Результаты и обсуждение
Из всех образцов хориона получено достаточное для анализа количество ДНК, и проведена сравнительная геномная гибридизация.
При отсутствии хромосомного дисбаланса плоидность определяли при проведении FISH с ДНК зондами на центромерные районы хромосом 18, Х и Y. Все случаи обнаружения дисбаланса при CGH подтверждались с помощью интерфазной FISH с соответствующими локус-специфичными или центромерными зондами.
Из 146 наблюдений, хромосомный и геномный дисбаланс не обнаружен в 71 случае, что составило 48,6 %. Различные ХА выявлены в 75 случаях. Таким образом, частота ХА при невынашивании беременности составила 51,4 %. Спектр выявленной хромосомной патологии включал практически все типы ХА, приводящие к антенатальной гибели плода, кроме моносомии по аутосомам и тетраплоидии (табл. 1).
Среди 75 случаев хромосомной патологии в 58,7 % (44 образца) выявлена трисомия по аутосомам. Триплоидия определена в 22,7 % случаев (n=17), из них: в 9 случаях дигенического (ХХХ), а в 8 – диандрического (ХХY) происхождения. Моносомия Х диагностирована в 7 наблюдениях (9,3 % от всех ХА). Сочетанная хромосомная патология выявлена в 3 наблюдениях (4 % от всех ХА) и представлена двойной трисомией по хромосомам 9 и 16, моносомией Х в сочетании с трисомией по 22 хромосоме и моносомией Х с частичной трисомией 6q.
Геномный дисбаланс в виде делеции и/или дупликации терминальных районов хромосом диагностированы в 4 наблюдениях (5,3 %) при наличии ВПР у плода. В 2 случаях, при частичной трисомии по длинному плечу хромосомы 20 у плода и частичной трисомии по длинному плечу хромосомы 22/частичной моносомии по длинному плечу хромосомы 11 установлено, что причиной аномального фенотипа у плода являлся геномный дисбаланс вследствие патологической мейотической сегрегации хромосом при аутосомной реципрокной транслокации у родителя-носителя – 46,XY,t(16;20)(p13.3;q13.13) и 46,XX,t(11;22)(q23.3;q12.2), соответственно. Важно отметить, что в случае t(16;20)(p13.3;q13.13) при CGH не выявлена делеция района 16q13.3-qter из-за ограничения разрешающей способности метода, поскольку размер транслоцированного сегмента не превышает 4 млн.п.н. Тем не менее информация, полученная при исследовании абортного материала методом CGH, позволила установить сбалансированную транслокацию у отца, когда дериватная хромосома 16 обнаружена при таргетной FISH с ДНК-зондом на субтеломерный район длинного плеча хромосомы 20. В остальных двух случаях установить происхождение хромосомной аномалии у плода оказалось невозможным.
Результаты использования методов метафазной CGH и FISH анализа для исследования материала неразвивающихся беременностей (n = 146)
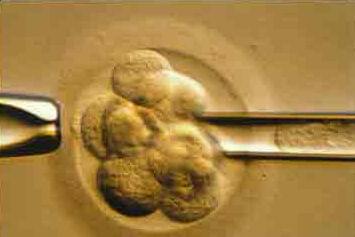
Преимплантационный генетический анализ эмбрионов
Каждая из 100 триллионов клеток в организме человека (за исключением красных кровяных клеток) содержит весь человеческий геном. Хромосомы – это струноподобные элементы внутри ядра (в центре) каждой клетки вашего тела. Они содержат генетическую информацию, ДНК. Ген занимает определенное место на хромосоме. В норме, есть 23 идентичных пары хромосом (2 метра ДНК) в каждой клетке, в общей сложности 46 хромосом. Каждый партнер во время оплодотворения обычно предоставляет 23 хромосомы. Если яйцеклетка или сперматозоид имеют аномальную упаковку хромосом, эмбрион, который они создают, также будет иметь хромосомные аномалии. Иногда это связано с перестройкой хромосом, или недостатком части хромосомы. В некоторых случаях есть отсутствующие хромосомы, или дополнительная хромосома (анеуплоидии), ведущие к наследственным заболеваниям. Любой эмбрион, в котором отсутствует хромосома (моносомия) перестанет расти до имплантации (фатальная аномалия). Если анеуплоидии включают хромосомы 13, 18, 21, Х или Y, беременность может дойти до родов. Наиболее распространенной из этих несмертельных аномалий является трисомия 21, или синдром Дауна, при которой присутствует дополнительная 21-я хромосома. Другие включают синдром Тернера у женщин и синдром Клайнфельтера у мужчин.
История преимплантационной генетической диагностики (ПГД)
Первые живорождения после ПГД были зарегистрированы в Лондоне в 1989 году. Две двойни девочек-близнецов родились от пяти пар с риском передачи связанного с Х-хромосомой заболевания. В настоящее время с помощью методов генетического анализа или ПГД могут быть обнаружены около 90% аномальных эмбрионов. Не все хромосомные или генетические заболевания могут быть определены этими процедурами, так как в ходе одной процедуры может быть диагностировано только ограниченное число хромосом. Многочисленные исследования на животных и некоторые исследования на человеке показывают, что микрохирургия эмбриона (биопсия), необходимая для удаления клеток, не влияет на нормальное развитие ребенка. Эта процедура, однако, была выполнена относительно небольшому числу пациентов во всем мире, поэтому точные негативные последствия, если таковые имеются, неизвестны. Несмотря на то, что после генетического анализа для выявления анеуплоидии всем мире на сегодняшний день было рождено уже много детей, эта процедура все еще относительно нова. В исследованиях на животных не было обнаружено никаких очевидных проблем и предварительные данные с эмбрионами человека позволяют предположить справедливость этого вывода. В исследовании, проведенном в Университетском колледже Лондона, исследователи недавно рассмотрели 12 преимплантационных эмбрионов с новой техникой, которая сочетает в себе амплификацию всего генома (WGA) и сравнительную гибридизацию генома (CGH). В результате в 8 из 12 изученных эмбрионов были обнаружены значительные хромосомные аномалии. Это может объяснить, почему люди имеют в лучшем случае 25% шансов на достижение жизнеспособной беременности в месяц при естественном зачатии.
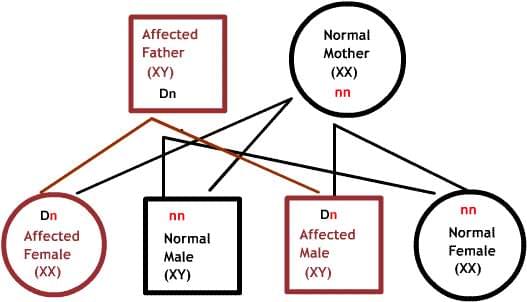
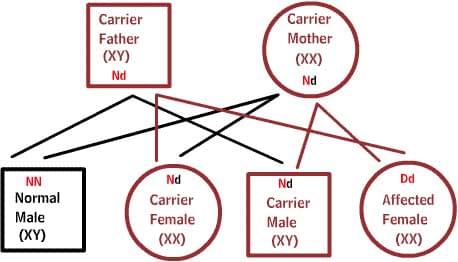
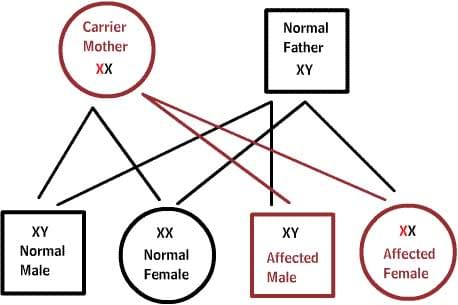
Как передаются по наследству генетические заболевания
В диаграммах ниже, D или d представляет дефектный ген, а N или n представляет нормальный ген. Мутации не всегда приводят к болезни.
Доминантные заболевания:
Один из родителей имеет один дефектный ген, который доминирует над своей нормальной парой. Так как потомки наследуют половину своего генетического материала от каждого из родителей, есть 50% риск наследования дефектного гена, и, следовательно, заболевания.
Рецессивные заболевания:
Оба родителя являются носителями одного дефектного гена, но при этом имеют нормальную пару гена. Для наследования заболевания необходимы две дефектных копии гена. Каждый потомок имеет 50% шанс быть носителем, и 25% шанс унаследовать заболевание.
X-сцепленные заболевания:
Нормальные женщины имеют XX хромосомы, а нормальные мужчины XY. Женщины, которые имеют нормальный ген на одной из Х-хромосом, защищены от дефектного гена на их другой Х-хромосоме. Однако, у мужчины отсутствует такая защита в связи с наличием только одной Х-хромосомы. Каждый мужской потомок от матери, которая несет в себе дефект, имеет 50% шанс унаследовать дефектный ген и заболевание. Каждый женский потомок имеет 50% шанс быть носителем, как и ее мать. (на рисунке ниже X представляет нормальный ген а X представляет дефектный ген)
Возможные преимущества генетического анализа
Преимплантационная генетическая диагностика позволяет отобрать и перенести не измененные (хромосомно нормальные) эмбрионы, которые могут привести к большей частоте имплантации на эмбрион, сокращению потерь беременности и рождению большего числа здоровых детей. Генетическая диагностика предлагает парам альтернативу мучительному выбору по поводу того, чтобы прервать пострадавшую беременность после пренатальной диагностики, производимой путем амниоцентеза или биопсии ворсин хориона (CVS) на более поздних стадиях беременности. Почти все генетически связанные заболевания, которые могут быть диагностированы в перинатальном периоде либо амниоцентезом или CVS, могут быть обнаружены и ПГД. Процедура должна уменьшить психологическую травму для пар, которые несут повышенный риск генетических заболеваний для потомства.
Преимущества преимплантационной генетической диагностики (ПГД) могут включать в себя:
Возможные риски генетического анализа
Кандидаты для биопсии эмбриона и ПГД
Кандидаты для биопсии эмбриона и ПГД включают в себя:
Пары с повторными неудачами ЭКО.
Используемые методы
Для анализа на наличие генетических дефектов эмбриона, из него необходимо удалить либо первое полярное тельце из неоплодотворенной яйцеклетки и/или 1 или 2 клетки от каждого эмбриона. Это называется биопсией яйцеклетки или эмбриона и обычно делается перед тем, как происходит оплодотворение, или через 3 дня после оплодотворения. Биопсия на 6-10 клеточной стадии не оказывает отрицательного влияния на преимплантационное развитие. На этом этапе каждая клетка имеет полный набор хромосом. Обычно из эмбриона удаляется только одна клетка, так как ожидается, что будут одинаковыми со всеми другими клетками в эмбрионе. Иногда необходимо удалить вторую клетку из эмбриона, например, если сигнал в первой не обнаружен. Для диагноза предрасположенности с помощью первого и второго полярных телец, как показателей генетического статуса яйцеклетки, используется анализ методом FISH. Недостатком анализа полярных телец заключается в том, что он не принимает во внимание отцовские анеуплоидии.
Анализ биопсированной клетки использует один из двух методов:
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Предимплантационный скрининг и хромосомные нарушения
Предимплантационный генетический скрининг (ПГС) представляет собой метод диагностики ЭКО-эмбрионов с целью обнаружения у них хромосомной патологии. Возможны сбои как в количестве хромосом эмбриона, так и в их распределении. Необходимо помнить, что ПГС не предназначен для выявления носительства конкретных генетических болезней, в отличие от ПГД.
В последнее время активно применяется новейший метод исследования хромосомных нарушений плода – неинвазивная пренатальная диагностика (НПД / NIPT). Данный метод позволяет выявить анеуплодии у плода лишь с использованием венозной крови матери, т.е. без какого-либо воздействия на плод. Эффективность НПД очень высока, составляя 90-99%, и его применение возможно уже с 10 недели беременности.
Что такое анеуплоидии?
Человеческая яйцеклетка в большинстве случаев является носителем хромосомного набора с патологией, и процент таких ненормальных яйцеклеток увеличивается с возрастом женщины. В общей сложности, порядка 50% человеческих эмбрионов имеют тот или иной тип хромосомной аномалии, говоря медицинским языком – анеуплоидии.
Анеуплоидия переводится с греческого языка как «не полностью кратный вид», т.е. это явление, при котором изменяется число хромосом в клетках организма. В норме каждый человек является носителем диплоидного (двойного) набора хромосом, состоящего из аутосом – 22 пары и половых хромосом – 2 штуки, в соматических клетках. В половых клетках (гаметах) человека содержится гаплоидный (одинарный) набор хромосом, который в момент оплодотворения превращается в диплоидный набор.
Анеуплоидии в сторону уменьшения количества хромосом, т.е. отсутствие 1 хромосомы в любой из хромосомных пар, называются моносомией. В большинстве случаев из-за отсутствия аутосомы у плода развиваются пороки не совместимые с жизнью, приводящие либо к его внутриутробной гибели, либо к спонтанному выкидышу.
Вследствие анеуплоидии хромосомный набор может также увеличиваться, приводя к явлению полисомии (полиплоидии) в виде трисомии – добавляется одна хромосома, тетрасомии – добавляются две хромосомы и пентасомии – добавляются три хромосомы. Данная патология, как правило, так же не совместима с жизнью, но есть некоторые виды этих нарушений, с которыми рождаются детки.
Показания к предимплантационной генетической диагностике
В настоящее время сфера предимплантационной генетической диагностики и скрининга является одной из самых динамично развивающихся областей репродуктивной медицины.
Данное исследование может быть рекомендовано для выявления анеуплоидии в следующих случаях:
В заключение хочу сказать, что даже в ситуации неблагоприятной наследственности Вы можете стать родителями малыша, который будет здоров с высокой долей вероятности. Помогут Вам в этом предимплантационный генетический скрининг ЭКО-эмбрионов и неинвазивная пренатальная диагностика материнской крови.
Что такое мозаичный эмбрион?
Преимплантационное генетическое тестирование эмбрионов на анеуплоидии (PGT-A) – это генетический анализ, который используется для повышения успешности ЭКО путем получения информации о хромосомном здоровье эмбриона.
Эмбрионы с правильным набором хромосом 46 – (эуплоидные) имеют больше шансов на имплантацию и развитие успешной беременности, чем эмбрионы с неправильным набором хромосом (анеуплоидные). У здорового человека в клетках 46 хромосом. На самом деле у нас есть две пары каждой хромосомы, одну из которых мы получаем от нашей биологической матери, а другую – от нашего биологического отца.
PGT-A проводится по причине того, что у анеуплоидных эмбрионов очень высока вероятность неудачной имплантации или прерывания беременности.
Вероятность получения анеуплоидного эмбриона увеличивается с возрастом.
Бывают такие варианты, когда из пары хромосом присутствует только одна хромосома – моносомия. Или же наоборот, вместо 2 хромосом, их 3, что называется трисомией. В результате преимплантационного генетического тестирования, эмбрион, у которого есть такие хромосомные изменения, называется анеуплоидным.
Однако недавние достижения в технологии PGT-A выявили третий вариант результатов PGT-A, которые находятся где-то посередине. Такой вариант, получивший название мозаичных эмбрионов (содержит сочетание анеуплоидных и эуплоидных клеток). Причина в том, что секвестирование ДНК для тестирования PGT стало более продвинутым и более чувствительным. Эта обновленная технология известна как NGS (следующее поколение секвестрования).
Теперь мы стали видеть более мелкие детали, тогда как раньше это было невозможно.
Сейчас можно услышать — «40% мозаика», что означает, что 40% клеток анеуплоидные, а 60% – эуплоидные (по данным биопсии).
Мозаицизм не обязательно присутствует во всем эмбрионе, он может быть только в определенных его участках. При биопсии эмбриона (бластоцисты) берутся клетки трофэктодермы (ТЭ), которыя в будущем формируют плаценту, а внутриклеточную массу (ВКМ), из которой будет формироваться плод, не затрагивают.
Мы должны помнить, что мозаицизм, выявленный в образце трофэктодермы, не всегда указывает на наличие мозаицизма в внутриклеточной массе, что, в свою очередь, не приводит к появлению мозаицизма у самого плода.
Какая частота мозаичных эмбрионов по данным PGT–A?
Мозаика встречается примерно у 15-90% эмбрионов на стадии дробления и у 30-40% бластоцист (5-ти суточной стадии развития эмбриона) (Spinella et al. 2018), возникает с одинаковой частотой независимо от возраста (Munne et al., 2017), от всех протестированных эмбрионов методом PGT-A.
Очевидно, что эуплоидные эмбрионы – имею выше шанс достичь наступления успешной беременности. В этом случае наиболее частый вопрос, который пациенты задают при получении результатов PGT-A: «Как влияет этот мозаичный результат на беременность или ребенка?».
Ответ сложен. Хотя мозаицизм существовал всегда, его можно было обнаружить только в течение нескольких лет, поэтому последующие исследования все еще продолжаются.
Тем не менее есть некоторые руководящие принципы и рекомендации профессионального медицинского сообщества.
Почему происходит мозаицизм эмбриона?
Причина возникновения полностью анеуплоидных эмбрионов является ошибка мейоза в яйцеклетке или сперматозоиде, и эта ошибка затем переносится в каждую клетку эмбриона.
В мозаичных эмбрионах ошибка возникает после оплодотворения, поражаются только те клетки, которые происходят от клетки с нарушением при ее делении. Важен тот факт, что уровень мозаицизма напрямую зависит от времени митотической ошибки. Если ошибка произойдет в ранней фазе деления клеток, тогда будет затронуто больше клеток, чем если бы это произошло на более позднем этапе.
Вероятно, мозаицизм эмбриона может быть результатом быстрого деления клеток и расслабления «контрольных точек», характерных для раннего развития эмбриона, и что это переходная фаза во время развития (McCoy 2017).
Для проведения PGT-A эмбриолог проводит получение, как правило, около 5-8 клеток у эмбриона на стадии бластоцисты, что для эмбриона полностью безопасным.
И так в образце биопсии для PGT-A если 5 из 5 клеток являются эуплоидными, то эмбрион является эуплоидным.
Соответственно, при проведении тестирования 5 клеток, мозаицизм минимально может составить 20% (1 из 5 клеток), а самый высокий показатель может быть 80% (4 из 5 клеток).
Международное общество по преимплантационной генетической диагностике (PGDIS) по выполнению PGT-A, рекомендуют классифицировать результаты следующим образом:
Рекомендации по переносу мозаичных эмбрионов
Международное собщество по преимплантационной генетической диагностике (PGDIS) рекомендовало отдавать приоритет мозаичным эмбрионам для переноса в зависимости от уровня мозаицизма и конкретной задействованной хромосомы.
Поскольку мозаицизм – относительно новый термин, по этой теме не так много данных, большинство рекомендаций сводятся к тому, что при переносе мозаичного эмбриона важно смотреть, какие хромосомы затронуты и могут ли быть связанные синдромы:
Grati et al. (2018) установили основные рекомендации в зависимости от вовлеченности конкретной хромосомы, оценили каждую из трисомий мозаичного эмбриона.
Приоритетные рассмотрения:
Какой показатель успешности мозаичных эмбрионов при переносе?
Показатели успешности мозаичных эмбрионов следует оценивать в зависимости от % мозаицизма (какой процент клеток у эмбриона содержит анеуплоидию).
Munne et al. (2017): 56% развивающаяся беременность (если мозаицизм 20-40%) при 22% развивающейся беременности (если мозаицизм > 40%);
Spinella et al. (2018): 42% живорождений (при 50% мозаичных эмбрионах). Частота выкидышей одинакова в обеих группах.
Мозаицизм низкого уровня может иметь сравнимый успех с переносом эуплоидных эмбрионов.
Важным показателем является репродуктивный возраст женщины при переносе мозаичного эмбриона.
Виктор и др. (2019) обнаружили, что возможность имплантации мозаичных эмбрионов может уменьшаться с возрастом – с 56% у женщин моложе 34 лет до 27% у женщин старше 34 лет.
Авторы предполагают, что такие показатели могут быть по причине того, что самокоррекция более эффективна в более молодом репродуктивном возрасте.
Что такое самокоррекция эмбриона? Что происходит с анеуплоидными клетками в мозаичном эмбрионе?
Большинство мозаичных эмбрионов становятся полностью анеуплоидными или эуплоидными к 12 дню развития (Popovic et al. (2019).
Способность исправлять себя можно объяснить следующим образом: в мозаичном эмбрионе клетки с анеуплоидией могут делиться медленнее, истощаться и погибнуть с большей вероятностью в сравнении с хромосомно здоровыми (эуплоидными) клетками, которые растут быстрее.
Но если анеуплоидных клеток слишком много, они могут вытеснить эуплоидные клетки и привести к остановке развития эмбриона либо к дальнейшему развитию эмбриона с не правильным набором хромосом.
Аномальные клетки могут перемещаться в трофэктодерму (будущую плаценту), в то время как эуплоидные клетки сосредотачиваться во внутриклеточной массе (клетки из которых происходит развитие эмбриона). На самом деле это способ самокоррекции, который мозаичный эмбрион может использовать для удаления измененных клеток из ВКМ.
Существует вероятно определенный порог, при котором такая самокоррекция может происходить.
Является ли мозаицизм с моносомией приоритетным для переноса эмбриона?
Отсутствие хромосомы (моносомия) у эмбриона редко приводит к развитию беременности и рождению ребенка (за исключением отсутствия одной X половой хромосомы) – синдром Тернера (кариотип 45 X0). Эмбрион не может иметь только одну копию хромосомы (это существенная потеря важного генетического материала), что приводит к невозможности развития.
По этим причинам мозаичный эмбрион с моносомией может быть лучшим выбором для переноса.
При переносе эмбриона с моносомией эуплоидные (хромосомно здоровые) клетки вытесняют моносомию, у эмбриона происходит самокоррекция и происходит развитие здоровой беременности.
Второй вариант, если анеуплоидные клетки перерастают, при моносомии, как правило, происходит остановка на раннем этапе развития, имплантация не наступает. Потому, что для развития эмбриона ему нужны две пары хромосом.
Что такое сегментарный мозаицизм?
Сегментарный хромосомный мозаицизм – это изменение, при котором затрагивается только участок (сегмент) хромосомы. Это может происходить на одной хромосоме (одиночная сегментарная мозаика) либо на нескольких хромосомах (множественная сегментная мозаика). Основываясь на данных многих исследований, сегментарные мозаики могут быть сопоставимы с эуплоидными эмбрионами по частоте имплантации (за исключением, возможно, нескольких сегментарных мозаик).
Мозаицизм целой хромосомы – это изменение при которой затрагивается вся хромосома, а не только ее сегмент.
Сложный аномальный эмбрион – это эмбрион, у которого 3 или более измененных хромосомы или хромосомных сегментов.
Мозаицизм целой хромосомы может иметь меньший успех в сравнении с эуплоидными эмбрионами. Fragouli et al. (2017): 13% против 47% живорождений. Таким образом, сегментная мозаика может быть приоритетнее для переноса эмбриона, чем мозаицизм целой хромосомы.
Сложные аномальный мозаицизм имеет меньший шанс успеха по сравнению с эуплоидными эмбрионами. Munne et al. (2017): 10% против 40% развивающихся беременностей на перенос эмбриона.
Как видно, при принятии правильного решения о переносе мозаичного эмбриона, важна грамотное консультирование репродуктолога, генетическое консультирование пары для достижения успешной, безопасной беременности и рождения здорового малыша в семье.