Мышечный катаболизм что это
Основные закономерности метаболических процессов в организме человека. Часть 1.
Метаболизм – обмен веществ и энергии — представляет собой по классическим определениям, с одной стороны, обмен веществами и энергией между организмом и окружающей средой, а, с другой стороны, совокупность процессов превращения веществ и трансформации энергии, происходящих непосредственно в самих живых организмах. Как известно, обмен веществ и энергии является основой жизнедеятельности организмов и принадлежит к числу важнейших специфических признаков живой материи. В обмене веществ, контролируемом многоуровневыми регуляторными системами, участвует множество ферментных каскадов, обеспечивающих совокупность химических реакций, упорядоченных во времени и пространстве. Данные биохимические реакции, детерминированные генетически, протекают последовательно в строго определенных участках клеток, что, в свою очередь обеспечивается принципом компартментации клетки. В конечном итоге в процессе обмена поступившие в организм вещества превращаются в собственные специфические вещества тканей и в конечные продукты, выводящиеся из организма. В процессе любых биохимических трансформаций освобождается и поглощается энергия.
Клеточный метаболизм выполняет четыре основные специфические функции, а именно: извлечение энергии из окружающей среды и преобразование ее в энергию макроэргических (высокоэнергетических) химических соединений в количестве, достаточном для обеспечения всех энергетических потребностей клетки; образование из экзогенных веществ промежуточных соединений, являющихся предшественниками высокомолекулярных компонентов клетки; синтез из этих предшественников белков, нуклеиновых кислот, углеводов, липидов и других клеточных компонентов; синтез и разрушение специальных биомолекул, образование и распад которых связаны с выполнением специфических функций данной клетки.
Поскольку первоначальные представления об обмене веществ возникли в связи с изучением процессов обмена между организмом и внешней средой и лишь впоследствии эти представления расширились до понимания путей трансформации веществ и энергии внутри организма, до настоящего времени принято выделять соответственно внешний, или общий, обмен веществ и внутренний или промежуточный, обмен веществ. В свою очередь как во внутреннем, так и во внешнем обмене веществ различают структурный (пластический) и энергетический обмен. Под структурным обменом понимают взаимные превращения различных высоко- и низкомолекулярных соединений в организме, а также их перенос (транспорт) внутри организма и между организмом и внешней средой. Под энергетическим обменом понимают высвобождение энергии химических связей молекул, образующейся в ходе реакций и ее превращение в тепло (большая часть), а также использование энергии на синтез новых молекул, активный транспорт, мышечную работу (меньшая часть). В процессе обмена веществ часть конечных продуктов химических реакций выводится во внешнюю среду, другая часть используется организмом. В этом случае конечные продукты органического обмена накапливаются или расходуются в зависимости от условий существования организма, называясь запасными или резервными веществами.
Как указывалось выше совокупность химических превращений веществ, которые происходят непосредственно в организме, начиная с момента их поступления в кровь и до момента выделения конечных продуктов обмена из организма, называют промежуточным обменом (промежуточным метаболизмом). Промежуточный обмен может быть разделен на два процесса: катаболизм (диссимиляция) и анаболизм (ассимиляция). Катаболизмом называют ферментативное расщепление крупных органических молекул, осуществляемое у всех высших организмов, как правило, окислительным путем. Катаболизм сопровождается освобождением энергии, заключенной в химических связях органических молекул, и резервированием ее в форме энергии фосфатных связей молекулы аденозинтрифосфорной кислоты (АТФ). Анаболизм, напротив, представляет собой ферментативный синтез крупномолекулярных клеточных компонентов, таких, как полисахариды, нуклеиновые кислоты, белки, липиды, а также некоторых их биосинтетических предшественников из более простых соединений. Анаболические процессы происходят с потреблением энергии. Процессы катаболизма и анаболизма происходят в клетках одновременно, неразрывно связаны друг с другом и являются обязательными компонентами одного общего процесса — метаболизма, в котором превращения веществ теснейшим образом переплетены с превращениями энергии. Катаболические и анаболические реакции различаются, как правило, локализацией в клетке. Например, окисление жирных кислот до углекислого газа и воды осуществляется с помощью набора митохондриальных ферментов, тогда как синтез жирных кислот катализирует другая система ферментов, находящихся в цитозоле. Именно благодаря разной локализации катаболические и анаболические процессы в клетке могут протекать одновременно. При этом все превращения органических веществ, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогормональными механизмами, придающими химическим процессам нужное направление. В организме человека не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма, допускающий также взаимопревращения между отдельными классами органических веществ. Подобные взаимопревращения диктуются физиологическими потребностями организма, а также целесообразностью замены одних классов органических веществ другими в условиях блокирования какого-либо процесса при патологии.
На второй стадии катаболизма продуктами химических реакций становятся еще более простые молекулы, унифицированные для углеводного, белкового и липидного обмена. по своему типу (гликолиз, катаболизм аминокислот, β-окисление жирных кислот соответственно). Принципиальным является то, что на второй стадии катаболизма образуются продукты, которые являются общими для обмена исходно разных групп веществ. Эти продукты представляют собой ключевые химические соединения, соединяющие разные пути метаболизма. К таким соединениям относятся, например, пируват (пировиноградная кислота), образующийся при распаде углеводов, липидов и многих аминокислот, ацетил-КоА, объединяющий катаболизм жирных кислот, углеводов и аминокислот, a-кетоглутаровая кислота, оксалоацетат (щавелевоуксусная кислота), фумарат (фумаровая кислота) и сукцинат (янтарная кислота), образующиеся при трансформации аминокислот. Продукты, полученные на второй стадии катаболизма, вступают в третью стадию, которая известна как цикл трикарбоновых кислот (терминальное окисление, цикл лимонной кислоты, цикл Кребса). На третьем этапе ацетил-КоА и некоторые другие метаболиты, например α-кетоглутарат, оксалоацетат, подвергаются окислению в цикле ди- и трикарбоновых кислот Кребса. Окисление сопровождается образованием восстановленных форм НАДН + Н+ и ФАДН2. Именно в ходе второй и третьей стадий катаболизма освобождается и аккумулируется в виде АТФ практически вся энергия химических связей подвергнутых диссимиляции веществ. При этом осуществляется перенос электронов от восстановленных нуклеотидов на кислород через дыхательную цепь, сопровождающийся образованием конечного продукта – молекулы воды. Транспорт электронов в дыхательной цепи сопряжен с синтезом АТФ в процессе окислительного фосфорилирования.
В процессе обмена веществ постоянно происходит превращение энергии: потенциальная энергия сложных органических соединений, поступивших с пищей, превращается в тепловую, механическую и электрическую. Энергия расходуется не только на поддержание температуры тела и выполнение работы, но и на воссоздание структурных элементов клеток, обеспечение их жизнедеятельности, роста и развития организма. Тем не менее, только часть получаемой при окислении белков, жиров и углеводов энергии используется для синтеза АТФ, другая, значительно большая, превращается в теплоту. Так, при окислении углеводов 22, 7% энергии химических связей глюкозы в процессе окисления используется на синтез АТФ, а 77, 3% в виде тепла рассеивается в тканях. Аккумулированная в АТФ энергия используемая в дальнейшем для механической работы, химических, транспортных, электрических процессов в конечном счете тоже превращается в теплоту. Следовательно, количество тепла, образовавшегося в организме, становится мерой суммарной энергии химических связей, подвергшихся биологическому окислению. Поэтому вся энергия, образовавшаяся в организме, может быть выражена в единицах тепла — калориях или джоулях.
Общий баланс энергии организма определяют на основании калорийности вводимых пищевых веществ и количества выделенного тепла, которое может быть измерено или рассчитано. При этом надо учитывать, что величина калорийности, получаемая при лабораторной калориметрии, может отличаться от величины физиологической калорической ценности, поскольку некоторые вещества в организме не сгорают полностью, а образуют конечные продукты обмена, способные к дальнейшему окислению. В первую очередь это относится к белкам, азот которых выделяется из организма главным образом в виде мочевины, сохраняющей некоторый потенциальный запас калорий. Очевидно, что калорическая ценность, дыхательный коэффициент и величина теплообразования для разных веществ различны. Физиологическая калорическая ценность (в ккал/г) составляет для углеводов — 4, 1; липидов — 9, 3; белков — 4, 1; величина теплообразования (в ккал на 1 литр потребленного кислорода) для углеводов составляет 5, 05; липидов — 4, 69; белков — 4, 49.
Процесс анаболизма по аналогии с катаболическими процессами также проходит три стадии. При этом исходными веществами для анаболических процессов служат продукты второй стадии и промежуточные соединения третьей стадии катаболизма. Таким образом вторая и третья стадии катаболизма являются в то же время первой, исходной стадией анаболизма и химические реакции, протекающие в данном месте и в данное время, выполняют по сути двойную функцию. С одной стороны, они являются основой завершающего этапа катаболизма, а с другой — служат инициацией для анаболических процессов, поставляя вещества-предшественники для последующих стадий ассимиляции. Подобным образом, например, начинается синтез белка. Исходными реакциями этого процесса можно считать образование некоторых a-кетокислот. На следующей, второй стадии в ходе реакций аминирования или трансаминирования эти кетокислоты превращаются в аминокислоты, которые на третьей стадии анаболизма объединяются в полипептидные цепи. В результате ряда последовательных реакций происходит также синтез нуклеиновых кислот, липидов и полисахаридов. Тем не менее следует подчеркнуть, что пути анаболизма не являются простым обращением процессов катаболизма. Это связано прежде всего с энергетическими особенностями химических реакций. Некоторые реакции катаболизма практически необратимы, поскольку их протеканию в обратном направлении препятствуют непреодолимые энергетические барьеры. Поэтому в ходе эволюции были выработаны другие, специфические для анаболизма реакции, где синтез олиго- и полимерных соединений сопряжен с затратой энергии макроэргических соединений, прежде всего – АТФ.
Статья добавлена 31 мая 2016 г.
Болезни и изменения клеточного метаболизма
Автор
Редакторы
Нейродегенеративные и онкологические болезни — самые распространенные возрастные патологии после болезней сердца и сосудов. Как показывают исследования, эти патологии тесным образом связаны с энергетическим обменом и митохондриальной дисфункцией. Детальное и масштабное изучение изменений клеточного метаболизма при развитии этих патологий способствует разработке более совершенных диагностических инструментов, позволяющих обнаруживать заболевание на самой ранней его стадии.
Биоэнергетика
Спецпроект о клеточном энергетическом метаболизме, работе митохондрий и АТФ, а также о заболеваниях, связанных с нарушениями функций клеточных «батареек».
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Наверное, у каждого, кто начинает знакомиться с удивительной организацией наших клеток, возникает чувство восхищения невероятной сложностью внутриклеточного мира. Каждую секунду в миллиардах наших клеток протекают сложные и строго скоординированные процессы. И одним из таких очень важных процессов является производство в митохондриях главной энергетической молекулы — аденозинтрифосфата, или АТФ. Сегодня уже хорошо известно, что работа митохондрий очень тесно связана со здоровьем и продолжительностью жизни [1]. Митохондрии производят энергию для поддержания жизни, но при этом они же служат основными источниками активных форм кислорода, избыток которых для клеток губителен.
Энергетический обмен
Любой живой организм находится в постоянной связи с окружающей средой, непрерывно обмениваясь с ней веществом. В этом процессе можно выделить три этапа:
Внутриклеточный метаболизм, в свою очередь, включает в себя два типа реакций: катаболизм и анаболизм.
Катаболизм — это процесс расщепления и окисления органических молекул, приводящий к образованию тепла и энергетических молекул, АТФ. Именно за счет постоянного производства—расщепления последних съеденные нами калории направляются «по адресу»: гидролиз двух высокоэнергетических (макроэргических) связей в молекулах АТФ обеспечивает энергией всевозможные синтетические и транспортные процессы в клетках.
На первом этапе катаболизма под воздействием пищеварительных ферментов сложные органические соединения (белки, полисахариды, жиры) распадаются на более простые — аминокислоты, моносахариды, жирные кислоты и глицерин, — которые клетка использует для реакций анаболизма (пластического обмена) и получения энергии. Аминокислоты идут на синтез белков. Жирные кислоты выполняют энергетическую функцию, входят в состав клеточных мембран и служат субстратом для синтеза эйкозаноидов
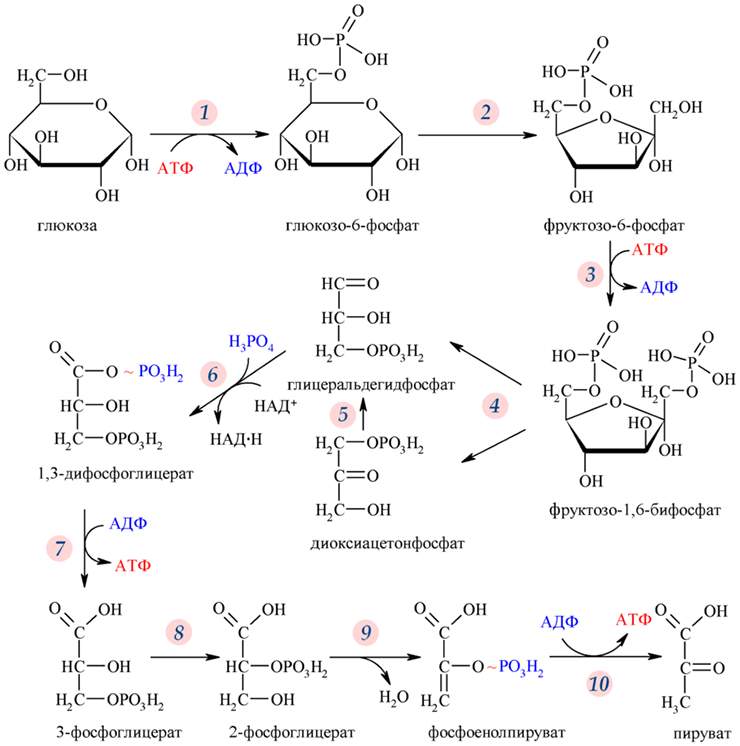
На втором этапе происходит гликолиз — расщепление молекул глюкозы (рис. 1) до пировиноградной кислоты (ПВК). Дальнейший ход реакций зависит от присутствия или отсутствия кислорода в клетке. Если кислорода нет (анаэробный процесс), то ПВК у микроорганизмов и растений будет превращаться в этанол, а в организме животных — в молочную кислоту [2]. Каждый, кто подвергал себя тяжелым физическим нагрузкам, мог почувствовать конечный результат анаэробного метаболизма в виде боли и скованности в мышцах из-за скопившейся в них молочной кислоты.
Рисунок 1. Реакции гликолиза. На 10 этапах гликолиза (пяти подготовительных и пяти этапах синтеза АТФ) из шестиуглеродной молекулы глюкозы образуются две трехуглеродные молекулы пировиноградной кислоты. Полученная от расщепления глюкозы энергия запасается в «энергетической валюте» клетки — двух молекулах АТФ и двух молекулах НАДФ.
Если же кислород в клетке есть, ПВК будет расщепляться на углекислый газ и воду и тоже высвобождать заключенную в углеводной молекуле энергию. Этот процесс называется аэробным клеточным дыханием и проходит в специальных органеллах — митохондриях. Окисление в митохондриях дает гораздо больше энергии, чем гликолиз.
Митохондрии и производство АТФ
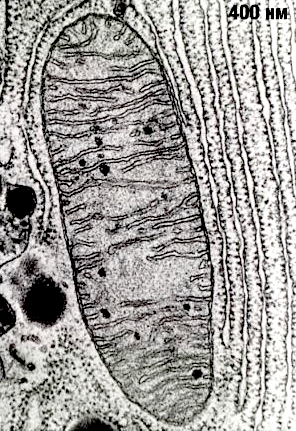
Рисунок 2. Митохондрия под электронным микроскопом.
Митохондрии — настоящее биологическое чудо, сотворенное эволюцией. Несмотря на очень маленький размер (в одной клетке может быть более 1000 митохондрий), эти органеллы поражают чрезвычайно сложной организацией (рис. 2). Они представляют собой вытянутые «пузырьки», окруженные двумя мембранами. Считается, что митохондрии сформировались в результате поглощения археями-фагоцитами пурпурных фотосинтезирующих бактерий, которые, приспосабливаясь к избытку кислорода, освоили аэробное дыхание [3], [4]. Мембраны митохондрий состоят из липидов и гидрофобных, нерастворимых в воде белков. (Здесь мы так подробно описываем строение митохондрий не случайно, а для того чтобы потом было понятно, как их нормальная работа и дисфункция влияют на здоровье.)
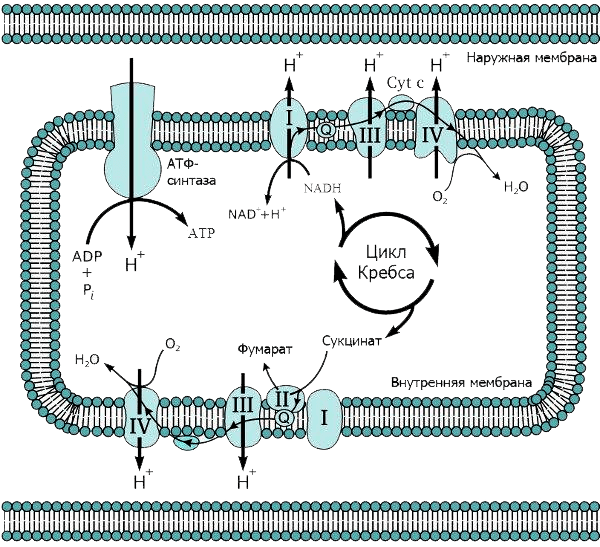
Строение мембран очень важно для процесса дыхания. Внешняя мембрана митохондрий — гладкая, а внутренняя — многократно складчатая. Эти складки (или кристы) позволяют увеличить рабочую площадь мембраны, что необходимо для размещения там всего комплекса белков, осуществляющих дыхание. Вначале окисляются углеродные атомы углеводов, жирных кислот и аминокислот до СО2 (гликолиз, цикл Кребса и β-окисление жирных кислот), а полученные таким образом электроны используются для образования НАДФ. Далее НАДФ окисляется молекулярным кислородом с образованием воды. НАДФ-оксидазная реакция сопровождается выделением очень большого количества свободной энергии (около 1,1 эВ при переносе одного электрона с НАДФ на кислород), которая может запасаться дыхательной цепью в виде трансмембранной разности электрохимических потенциалов ионов H+ (протонов).
Работа же дыхательных белков-ферментов похожа на работу насосов: передавая электроны друг другу, они перекачивают протоны в межмембранное пространство (см. видео 1). В результате внутренняя мембрана митохондрии заряжается подобно конденсатору. Создаются потенциалы: электрический (положительные заряды — снаружи митохондриальной мембраны, отрицательные — внутри органеллы) и химический (возникает разница концентраций протонов: внутри митохондрии их меньше, снаружи — больше). Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм [5]. Для сравнения: потенциал действия на мембранах нервных клеток при передаче сигнала достигает всего 30 мВ.
Видео 1. Как работает митохондрия
Накопившись в межмембранном пространстве, протоны, подобно электрическому току, устремляются назад, в митохондрию — туда, где их концентрация ниже. Однако они могут проходить только по специальным каналам АТФ-синтазы, встроенной во внутреннюю мембрану: протонный канал (ротор) этого фермента закреплен в мембране, а каталитический комплекс торчит внутрь митохондрии, в матрикс (рис. 3). Поток протонов раскручивает ротор, как река водяную мельницу. В результате ротор вращается с невероятной скоростью — 300 оборотов в секунду (см. видео 2)! И именно это вращение приводит к образованию высокоэнергетической молекулы — АТФ [6]. Подсчитано, что в сутки в организме взрослого человека синтезируется и расходуется около 40 кг АТФ, при этом жизнь каждой молекулы очень коротка.
Рисунок 3. Схема дыхательной цепи митохондрий.
Видео 2. Работа АТФ-синтазы в мембране митохондрии
Всё вышесказанное имеет самое непосредственное отношение к старению. Дело в том, что в процессе дыхания ферменты работают не совсем «чисто», и в результате образуются побочные продукты — активные формы кислорода (АФК). Пока человек молод и здоров, образующиеся в митохондриях АФК не представляют для него ощутимой угрозы, так как легко нейтрализуются организмом. Но когда человек стареет, ведет нездоровый образ жизни или имеет генетическую предрасположенность к определенным болезням, его защитные системы дают сбой, рушась одна за другой.
Жирные кислоты и дисфункция митохондрий
То, что старение и возрастные патологии сопровождаются дисфункцией митохондрий, которые начинают производить меньше АТФ и хуже обновляться, уже ни у кого не вызывает сомнения. Выяснилось также, что дисфункция митохондрий и старение тесным образом связаны с повышением уровня свободных жирных кислот в крови [7], чему сильно способствуют малоподвижность и нерациональное питание. Жирные кислоты, попадая в клетку, способны напрямую снижать синтез АТФ, разобщая окисление и фосфорилирование. Этот связанный с терморегуляцией организма феномен был открыт еще шесть десятилетий назад академиком Скулачевым и его коллегами [8]. Снижение синтеза АТФ, в свою очередь, запускает сразу несколько негативных цепных реакций, связанных с возрастными болезнями и старением в целом.
И вот что происходит. Повышение уровня свободных жирных кислот в организме приводит к резистентности к инсулину: инсулинзависимые клетки перестанут реагировать на этот гормон. В результате нарушается усвоение глюкозы и жирных кислот, ухудшается окисление последних. Дело в том, что характерный для состояния инсулинорезистентности высокий уровень инсулина активирует целый каскад реакций, который блокирует работу фермента карнитинпальмитоилтрансферазы I (СРT1), участвующего в переносе жирных кислот внутрь митохондрий [9]. Из-за этого ухудшается синтез АТФ, а жирные кислоты накапливаются в цитоплазме клеток, вызывая эффект липотоксичности. Кроме резистентности к инсулину, избыток жирных кислот в организме вызывает резистентность к еще одному «пищевому» гормону — лептину. А из-за этого страдает функция одного из главных участников биогенеза (обновления) митохондрий — коактиватора рецептора гамма, активируемого пролифераторами пероксисом (PGC-1α). В итоге митохондрии производят меньше АТФ, стареют, погибают и провоцируют гибель клеток путем апоптоза [10].
Ну и наконец, избыток жирных кислот вызывает стресс эндоплазматического ретикулума (ЭПР) — внутриклеточного органоида, участвующего в синтезе белков и множестве других процессов. При стрессе ЭПР в цитоплазму высвобождаются ионы кальция, способные вызывать дисфункцию и гибель митохондрий [11]. Ионы кальция могут накапливаться в клетке и по другой причине — из-за ухудшения работы ионных насосов, откачивающих кальций из клетки. А причиной этому служит нарушение работы митохондрий, сопровождающееся снижением синтеза АТФ, без которого отказываются работать ионные насосы. В итоге формируется порочный круг: снижение выработки АТФ приводит к дисфункции митохондрий, что еще больше снижает выработку АТФ, и т.д.
Жирные кислоты, церамиды и повреждения нейронов
Как выяснилось, избыток жирных кислот и дисфункция митохондрий напрямую связаны с возникновением возрастных нейродегенеративных патологий. Надо сказать, что клетки нервной системы — самые уязвимые для возрастного окислительного стресса и снижения синтеза АТФ. Такая исключительная чувствительность нейронов к дефициту энергии и повышению генерации АФК объясняется несколькими причинами.
Во-первых, нервная ткань в силу своей физиологии нуждается в наибольшем потреблении кислорода. Вследствие этого в митохондриях нейронов происходит интенсивный окислительный метаболизм, который и становится основной причиной повышенной генерации АФК.
Во-вторых, из-за того, что мембраны нейронов содержат много ненасыщенных жирных кислот, они легко подвергаются перекисному окислению липидов. Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
В настоящее время известно несколько факторов, повреждающих нейроны. Среди них — белки, образующие внутри- и внеклеточные агрегаты (β-амилоидный белок и другие), а также церамиды и липофусцин. На их количество влияет прежде всего избыток жирных кислот в организме. Отягчающим обстоятельством в этом случае выступает чрезмерное содержание насыщенных кислот (пальмитиновой и стеариновой) в пищевом рационе. Всё это вместе служит мощным стимулом развития разнообразных нейродегенеративных заболеваний, таких как болезнь Альцгеймера [13], [14].
Но каким же образом пальмитиновая кислота может способствовать нейродегенерации? Установлено, что из-за избытка этой кислоты накапливаются церамиды, которые участвуют в регуляции терминальной дифференцировки, пролиферации и апоптоза нейронов. Посредством нескольких химических реакций они воздействуют на регуляторы клеточного цикла, повышая концентрацию ингибиторов киназ p21/SDI1 и p27/KIP1. Таким образом церамиды останавливают клеточный цикл, что, в свою очередь, активирует главного «стража генома» — белок р53 — и «насылает» на клетку апоптоз [15]. Кроме этого, при деградации церамида образуется вещество сфингозин, обладающее цитотоксическим действием и способное вызывать как апоптоз, так и некроз клеток. Но и это еще не всё. Обнаружено, что накопление насыщенных жирных кислот (пальмитиновой и стеариновой) стимулирует специальные клетки головного мозга (астроглию) на эндогенный (внутренний) синтез церамидов. Эти произведенные церамиды запускают цепную реакцию следующего вида: церамиды → повышение секреции провоспалительных цитокинов и оксида азота → увеличение производства АФК и окислительный стресс → активация стресс-регулируемых киназ (CDK5 и GSK-3) в нейронах → образование β-амилоидного белка и гиперфосфорилирование τ-белка [16].
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
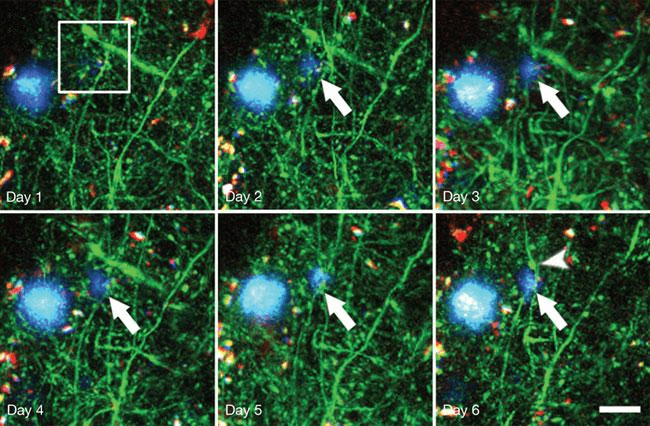
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, для которого характерны синаптическая дисфункция и гибель нейронов, что сопровождается снижением когнитивных способностей: ухудшением памяти и мышления, постепенной потерей социальных и моторных навыков [17]. В зоне риска развития болезни находятся в основном пожилые люди. Лишь 1–2% людей в возрасте до 65 лет страдают БА. Согласно одной из гипотез развития БА — амилоидной, — болезнь возникает из-за накопления в головном мозге агрегатов β-амилоида. Этот пептид состоит из 39–43 аминокислотных остатков и является фрагментом крупного трансмембранного белка под названием предшественник бета-амилоида (amyloid precursor protein, APP). Находясь в избытке, молекулы β-амилоида начинают «склеиваться» и образовывать нерастворимые бляшки (рис. 4). Именно в таком состоянии белок нарушает работу нервных клеток и вызывает симптомы БА. У страдающих БА в пораженных участках мозга находят большое количество амилоидных бляшек и нейрофибриллярных клубков [18].
Рисунок 4. Образование амилоидной бляшки у генно-инженерных мышей (показано длинной стрелкой). На 6-й день уже видна дистрофия нейрона (короткая стрелка). Синим цветом обозначены отложения амилоида, зеленым — нейроны. Длина масштабной линейки — 20 мкм; снимки сделаны с помощью мультифотонного микроскопа.
Однако амилоидная гипотеза — не единственная, объясняющая возникновение БА. В 1993 году Аллен Роузес, профессор Университета Дьюка, предложил еще одну гипотезу возникновения БА — генетическую, связанную с геном APOE, кодирующим аполипопротеин Е (ApoE). Выяснилось, что наследование одного из вариантов гена APOE — APOE4 — в несколько раз повышает шансы заболеть БА. Всё больше исследователей склоняются к мысли, что β-амилоид излишне «демонизирован» и не является первопричиной развития БА. Неудавшаяся терапия, направленная на очистку клеток от β-амилоида, подтверждает, что с этой болезнью не всё до конца ясно [19].
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви. Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания. Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути. Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Болезнь Хантингтона (БХ) — тоже не слишком редкое нейродегенеративное заболевание [21]. Как и в случае болезни Альцгеймера, для патогенеза БХ характерно образование токсичных белковых агрегатов с участием мутантных форм белков, которые синтезируются в нервной ткани. Но если к основному «виновнику» БА, β-амилоиду, у ученых есть вопросы, в случае с БХ сомнений гораздо меньше. Установлено, что именно генетические особенности — полиморфизмы определенных участков ДНК — приводят к появлению патологических форм белка хантингтина. Такой хантингтин способен к ассоциации с другими белками нервной ткани, в результате чего образуются нерастворимые токсичные агрегаты, повреждающие кору и полосатое тело головного мозга. Для БХ типичны всплески непроизвольной двигательной активности, эмоциональные расстройства и потеря памяти. В то же время нормальная физиологическая функция белка хантингтина в организме остается под вопросом. Предполагают, что он играет какую-то роль в эмбриогенезе [22].
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных). Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Со скоплением дефектных белков связали и уже упоминавшийся стресс эндоплазматического ретикулума. Один из таких белков, α-синуклеин, может снижать активность протеасом, что заканчивается стрессом ЭПР, увеличением производства АФК и инициацией апоптозных процессов. Это происходит потому, что из митохондрий высвобождается апоптозный фактор, цитохром С, который активирует «клеточных убийц» — каспазу-9 и каспазу-3 [24]. Как полагают, на начальных этапах нейродегенерации при БА накопление β-амилоида и гиперфосфорилирование τ-белка могут быть физиологическими механизмами защиты клетки от окислительного стресса, вызванного прогрессирующей митохондриальной дисфункцией. Однако при избыточном накоплении этих белков в клетке происходит сбой в работе митохондрий. Так, у пациентов с БА обнаружили, что β-амилоид накапливается в митохондриях и нарушает реакции гликолиза и цикла Кребса, активизирует продукцию АФК. Более того, β-амилоид способен напрямую подавлять синтез АТФ. Это возможно из-за структурного сходства белка с естественным ингибитором F(1)-субъединицы АТФ-синтазы митохондрий. Также β-амилоид может взаимодействовать с митохондриальной мембраной, формируя стабильные комплексы с двумя транслоказами, TOM40 и TIM23. Такие комплексы подавляют импорт в митохондрии белков, кодируемых ядерным геномом, — субъединиц IV и Vb цитохромоксидазы. На что органелла откликается увеличением производства агрессивного пероксида водорода.
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран. Известно, что β-амилоид может связывать гем, а это ведет к дефициту гема в клетке, из-за чего нарушается работа гем-содержащего IV комплекса электронтранспортной цепи митохондрий [26].
Но не только β-амилоид способен негативно влиять на митохондрии. В экспериментах с трансгенными грызунами, экспрессирующими ген хантингтина человека, обнаружили агрегацию этого белка в митохондриях с последующим развитием их дисфункции. Другой «зловредный» белок, α-синуклеин, накапливаясь во внутренней митохондриальной мембране, способен снижать активность дыхательного комплекса I. Как следствие, митохондрии увеличивают продукцию АФК [27]. Также обнаружено, что α-синуклеин, взаимодействуя с митохондриями, может стимулировать высвобождение из них цитохрома С, а значит, инициировать апоптоз.
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП. Дефектные формы τ-белка и хантингтина тоже мешают нормальной работе митохондрий, ухудшая тем самым энергообеспечение отростков нервных клеток и синаптическую передачу, вызывая дегенерацию синапсов [29].
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.
Эффект Варбурга
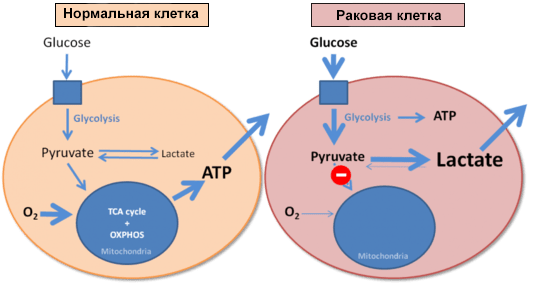
И напоследок стόит коснуться еще одного момента, связанного с патологиями и изменением клеточного метаболизма. В 1926 году немецкий биохимик Отто Варбург сравнил скорости образования молочной кислоты (лактата) в нормальных и опухолевых клетках. Оказалось, что опухолевые клетки потребляют очень много глюкозы, образуя при этом лактат. И делают это они гораздо быстрее, чем нормальные клетки: злокачественная ткань в эксперименте производила молочную кислоту в восемь раз активнее, чем это происходит в мышце, выполняющей физическую работу. Варбург установил, что раковые клетки используют гликолиз для получения энергии вне зависимости от доступности кислорода (рис. 5) [30]. В честь первооткрывателя этот феномен назвали эффектом Варбурга [2].
Рисунок 5. Энергообеспечение нормальной и раковой клеток. Синим квадратом обозначена поступающая в клетку глюкоза.
Обнаружив этот эффект, Варбург логично предположил, что его можно объяснить дисфункцией митохондрий в опухолевых клетках и нарушением окислительного фосфорилирования. Сегодня эта точка зрения ставится под сомнение, так как и в перерожденной ткани обнаруживают большое количество нормально работающих митохондрий. Около половины всей энергии опухолевые клетки получают из молекул АТФ, произведенных в митохондриях [31]. Эффект Варбурга проявляется в клетках уже в самом начале их трансформации в опухолевые. И это дает возможность проводить раннюю диагностику неопластических процессов: как только клетка начала расходовать глюкозу в повышенных масштабах, пора бить тревогу. Обнаружить эти процессы можно с помощью позитронно-эмиссионной томографии с использованием фторированного аналога глюкозы, 2-( 18 F)-2-дезокси-D-глюкозы.
Но зачем раковые клетки переходят на анаэробный гликолиз? Сейчас считается, что так они получают преимущество, заранее подготавливаясь к «тяжелым временам» — развитию гипоксии. А кроме этого, такой способ энергообеспечения дает клеткам возможность использовать промежуточные продукты гликолиза для анаболических реакций, усиления своей антиоксидантной защиты и отражения иммунной атаки организма [32].
Таким образом, изменения в метаболизме глюкозы и появление дефектных белков и внутриклеточных агрегатов могут говорить о начале развития патологии. Своевременное выявление подобных внутриклеточных процессов может сыграть решающую роль в предупреждении и терапии самых распространенных нейродегенеративных и онкологических заболеваний. А для того чтобы это было возможным, необходимо изучать фундаментальные аспекты патологий, связанные с работой митохондрий и энергетическим обменом. Сегодня уже разработаны системы, позволяющие заглянуть «вглубь» этих заболеваний и даже провести диагностику на самой ранней стадии их развития. Подробнее об этих системах, принципах их действия и исследованиях с их использованием расскажут следующие статьи спецпроекта.
ЗАО «БиоХимМак» — спонсор спецпроекта по биоэнергетике
Компания более 25 лет успешно занимается поставками научного и медицинского оборудования российских и зарубежных производителей: Beckman Coulter, Bio-Rad, Molecular Devices, Thermo Fisher Scientific, UVP, Seahorse Bioscience (part of Agilent), Immucor, MRC Holland и др. «БиоХимМак» обслуживает более 5000 научных и медико-диагностических лабораторий в России и странах СНГ.
Отдел молекулярной диагностики (Life Science MDx)
Молекулярная онкология, преимплантационный скрининг, цитогенетика, пренатальные и постнатальные исследования, диагностика инфекций, наследственных, мультифакторных заболеваний, детекция генномодифицированных источников и бактериального загрязнения в продуктах питания, криминалистические приложения — это лишь неполный перечень областей, которые входят в сферу интересов отдела.
Основные направления деятельности отдела:
Отдел работает как с инновационной продукцией (MLPA, PGS и NGS исследования, клеточная биоэнергетика Agilent Seahorse Bioscience), так и с зарекомендовавшими себя мировыми брендами — Beckman Coulter, Bio-Rad, Molecular Devices, UVP, Thermo Fisher Scientific.
Материал предоставлен партнёром — компанией «БиоХимМак»