На чем основано дихроматометрическое титрование восстановителей
Дихроматометрическое титрование
Дихроматометрией называется метод определения веществ, основанный на реакции их окисления дихромат-ионом. Стандартный потенциал редокс-пары
Рабочий раствор дихромата калия можно приготовить по точной навеске. Дихромат калия удовлетворяет всем требованиям первичного стандарта, при хранении в закрытой ёмкости в тёмном месте расвор дихромата калия стабилен и не изменяет свой титр в течение длительного времени. Эквивалентное число в реакции окисления в кислотной среде z = 6. Эквивалентная масса М = Э = 49,031 г/моль
Приведём формулу расчёта кривых титрования железа (II) дихроматом калия. При титровании протекает реакция
До точки эквивалентности в растворе присутствуют как исходные ионы, так и ионы, образовавшиеся в ходе реакции
Уравнения Нернста для двух редокс-пар следующие
Расчёт потенциала до точки эквивалентности ведут по уравнению
В точке эквивалентности Е = Е1 = Е2
Проводя определённые алгебраические преобразования, получаем формулу :
Расчёт после точки эквивалентности ведут по уравнению (2).
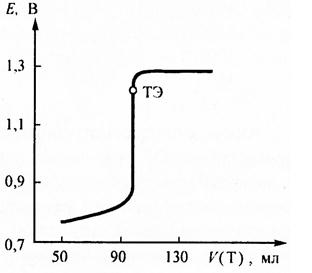
По приведённым формулам строят кривую титрования железа (II) дихроматом калия (рис. 1).
Рис. Рассчитанная кривая ОВ титрования 100 мл кислого 0,05 моль/л раствора железа (II) раствором дихромата калия с молярной концентрацией эквивалента 0,05 иоль/л. Исходная концентрация ионов водорода [H + ] = 1 моль/л. ТЭ – точка эквивалентности.
Полученная кривая несимметрична относительно точки эквивалентности. Скачок на кривой титрования лежит в пределах от 0,95 до 1,3 В. Потенциал в точке эквивалентности равен 1, 223 В. Следовательно в качестве индикатора можно применять n-фенилантраниловую кислоту (Е = 1 В), ферроин (Е = 1,06 В), но нельзя использовать дифениламин, потенциал которого равняется 0,76 В и лежит за пределами скачка. Без индикаторов дихромат калия также не применяется, поскольку имеет недостаточно интенсивную окраску, непригодную для точной визуальной фиксации точки эквивалентности.
В аналитической практике титрование раствора Fe(II) раствором дихромата калия проводят в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в прочный бесцветный фосфатный комплекс. В результате равновесие смещается в сторону образования Fe 3+ и скачок на кривой титрования расширяется в сторону более низкого потенциала и лежит в пределах от –0,68 В и до –1, 3 В. Следовательно в присутствии фосфорной кислоты ТВ можно применять в качестве индикатора также дифениламин.
Дата добавления: 2016-01-09 ; просмотров: 2389 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Дихроматометрическое титрование

Стандартный раствор K2Cr2O7 является первичным. Он устойчив при хранении. В отличие от KMnO4 дихромат не восстанавливается следами органических веществ и хлорид-ионов, содержащихся в воде. Для обнаружения конечной точки титрования обычно используют окислительно-восстановительные индикаторы: дифениламин, ферроин и др.
Дихроматометрическое титрование применяют для определения восстановителей, некоторых окислителей, а также ионов, образующих малорастворимые в воде хроматы или дихроматы. Как и перманганатометрическое титрование дихроматометрия используется, главным образом, для определения неорганических веществ и сравнительно редко используется в фармацевтическом анализе.
Прямое дихроматометрическое титрование заключается в том, что раствор определяемого восстановителя подкисляют серной кислотой и титруют стандартным раствором K2Cr2O7, например:
Дихроматометрическое титрование используется также как осадительное титрование для определения веществ, образующих малорастворимые в воде хроматы или дихроматы. К раствору, содержащему определяемый катион, добавляют избыток стандартного раствора дихромата калия. Выпавший осадок отфильтровывают, а в фильтрате определяют оставшееся количество K2Cr2O7 путём титрования стандартным раствором Fe 2+ или иодометрически. Такой вариант титрования используется, например, для определения метиленового синего.
Дата добавления: 2015-08-05 ; просмотров: 12 ; Нарушение авторских прав
Дихроматометрическое титрование
Кривые окислительно-восстановительного титрования
Кривые окислительно восстановительного титрования строят в следующих координатах. По оси y откладывают изменение окислительно-восстановительного потенциала, а по оси x объем прибавленного титранта или степень оттитрованности
где n – количество оттитрованного в данный момент вещества, а n0 – исходное количество вещества. f – рассчитывается также как
V – объём титранта, прибавленного в данный момент, а V – объём титранта в точке эквивалентности.
Наибольшие изменения потенциала раствора наблюдаются в точке эквивалентности или около неё, так как именно в этой области происходит самое большое изменение отношения концентраций окисленной и восстановленной форм редокс-пар. На кривых титрования обнаруживается скачок потенциала. Расчётные теоретические кривые титрования строят для того, чтобы определить интервалы скачка с целью подбора соответствующего индикатора. Потенциал перехода между редокс-формами индикатора должен попасть внутрь скачка на кривой титрования.
Если в окислительно-восстановительной реакции не участвуют протоны или реакция проводится при строго определённой концентрации Н + ионов, то расчёт потенциала в точке ковалентности проводят по формуле
а n1 n2 – число электронов, принимаемых или отдаваемых в реакции, соответственно.
Если при титровании не используются редокс-индикаторы, как, например, в перманганатометрии, то построение кривых титрования не имеет практического смысла.
Дихроматометрией называется метод определения веществ, основанный на реакции их окисления дихромат-ионом. Стандартный потенциал редокс-пары
Рабочий раствор дихромата калия можно приготовить по точной навеске. Дихромат калия удовлетворяет всем требованиям первичного стандарта, при хранении в закрытой ёмкости в тёмном месте расвор дихромата калия стабилен и не изменяет свой титр в течение длительного времени. Эквивалентное число в реакции окисления в кислотной среде z = 6. Эквивалентная масса М = Э = 49,031 г/моль
Приведём формулу расчёта кривых титрования железа (II) дихроматом калия. При титровании протекает реакция
До точки эквивалентности в растворе присутствуют как исходные ионы, так и ионы, образовавшиеся в ходе реакции
Уравнения Нернста для двух редокс-пар следующие
Расчёт потенциала до точки эквивалентности ведут по уравнению
В точке эквивалентности Е = Е1 = Е2
Проводя определённые алгебраические преобразования, получаем формулу :
Расчёт после точки эквивалентности ведут по уравнению (2).
По приведённым формулам строят кривую титрования железа (II) дихроматом калия (рис. 1).
Рис. Рассчитанная кривая ОВ титрования 100 мл кислого 0,05 моль/л раствора железа (II) раствором дихромата калия с молярной концентрацией эквивалента 0,05 иоль/л. Исходная концентрация ионов водорода [H + ] = 1 моль/л. ТЭ – точка эквивалентности.
Полученная кривая несимметрична относительно точки эквивалентности. Скачок на кривой титрования лежит в пределах от 0,95 до 1,3 В. Потенциал в точке эквивалентности равен 1, 223 В. Следовательно в качестве индикатора можно применять n-фенилантраниловую кислоту (Е = 1 В), ферроин (Е = 1,06 В), но нельзя использовать дифениламин, потенциал которого равняется 0,76 В и лежит за пределами скачка. Без индикаторов дихромат калия также не применяется, поскольку имеет недостаточно интенсивную окраску, непригодную для точной визуальной фиксации точки эквивалентности.
В аналитической практике титрование раствора Fe(II) раствором дихромата калия проводят в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в прочный бесцветный фосфатный комплекс. В результате равновесие смещается в сторону образования Fe 3+ и скачок на кривой титрования расширяется в сторону более низкого потенциала и лежит в пределах от –0,68 В и до –1, 3 В. Следовательно в присутствии фосфорной кислоты ТВ можно применять в качестве индикатора также дифениламин.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
МОДУЛЬ № 2
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Методы, используемые на лекции:
1. По дидактическому назначению: лекция вводная, тематическая, объяснительная.
2. По роли в образовательном процессе: лекция вводная, установочная, обзорная, обобщающая.
3. По содержанию и системе построения: лекция информационная (традиционная).
4. По назначению лекция направлена на приобретение студентами знаний, на развитие творческой деятельности, а также на закрепление учебного материала. По типу познавательной деятельности на лекции применяются репродуктивные и проблемные методы изложения материала, используются наглядные методы обучения в виде презентации по данному разделу
1. Дидактические: презентация.
2. Материально технические: мел, доска, мультимедийный проектор, экран.
1. Организационный момент 3 мин (название темы и плана лекции).
4. Второй час лекции 40 мин.
Йодатометрическое титрование. Сущность метода. Титрант метода, его приготовление, стандартизация.
1.3. Индикаторы метода, определение конечной точки титрования.
Иодатометрия, или йодатометрическое титрование ‒ это определение различных восстановителей титрованием раствором иодата калия KIO3. Метод – фармакопейный.
Сущность метода. В основе метода лежит полуреакция (1):
В соответствии с полуреакцией (1) число электронов, принимающих участие в этой полуреакции, равно n = 6; фактор эквивалентности для иодат-иона в подобных ОВ процессах равен 1/z = 1/n = 1/6. Молярная масса эквивалента иодата калия равна
М(1/6 KIO3) = М(KIO3)/6 = 35,6668 г/моль.
Молярная концентрация с(KIO3) и молярная концентрация эквивалента с(1/6 KIO3) связаны соотношением
Иодат-ион способен в кислой среде, в зависимости от условий, восстанавливаться также до иода в соответствии с полуреакцией
IO3- + 5e + 6H+ = 0,5I2 + 3H2O
Стандартный ОВ потенциал редокс-пары IO3-,Н+|I2 при комнатной температуре равен 1,195 В.
Титрант метода, его приготовление, стандартизация. В качестве титранта метода применяют водный раствор иодата калия KIO3 обычно с молярной концентрацией эквивалента 0,1 моль/л.
Титрант можно готовить по точной навеске иодата калия высокой степени чистоты (обычно химически чистого, «х. ч.»). Безводный KIO3 устойчив при хранении.
Для приготовления раствора иодата калия с молярной концентрацией эквивалента 0,1 моль/л точную навеску (около 3,567 г) высушенного кристаллического иодата калия тонко растирают в ступке, растворяют в дистиллированной воде в мерной колбе вместимостью 1 л и доводят объем раствора до метки.
При необходимости титрант стандартизуют следующим образом.
К 20 мл стандартизуемого раствора иодата калия, помещенного в колбу с притертой пробкой, добавляют 100 мл дистиллированной воды, 25 мл разбавленной серной кислоты, 2 г кристаллического иодида калия и оставляют колбу на 10‒15 минут в темном месте. При этом протекает реакция
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O
Образовавшийся иод титруют стандартным 0,1 моль/л раствором тиосульфата натрия в присутствии индикатора – крахмала.
Стандартные растворы иодата калия хранят в сосудах из темного
стекла с притертыми пробками, в темном месте.
Индикаторы метода, определение конечной точки титрования. В иодатометрии при визуальном определении КТТ используют либо свежеприготовленный 1%-ный раствор крахмала либо не смешивающиеся с водой органические экстрагенты − хлороформ, тетрахлорид углерода, способные экстрагировать иод из водной фазы, окрашиваясь при этом в фиолетовый цвет. При первой избыточной капле иодата калия KIO3 выделяется иод I2, крахмал синеет.
В качестве индикаторов используют и некоторые красители.
Применение иодатометрии. Методом иодатометрического титрования определяют различные вещества, обладающие восстановительными свойствами, например олово(II), сурьму(III), мышьяк(III), Hg22+, железо(II), иодиды, сульфиты, тиосульфаты, тиоцианаты, аскорбиновую кислоту, гидразин, гидразид изоникотиновой кислоты и др.
Способом обратного титрования, с иодатометрическим окончанием.
можно определять и окислители, такие; как PbO2, MnO2, пероксиды водорода и бария и т. п. Рассмотрим некоторые примеры.
Определение иодидов прямым титрованием. В основе определения иодид-ионов лежат реакции (2) и (3):
Для проведения определения к анализируемому раствору иодида прибавляют несколько капель СС14 или СНСl3 (для фиксирования окончания титрования). Смесь титруют стандартным раствором иодата калия.
Вначале титруемый раствор темнеет вследствие образования иода по реакции (2), а затем, по мере дальнейшего прибавления титранта, постепенно светлеет до бледно-желтой окраски остаточного иода. Смесь энергично встряхивают. Иод при этом переходит в органическую фазу, которая принимает фиолетовую окраску. Титрование продолжают при энергичном встряхивании смеси до обесцвечивания органической фазы.
Определение сурьмы (III) прямым титрованием. Для определения сурьмы (III) анализируемый соляно-кислый раствор, содержащий сурьму (III), титруют стандартным раствором иодата калия. При этом протекает реакция
5H[SbCl4] + 2КIO3 + 12HC1 = I2 + 5H[SbCl6] + 2KCl + 6Н2O
Выделившийся иод реагирует с прибавляемым титрантом с образованием монохлорида иода:
2I2 + КIO3 + 6НС1 = 5IC1 + КС1 + 3Н2O
Последнюю реакцию в условиях проведения титрования можно представить также в виде
2I2 + КIO3 + 11НС1 = 5НICl2 + КС1 + 3Н2O
В качестве индикатора используют либо крахмал, либо слой органического экстрагента, окрашивающегося иодом в фиолетовый цвет.
При определении аскорбиновой кислоты к анализируемому солянокислому раствору прибавляют небольшое количество 1%-ного раствора KI и крахмала (в качестве индикатора). Затем проводят титрование стандартным раствором иодата калия до появления устойчивой синей окраски раствора.
Аскорбиновая кислота C6H8O6 окисляется иодатом калия КIO3 до дегидроаскорбиновой кислоты C6H6O6, что схематически можно описать в виде
3C6H8O6 + КIO3 = 3C6H6O6 + KI + 3H2O
Количественно по ФС определяют кислоту аскорбиновую, используя в качестве титранта-окислителя 0,1 моль/л раствор иодата калия в присутствии иодида калия:
KIO3 + 5KI + 6HCl = 3I2 + 6KCl + 3H2O
После достижения точки эквивалентности первая капля прибавленного титранта окисляет иодид-ионы до иода:
5I- + IO3- + 6H+ = 3I2 + 3H2O
который в присутствии крахмала и окрашивает раствор в синий цвет.
В основе иодатометрического определения ряда других веществ лежат реакции:
2SnCl2 + КIO3 + 6НС1 = 2SnCl4 + ICl + KCl + 3H2О
2HAsО2 + КIO3 + 2НС1 + Н2О = 2H3AsО4 + ICl + KCl
2Hg2Cl2 + KIO3 + 6HC1 = 4HgCl2 + ICl +KC1 + 3H2O
Na2S2O3 + 2KIO3 + 2HC1 = Na2SO4 + 2IC1 + K2SO4 + H2O
2KNCS + 3КIO3 + 2HCI = 2ICN + ICl + 2K2SO4 + KCl + H2O
N2H4 ∙2HCI + КIO3 = ICl + N2 + KCl + 3H2O
Дихроматометрическое титрование, или дихроматометрия, ‒ метод определения веществ, основанный на реакции их окисления дихромат-ионами. Метод ‒ фармакопейный.
Сущность метода. В основе метода лежит полуреакция
Сr2О72- + 6е + 14Н+ = 2Сr3+ + 7Н2O
Стандартный ОВ потенциал редокс-пары Сr2О72-,Н+|Сr3+ равен при комнатной температуре E° = 1,36 В, т. е. имеет довольно высокое значение, поэтому дихромат-ионы способны окислять в кислой среде целый ряд веществ-восстановителей.
Реальный ОВ потенциал редокс-пары Сr2О72-,Н+|Сr3+ возрастает с повышением концентрации ионов водорода в соответствии с уравнением Нернста:
E = E° + (0,059/6) lg([Cr2O72-][H+]14 /[Cr3+]2),
вследствие чего окислительная способность дихромат-иона увеличивается с понижением pH среды. Поэтому дихроматометрическое титрование обычно проводят в сильнокислых растворах.
Кислую среду можно создавать, прибавляя не только серную, но также ортофосфорную или хлороводородную кислоту; при концентрациях НСl, не превышающих 2 моль/л, хлорид-ионы не окисляются дихромат-ионами. При более высокой концентрации НСl в растворе или при повышении температуры возможно частичное окисление хлорид-ионов дихромат-ионами до хлора, поэтому в этих условиях дихроматометрическое титрование в присутствии хлорид-ионов не проводят.
Титрант метода. Титрантом метода является водный раствор дихромата калия К2Сr2О7, чаще всего с молярной концентрацией эквивалента 0,1 моль/л. Титрант готовят по точной навеске дихромата калия высокой степени чистоты, предварительно дважды перекристаллизованного из воды и затем высушенного при
150−200 °С. При хранении в закрытой емкости в темном месте раствор дихромата калия стабилен и не изменяет свой титр в течение длительного времени.
Фактор эквивалентности дихромата калия в соответствии с вышенаписанной полуреакцией равен 1/6; молярная масса эквивалента составляет
M(1/6 К2Сr2O7) = М(К2Сr2O7)/6 = 294,185/6 г/моль = 49,031 г/моль.
Определение конечной точки титрования. Водные растворы дихромата калия имеют оранжевую окраску, однако ее интенсивность недостаточна для надежного определения изменения цвета титруемого раствора в ТЭ. К тому же в ТЭ присутствуют катионы Сr3+, образовавшиеся при восстановлении дихромат-иона и обладающие зеленой окраской, что также затрудняет определение изменения цвета титруемого раствора в ТЭ. Поэтому дихроматометрическое титрование обычно проводят в присутствии редокс-индикаторов − дифениламина, дифениламинсульфоновой кислоты, N-фенилантраниловой кислоты. Применение дихроматометрии. Прямым дихроматометрическим титрованием можно определять ряд восстановителей, таких, как железо (II) (включая определение ферроцианидов, содержащих ферроцианид-ион [Fe(CN)6]4-), сульфиты, иодиды, арсениты, аскорбиновую кислоту, метанол, суммы окисляющихся веществ в воде и почве и т. д.
Методом обратного титрования определяют некоторые окислители.
Так, определение железа(II) ведут прямым титрованием аликвоты анализируемого раствора стандартным раствором дихромата калия в кислой среде на основе реакции
6Fe2+ + Сr2О72- + 14Н+ = 6Fe3+ + 2Сr3+ + 7Н2О
При обратном дихроматометрическом определении окислителей, таких, как нитраты, хлораты, перманганаты и др., поступают следующим образом.
К аликвоте анализируемого раствора, содержащего определяемый окислитель, прибавляют известный избыток титрованного раствора железа (II). При этом железо (II) окисляется до железа (III), на что расходуется весь окислитель, присутствовавший в анализируемом растворе. Избыток непрореагировавшего железа (II) оттитровывают стандартным раствором дихромата калия, часто − в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в фосфатные комплексы, вследствие чего реакция протекает с большей полнотой, а желтая окраска аквакомплексов железа (III) исчезает.
Так можно определять нитраты:
NO3- + 3Fe2+ + 4Н+ = 3Fe3+ + NO + 2H2O
Избыток железа(II) оттитровывают раствором дихромата калия:
6Fe2+ + Cr2O72- + 14Н+ = 6Fe3+ + 2Сr3+ + 7Н2O
Аналогично определяют хлораты:
6Fe2+ + Сr2O72- + 14Н+ = 6Fe3+ + 2Сr3+ + 7Н2O
Методом обратного титрования определяют и некоторые восстановители, которые медленно реагируют с раствором дихромата калия. Так, например, при определении гидрохинона к аликвоте анализируемого раствора, содержащего гидрохинон, прибавляют известный избыток раствора дихромата калия и оставляют на некоторое время. Затем избыточный дихромат калия оттитровывают раствором, содержащим железо(II).
К преимуществам можно отнести то, что стандартный раствор титранта готовится по точной навеске и не требует последующей стандартизации; титрант стабилен даже при длительном хранении; титрование можно проводить в соляно-кислой среде.
Недостатки: несколько меньший по сравнению с перманганат-ионом стандартный ОВ потенциал редокс-пары и в связи с этим более ограниченная возможность определения восстановителей; менее удобная фиксация КТТ, необходимость использования редокс-индикаторов.
Хлориодиметрия, или хлориодиметрическое титрование, − метод определения восстановителей с применением титранта − раствора монохлорида иода(I) ICl. Метод − фармакопейный.
Сущность метода. В основе хлориодиметрического титрования лежит полуреакция
Монохлорид иода может также восстанавливаться по схеме
При титровании восстановителя X с учетом полуреакции (1) выделяются иодид-ионы. После того как все количество восстановителя прореагирует с ICl, прибавляемый избыточный ICl окисляет иодид-ионы:
Суммарно (1) и (3) дают полуреакцию (2).
В соответствии с полуреакцией (1) число электронов, принимаемых одной молекулой ICl, равно n = 2. Поэтому фактор эквивалентности монохлорида иода равен 1/z = 1/n = 2; молярная масса эквивалента М(1/2 IСl) = М(ICl)/2 = 162,358/2 = 81,179 г/моль. Молярная концентрация с(IСl) и молярная концентрация эквивалента c(1/2 IСl) связаны соотношением
Как окислитель монохлорид иода эффективнее иода и более устойчив.
Титрант метода, его приготовление, стандартизация. В качестве титранта в хлориодиметрии применяют раствор монохлорида иода ICl с молярной концентрацией эквивалента, равной обычно 0,1 моль/л.
Монохлорид иода представляет собой твердое вещество красного цвета с температурой плавления 27 °С. Однако раствор титранта по навеске монохлорида иода не готовят. Монохлорид иода обычно получают непосредственно в сильнокислом растворе на основе реакции
2KI + КIO3 + 6НСl = 3ICl + 3КСl + ЗН2O
между иодидом и иодатом калия в соляно-кислых растворах.
Для получения раствора монохлорида иода смесь 5,53 г иодида калия и 3,55 г иодата калия помещают в стеклянную колбу с притертой пробкой и прибавляют 50 мл дистиллированной воды, 40 мл концентрированной HCl. Смесь перемешивают до полного растворения иода, первоначально образующегося при протекании реакции. Прибавляют 10 мл хлороформа, смесь переносят в делительную воронку и взбалтывают.
Если органический слой принимает фиолетовую окраску, то это означает, что в смеси имеется некоторое количество иода. В этом случае к смеси прибавляют по каплям 1%-ный раствор КIO3 при энергичном взбалтывании до полного обесцвечивания органического слоя.
Если органический слой бесцветный, то прибавляют по каплям 1%-ный раствор KI до появления слабо-розовой окраски этого слоя.
После полного расслоения органической и водной фаз отделяют водную фазу в мерную колбу на 1 л и доводят объем раствора до метки дистиллированной водой.
Полученный раствор монохлорида иода имеет лимонно-желтый цвет.
Стандартизацию раствора монохлорида иода проводят по стандартному раствору тиосульфата натрия. Для этого 25 мл раствора монохлорида иода, полученного, как описано выше, помещают в колбу для титрования с притертой пробкой, прибавляют 1 г иодида калия и оставляют смесь на
15 минут в темном месте. При этом протекает реакция
Иод, выделившийся в количестве, эквивалентном количеству прореагировавшего монохлорида иода, титруют стандартным 0,1 моль/л раствором тиосульфата натрня в присутствии крахмала до исчезновения синей окраски раствора.
Стандартизованный раствор монохлорида иода хранят в сосудах из темного стекла с притертыми пробками, в темном месте.
Поскольку раствор монохлорида иода при хранении способен несколько изменять свой титр, то каждый раз перед применением определяют заново его титр по стандартному раствору тиосульфата натрия.
При титровании восстановителей в растворе накапливаются иодид-ионы в соответствии с полуреакцией (1). После ТЭ первая же капля избыточного титранта, содержащего монохлорид иода, взаимодействует с иодид-ионами по реакции (3) с образованием иода, который тотчас же в присутствии крахмала окрашивает раствор в синий цвет; титрование заканчивают.
Определение конца титрования проводят также потенциометрически.
Условия хлориодиметрического титрования. Титрование проводят в кислой, нейтральной или слабощелочной среде. В сильнощелочных растворах протекает побочная реакция:
В щелочной среде протекает и другая побочная реакция:
с участием иода, образующегося при титровании определяемого восстановителя. Поэтому титрование в щелочных средах дает неточные результаты.
Применение хлориодиметрии. Метод используют для определения различных восстановителей, ряда органических лекарственных препаратов − сульфамидных производных, барбитуратов, тиобарбитуратов, новокаина, риванола, других органических соединений.
При прямом титровании раствором монохлорида иода можно определять ртуть (I), олово (II), мышьяк (III), сурьму (III), железо (II), иодиды, сульфиты, тиоцианаты, аскорбиновую кислоту, гидразин и его производные, гидрохинон, метионин, тиокарбамид и его производные и т. д.
Как уже отмечалось выше, в хлориодиметрии определение конца титрования часто проводят потенциометрическим методом.
Проиллюстрируем сказанное некоторыми примерами.
Железо(II) при прямом титровании можно определять на основе реакции
Здесь H2Y2- − сокращенное обозначение аниона этилендиаминтет-рауксусной кислоты. В данном случае ТЭ можно фиксировать потенциометрически.
Ферроцианиды титруют до феррицианидов на основе реакции
2[Fe(CN)6]4- + 2ICl = 2[Fe(CN)6]3- + I2 + 2Сl-
в слабощелочной среде (предпочтительно в присутствии NaHCO3).
Тиоцианаты (роданиды) титруют в нейтральной, слабокислой или слабощелочной среде. Реакции можно описать следующими уравнениями. В слабощелочной среде:
В нейтральной или слабокислой среде:
Титрование гидрохинона С6Н4(ОН)2 до хинона С6Н4O2 также проводят либо в слабокислой, либо в слабощелочной среде согласно следующим реакциям.
В слабокислой среде:
C6H4(OH)2 + 2ICl = С6Н4O2 + I2 + 2HCl


В слабощелочной среде:
Аскорбиновую кислоту (витамин С) можно определять прямым титрованием раствором ICl на основе реакции:
Методами обратного и заместительного титрования определяют железо (II), ртуть (I), сульфиты, фенол, резорцин, салицилаты и др.
Так, при определении железа(II) к анализируемому раствору, содержащему железо(II), прибавляют в избытке раствор ICl. При этом протекает реакция:
2Fe2+ + 2ICl = 2Fe3+ + I2 + 2Cl-
Выделившийся иод оттитровывают.
При определении Hg2Cl2 навеску препарата, содержащего хлорид ртути(I), встряхивают 2−3 минуты с известным количеством раствора IC1, взятого в избытке, в соляно-кислой среде. При этом Hg2Cl2 растворяется. После его растворения прибавляют избыток 10%-ного раствора KI и оттитровывают выделившийся иод стандартным раствором тиосульфата натрия.
При анализе органических лекарственных препаратов, способных иодироваться, к анализируемому раствору, содержащему определяемое вещество, прибавляют избыток стандартизованного раствора IC1 и оставляют смесь на некоторое время для протекания реакции. Затем к смеси прибавляют избыток иодида калия и выделившийся иод оттитровывают стандартным раствором тиосульфата натрия в присутствии индикатора − крахмала.
Так поступают, например, при определении лактата этакридина на основе реакций: