На конкретных примерах покажите что такое изомерия
Изомерия в органической химии
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Виды изомерии в органической химии
Изомерия в химии — что это за явление
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Подробнее явление изучил Й. Берцелиус. Исследовав винную и виноградные кислоты (у обеих формула C 4 H 6 O 6 ) он в 1830 году ввел термин «изомерия». Его предположение заключалось в следующем: вещества с одинаковым составом могут различаться из-за разного распределения атомов в молекуле.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Изомерия — явление, суть которого заключается в существовании химических соединений, которые одинаковы по качественному и количественному составу, но различаются по строению или расположению атомов в пространстве. Вследствие этого они обладают разными физическими и химическими свойствами.
Из данного определения следует определение веществ-изомеров.
Изомеры — это химические соединения с одинаковым составом, но разные по строению или пространственному расположению атомов и свойствам.
Как правило, большое количество изомеров характерно для представителей широко известного класса аминокислот. За счет различных заместителей при α-углеродном атоме им также свойственна и оптическая изомерия, которая будет рассмотрена далее.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
Структурная изомерия
Структурные изомеры — вещества, которые одинаковы по качественному и количественному составу, но различающиеся строением, т. е. порядком расположения атомов. Структурные изомеры имеют одинаковые молекулярные, но разные структурные формулы.
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола ( C 6 H 6 ), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
Рассмотрим подробнее каждый из типов.
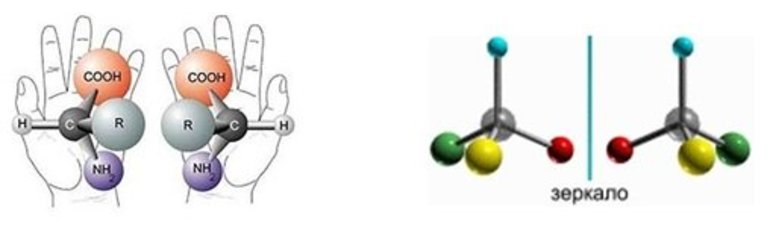
1. Оптическая изомерия (энантиомерия).
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
У одного и того же вещества могут быть разные типы изомеров. Так, многим представителем класса алкенов свойственны межклассовая, геометрическая и изомерия углеродного скелета. Среди альдегидов встречается структурная изомерия — углеродного скелета и межклассовая. Для циклоалканов характерна межклассовая изомерия, цис-, транс-изомерия и др.
Определение понятия
В 1823 году завязался спор между учеными Ф. Велером и Ю. Либихом из-за разных свойств одного вещества — AgCNO. Эта формула соответствовала и гремучему, и циановокислому серебру. Второй подобный случай произошел с Й. Берцелиусом. Он исследовал виноградную и винную кислоты и в 1830 году впервые использовал термин «изомерия». Это явление ученый объяснил тем, что простые атомы таблицы Менделеева по-разному распределяются в молекуле.
И лишь во второй половине XIX века появилось подлинное определение термина. В его основание легли стереохимическое учение Я. Вант-Гоффа и теории строения А. Бутлерова. Первый выявил пространственную изомерию, второй — структурную. Сегодня это название носит явление, которое заключается в существовании соединений с одинаковой массой и атомным составом, но разным расположением в пространстве и строением.
Структурный тип
Существует несколько типов изомерии. Структурным является тот, при котором различия наблюдаются в химическом строении молекулы. Сюда можно отнести несколько видов:
Разный порядок связи атомов обуславливает изомерию углеродного скелета. Самые простые примеры для этого случая: бутан и изобутан. Формула первого — СН3-СН2-СН2-СН3, а второго — (СН3)3СН. Сюда же можно отнести такие вещества, как фенантрен и антрацен, метилциклопропан и циклобутан. А также структурная изомерия характерна для гомологического ряда алканов.
Валентной изомерией называется вид структурной, при котором атомы переходят из одного в другой только благодаря перераспределению связей. То есть у каждого вещества есть свои изомеры: у бензола это призман, бензол Дьюара и бензвален.
Если отличается характер функциональной группы, то говорят о межклассовом типе. К нему относят диметиловый эфир и этанол: СН3-О-СН3 и СН3-СН2-ОН. Отличия в положении одних и тех же кратных связей или функциональных групп при общем углеродном скелете — характерные черты одноименной изомерии. Основные примеры: 4-хлорбутановая кислота или 2-хлорбутановая кислота.
Метамерия — еще один вид изомерии органических соединений. Его особенности заключаются в том, что атомы углерода по-разному распределяются между углеводородными радикалами, которые разделены гетероатомом. Известен этот тип в числе простых и сложных эфиров, аминов и тиоспиртов. Но сегодня это понятие редко используется. А. Бутлеров называл явление изомерией нецельных структур, а наглядными примерами служат диэтиловый и метилпропиловый эфир: СН3СН2ОСН2СН3 и СН3ОСН2СН2СН3.
Особенности стереоизомерии
Причина возникновения пространственной или стереоизомерии — молекулы различаются в пространственной конфигурации, но имеют абсолютно одинаковое химическое строение. Их обозначают с помощью специальной стереохимической номенклатуры, собранной в разделе Е правил ИЮПАК.
Эту группу делят на несколько видов:
Если комбинация пространственных изомеров не составляет пару антиподов, то их относят к диастереомерам. Такие молекулы имеют различную конфигурацию элементов хиральности.
Геометрический вид
Геометрическая классификация характеризуется одинаковым порядком соединения атомов при разном их расположении. В таких изомерах стереогенная группа — это малые циклы или кратная связь. Но они могут существовать только при наличии функциональных соединений. Названия такого явления могут отличаться — транс и цис изомерия.
В первом случае отличающиеся заместители находятся по разные стороны от двойной связи. А во втором одинаковые элементы при разных углеродных атомах имеют общее место расположения. Разные заместители обозначают латинскими буквами E — entgegen или Z — zusammen. Если необходимо установить тип конфигурации, то определяют старшинство атомов, сравнивают их порядковые числа.
Пометку буквой Z имеют изомеры, в которых оба старших заместителя расположены на одной стороне связи. А у E-молекул они находятся по разным бокам. Пример расчетов: вещество с формулой 1-бром-1-хлор-2-нитроэтилена, старшие заместители — Н с номером 1, Br (35), N (7) и Cl (17). В первом атоме углерода главнее бром (35), во втором — азот (7). Они находятся по разным сторонам, поэтому изомер относится к группе E. А если старший заместитель у первого атома Cl (17), а у второго Br (35), то это Z-изомер.
Иногда элементы одинаковы, они связаны с ненасыщенными атомами углерода, тогда необходимо сравнивать второй и третий слой молекулы. Если в конкретном примере заместители одинаковы, то нужно рассматривать следующие группы.
Оптическая группа
В 19 веке ученые выявили, что при пропускании поляризованных лучей через некоторые виды веществ, они отклоняют плоскость света на определенный угол. Есть также два соединения, которые искажают поляризацию на углы, одинаковые по величине, но разные по знаку. Эти молекулы получили название оптических изомеров — энантиомеров или антиподов.
Если в составе смеси содержится одинаковое количество изомеров, которые вращаются в разные стороны, то ее называют рацемической. Вещества, содержащие один и более асимметричных атомов углерода, считаются оптически активными. Два таких изомера отличаются, как какой-либо предмет и его отражение в зеркале. Если их наложить друг на друга, то они не совпадут — хиральные молекулы. Но иногда они полностью идентичны — ахиральные вещества.
К хиральным, кроме углерода, относятся соединения с атомами кремния, фосфора, азота. У них есть общая черта — стереогенная плоскость или ось. Изобразить такие изомеры можно с помощью уравнений Фишера. Ключевые моменты построения:
В этой схеме не нужно рисовать символ атома углерода. Но если центром является другая частица, то ее необходимо подписать. При изображении заместителей строго соблюдают их пространственное расположение.
Химические превращения
Явление, при котором структурные изомеры превращаются один в другой, называют изомеризацией. Эти процессы особенно важны в промышленности. Есть особая технология превращения алканов в изоалканы, что повышает октановое число моторного топлива. Пентан изомеризуется в изопентан, затем его дегидрируют и создают изопрен.
Перегруппировки внутри молекул также считаются изомеризацией. Большое значение в промышленности имеет явление Бекмана — циклогексаноноксим переходит в капролактам, так называется сырье для изготовления капрона.
Рацемизацией является процесс взаимного превращения энантиомеров. Следствие этого явления — исчезновение оптической активности из-за появления эквимолярной смеси отрицательных и положительных форм. Диастереомеры при взаимопревращении образуют тремодинамически устойчивую смесь. А процесс с конформационными изомерами называется одноименным равновесием.
Изомерия приводит к увеличению известных и потенциально возможных соединений. Ученые выявили более 500 видов структурных дециловых спиртов, 1500 пространственных изомеров. Для подсчетов используются специальные математические формулы, а при рассмотрении проблем химического явления применяют топологические методы.
Изомер – определение, типы, пример и тест
Определение изомера
Изомеры – это две молекулы с одинаковой молекулярной формулой, но структурно различающиеся. Следовательно, изомеры содержат одинаковое количество атомов для каждого элемента, но расположение атомов отличается. Несмотря на одинаковую молекулярную формулу, физические свойства каждого молекула может отличаться, особенно если функциональные группы, связанные с каждой молекулой, различны. Изомеризация – это процесс, при котором одна молекула превращается в другую молекулу с одинаковыми атомами. Это может происходить спонтанно или может потребоваться реакция для достижения этого эффекта.
Типы изомеров
Существует два основных типа изомеров: структурные изомеры и стереоизомеры (показаны ниже).
Структурные изомеры
Структурные изомеры различаются в отношении специфического присоединения атомов и функциональных групп. Таким образом, в зависимости от конкретных изомеров, они не могут быть отнесены к одной и той же функциональной группе, и они будут иметь разные названия IUPAC. Типы структурных изомеров включают в себя цепные изомеры (например, углеводородные цепи, демонстрирующие различные схемы разветвления); положение изомеров, которые различаются в зависимости от расположения функциональной группы на цепи; функциональные группы изомеров, в которых функциональная группа дополнительно разделена на различные функциональные группы; и скелетные изомеры, которые имеют различные углеродные цепи. Другим типом структурного изомера является таутомер. Таутомеры самопроизвольно преобразуются между двумя структурными изомерами и проявляют различные свойства в зависимости от конкретной изоформы. Иногда конверсия таутомеров может быть настолько быстрой, что выделение обоих невозможно.
стереоизомеры
Стереоизомеры относятся к изомерам, которые имеют одинаковую структуру связи, но различаются в отношении геометрического положения функциональных групп и атомов. Типы стереоизомеров состоят из энантиомеров, диастереомеров и конформационных изомеров. Энантиомеры являются зеркальными изображениями, которые содержат хиральные центры и не являются наложенными. Диастереомеры не являются зеркальными изображениями, которые могут содержать или не содержать хиральные центры. Конформационные изомеры показывают различные вращения вокруг одинарных связей.
Пример изомера
Есть несколько примеров изомеров, описанных следующим образом:
Метоксиэтан и пропанол
Химическая структура C3H8O существует в виде нескольких изомеров пропанола, а также изомера метоксиэтана. Два изомера пропанола состоят из пропан-1-ола и пропан-2-ола (также известного как изопропиловый спирт), которые отличаются размещением атома кислорода либо на концевом атоме углерода, либо на центральном атоме углерода, соответственно. Метоксиэтан также является изомером C3H8O, но представляет собой простой эфир, так как атом кислорода находится в центре молекулы, а не связан с одним атомом углерода.
Метилацетилен и аллен
Метилацетилен и аллен являются примером изомеров C3H4, которые различаются в зависимости от типа связи, проявляемой молекулами. Метилацетилен имеет одну тройную связь и одну одинарную связь между атомами углерода, а аллен имеет две двойные связи между атомами углерода.
Фульминат и цианат
Фульминат и цианат являются примером изомеров CNO. Фульминат демонстрирует расположение, в котором N связан как с атомами С, так и с О, тогда как в цианате и О, и N связаны с центральным атомом С.
Глюкоза и фруктоза
Глюкоза и фруктоза являются примером изомеров C6H12O6, которые различаются в зависимости от положения атома кислорода с двойной связью. В глюкозе О расположен на первом С, тогда как он расположен на втором С во фруктозе (структуры каждого показаны ниже).
Фармацевтические примеры
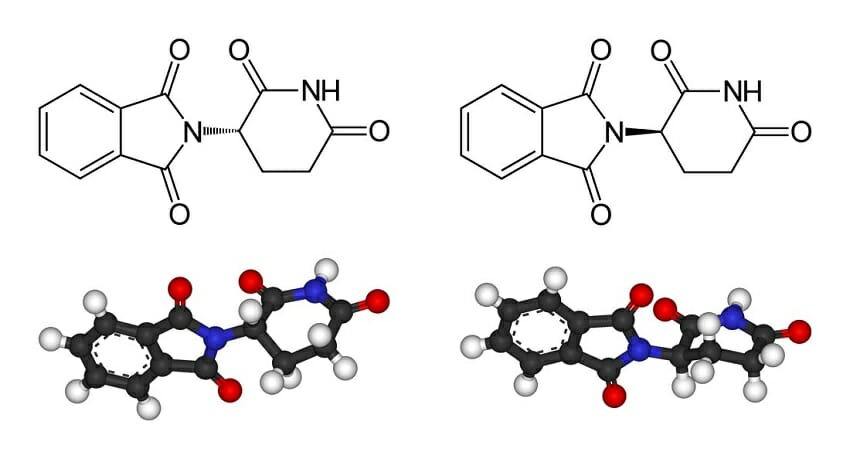
Изомеры чрезвычайно важны при разработке фармацевтических препаратов, поскольку обычно только один изомер конкретной молекулы будет оказывать желаемый эффект. Например, только один изомер ибупрофена будет связываться с необходимой мишенью в организме человека и вызывать облегчение боли. Точно так же цисплатин является эффективным противоопухолевым препаратом, в то время как его изомер, трансплатин, вообще не оказывает противоракового действия. Один из самых известных примеров – талидомид (на фото ниже). Хотя один изомер талидомида является сильнодействующим средством для подавления утреннего недомогания, он был доставлен в соотношении 50:50 со своим стереоизомером, который был ответственен за врожденные дефекты, наблюдаемые у детей, родившихся в 1950-х годах, от матерей, которые принимали препарат.
Ферментативные реакции
викторина
1. Изомеры с одинаковой структурой связи, но геометрическим положением атомов и функциональных групп, известны как:A. Структурные изомерыB. стереоизомерыC. таутомерыD. Цепные изомеры
Ответ на вопрос № 1
В верно. Стереоизомеры отличаются от структурных изомеров, потому что они имеют одинаковую структуру основной связи, но атомы и функциональные группы имеют тенденцию вращаться или располагаться по-разному в пространстве.
2. Молекулы А, В и С являются изомерами. Фермент А связывается с изомером А с образованием изомера В и наоборот, но Фермент А не может связываться с изомером С. Фермент А является примером:A. ИзомеразаB. СтереоизомерC. Структурный изомерD. Конверсионный изомер
Ответ на вопрос № 2
верно. Изомеразы – это специализированные ферменты, которые превращают молекулу в ее изомер. Однако не все изомеры способны связываться с ферментом из-за физической структуры молекулы.
3. Изомеры важны в биологических системах, потому что:A. Различные изомеры могут оказывать различное влияние на организм. XXB. Конкретные изомеры могут потребоваться для ферментативных реакцийC. Фармацевтическая разработка должна учитывать все потенциальные изомеры, чтобы избежать потенциальных вредных побочных эффектов, вызванных непреднамеренным взаимодействием изомеров молекулы при доставке пациентам.D. Все вышеперечисленноеE. Только А и БF. Ни один из вышеперечисленных
Ответ на вопрос № 3
D верно. Поскольку физическая структура часто различается между изомерами, разные изомеры могут по-разному связываться с различными рецепторами или ферментами в организме, вызывая тем самым дифференциальные эффекты. Это может представлять потенциальную проблему в фармацевтической промышленности, если лекарство содержит смесь его изомеров, поскольку такие молекулы могут вызывать непреднамеренные эффекты.