Нашли узел в щитовидной железе что делать
Узловые образования щитовидной железы: современные принципы диагностики и хирургического лечения
В данной статье описаны основные причины узловых образований щитовидной железы, механизм их образования. Основной акцент автора сделан на современные методы диагностики и лечения узловых образований щитовидной железы.
В последние десятилетия отмечается неуклонный рост числа пациентов с патологией щитовидной железы. Исследования, проводимые как у нас в стране, так и зарубежом, показывают, что истинного увеличения частоты эндокринных заболеваний не произошло, просто повысилось качество их диагностики. Сейчас каждый пациент может выполнить ультразвуковое исследование или сдать анализ для определения гормонов щитовидной железы. Зачастую УЗИ щитовидной железы проводится пациентам просто «заодно» с исследованием других органов. Улучшенная диагностика дает свой результат: по статистике у каждого второго- третьего жителя нашей страны есть признаки заболевания щитовидной железы. Между тем, повышения смертности от заболеваний щитовидной железы в последние десятилетия не отмечено.
Узлы щитовидной железы являются наиболее часто встречающимся видом патологии этого органа. Узлом называется участок, отличающийся по плотности или цвету при ультразвуковом исследовании от остальной ткани щитовидной железы и имеющий четкие границы. Если мы ощупываем железу и чувствуем в ней уплотнение с четкими границами- это узел. Если мы делаем УЗИ и видим светлое или темное пятно на фоне остальной ткани железы- это тоже узел. Увеличение обьема щитовидной железы, равно как и наличие в ней узлов, обозначается термином «зоб». О диффузном зобе говорят, когда ткань железы увеличена равномерно и не содержит никаких уплотнений. Узловым зобом называют ситуацию, сопровождающуюся появлением узлов в ткани железы. По современным данным, при ультразвуковом исследовании у 30-67% жителей Росси в ткани щитовидной железы могут быть выявлены узлы. В подавляющем большинстве случаев (95%) узлы эти являются доброкачественными, и только у 5% пациентов они представляют собой злокачественные опухоли. С возрастом частота выявления узлов возрастает. У детей узлы щитовидной железы- редкость, в то время как в возрасте 60 лет и старше до 80% людей имеют узлы. Но у детей и мужчин злокачественные узлы выявляются в 2 раза чаще, чем у взрослых и женщин соответственно. Соотношение мужчин и женщин примерно 1:10.
Узловые образования могут быть как доброкачественными (коллоидные узлы, фолликулярные аденомы, кисты и воспалительные заболевания щитовидной железы), так и злокачественными (рак щитовидной железы- папиллярный, фолликулярный, В-клеточный, медуллярный, анапластический и др).
Причины возникновения узлов
В настоящее время считается, что основной причиной возникновения узлов щитовидной железы является хроническая нехватка йода в пище. Йодная обеспеченность населения влияет на количество доброкачественных узлов щитовидной железы (так называемых коллоидных узлов). Часть узлов, в основном представленная опухолями, возникает после воздействия потока ионизирующего излучения на организм человека. Определенное значение имеет и наследственность. Известно, что у родственников пациентов с заболеваниями щитовидной железы вероятность выявления узлов повышена.
Механизм появления узлов
По механизму появления узлы щитовидной железы можно разделить на две основные группы- опухоли и «не-опухоли». Опухолевые узлы появляются из-за возникновения мутации в одной из клеток щитовидной железы (А, В, или С-типа). Причиной мутации является повреждение генетического материала клетки, находящегося в ее ядре. Это повреждение может быть вызвано радиацией, воздействием некоторых химических веществ (например, тяжелых металлов). В ряде случаев такие мутации могут передаваться по наследству. Доброкачественные опухоли, увеличиваясь, раздвигают окружающую ткань щитовидной железы. Увеличение опухоли приводит к атрофии ткани железы вследствие сдавления ее тканью опухоли. Клетки доброкачественного образования не приобретают способности к инфильтративному росту, т.е. проникновению между клетками щитовидной железы. Основным свойством злокачественных опухолей является возможность инфильтративного роста. Опухоль может врастать не только в щитовидную железу, но и в окружающие органы- трахею, пищевод, мышцы, сосуды.
Метастазирование происходит гематогенным и лимфогенным путем. Свойства опухоли напрямую зависят от типа клетки, в которой произошла мутация. А-клетки являются источником возникновения фолликулярных аденом и карцином, папиллярной карциномы, анапластичского рака, В-клетки (клетки Гюртля) дают начало Гюртле-клеточным аденомам и карциномам, а С-клетки- медуллярной карциноме щитовидной железы.
Современные методы диагностики
А. Осмотр: осмотр позволяет выявить увеличение щитовидной железы, асимметрию размеров долей, характерную для наличия узлов, увеличенных лимфоузлов, а также ряд других важных для диагностики признаков (нервозность и суетливость пациента, экзофтальм, характерный для тиреотоксикоза блеск глаз и т.д.). Важна информация о быстром росте выявленного узла, появление осиплости голоса, кашля, нарушений при глотании и дыхании.
Б. Ультразвуковое исследование (УЗИ) является следующим этапом диагностического процесса. В ходе исследования возможно выявление участков неоднородности в ткане щитовидной железы размером 2-3 мм. Чувствительность УЗИ значительно превышает возможности пальпации. Известно, что у 20-50% пациентов с одиночным узлом, выявленным при пальпации, УЗИ позволяет выявить дополнительные узлы. Важно при проведении УЗИ выполнить и доплеровское исследование, т.е. исследование интенсивности кровотока внутри узла. Основное предназначение УЗИ при обследовании пациентов с узлами- выявить тех, кому необходимо проведение ТАБ. По современным представлениям, образования размером меньше 1 см можно не подвергать дальнейшим исследованиям. Все узлы, диаметром 1 см и более- подлежат проведению исследования клеточного состава узла- тонкоигольной аспирационной биопсии (ТАБ). Никакие другие методы исследования, кроме биопсии, не позволяют надежно исключить злокачественность узла.
В. Тонкоигольная аспирационная биопсия. Методика исследования заключается в следующем. Под контролем УЗИ врач проводит пункцию (укол) в узел щитовидной железы щитовидной железы тонкой иглой, подсоединенной к пустому шприцу. После того, как кончик иглы оказывается внутри узла, врач несколько раз аспирирует (всасывает) содержимое узла шприцем. Затем игла извлекается и содержимое узла наносится на лабораторные стекла. Чаще всего производится 2-3 укола в разные участки узла для получения достаточного количества биологического материала и исключения возможности ошибки. Вся процедура занимает не боле 1 минуты и прекрасно переносится всеми пациентами. На место укола наклеивается стериальная наклейка и через 5-10 минут пациент может отправляться по своим делам. Через 2 часа после биопсии можно мыться, заниматься спортом и т.д.Результатом ТАБ является получение цитологического заключения, описывающего природу узла. В настоящее время, согласно современным классификациям, практически все цитологические заключения сводятся к 5 основным вариантам:1. «Коллоидный узел». Пунктированный узел является доброкачественным неопухолевым образованием. Признаков рака нет, как нет и вероятности «перерождения» узла в злокачественную опухоль.2. «Тиреоидит Хашимото» («Аутоиммунный тиреоидит». Пунктированное образование является участком воспалительных изменений в ткани щитовидной железы. Признаков злокачественного роста нет, ситуация совершенно благоприятна.3. «Фолликулярная опухоль». Ситуация подозрительна в отношении наличия злокачественного процесса в пунктируемом узле. Известно, что среди фолликулрных опухолей 85% представлены аденомами (т.е. являются доброкачественными), а 15%- карциномами. 4. «Папиллярная карцинома», «Медуллярная арцинома», «Плоскоклеточная карцинома», «Анапластическая карцинома», «Лимфома». Пунктированный узел является злокачественной опухолью. 5. «материал неинформативен». Подобные ответы составляют 4-5 % заключений. Проводят повторное исследование.
Г.Исследование крови на уровень гормонов. Для решения вопроса о состоянии функции щитовидной железы достаточно определения уровня тиреотропного гормона (ТТГ) в крови. При отклонении уровня ТТГ за пределы установленной нормы пациенту рекомендуют провести исследование уровня свободных фракций гормонов Т3 (трийодтиронина) и Т4 (тироксина) для уточнения диагноза. Также проводится определение титра антител к ткани щитовидной железы- антител к тиреопероксидазе (АТ к ТПО). Поышенный титр антитл свидетельствует о наличии у пациента аутоиммунной реакции, позволяет выявить некоторые заболевания щитовидной железы- аутоиммунный тиреоидит. Повышение уровня кальцитонина убедительно свидетельствует о наличии у человека медуллярной карциномы. Определение антител к рецептору гормона ТТГ- высокий уровень свидетельствует о наличии у человека диффузного токсического зоба.
Д. К дополнительным методам относится сцинтиграфия щитовидной железы с изотопами йода или технеция. Исследование помогает определить уровень накопления препаратов в ткани щитовидной железы и в узлах, и тем самым выявить участки, не накапливающие препарат, а значит не вырабатывающие гормоны, и другие- интенсивно накапливающие изотопы, в значит гормонально активные. Р-графия пищевода с контрастированием барием позволяет видеть контур пищевода, который может быть отклонен при сдавлении крупным узлом. КТ и МРТ шеи- изучение распространения увеличенной железы в грудную клетку при выявлении загрудинного зоба, лимфаденопатию грудной полости, показать сдавление пищевода или трахеи.
Хирургическое лечение пациентов с доброкачественными узлами проводится в следующих случаях
Оперативное лечение показано всем пациентам, получившим цитологическое заключение о наличии в исследуемом узле рака щитовидной железы или при подозрении на наличие злокачественной опухоли, т.е. при цитологической картине фолликулярной опухоли (в настоящее время не методик, позволяющих четко определить характер подобных узлов).
В радикальном лечении также нуждаются пациенты, страдающие диффузно- токсическим зобом (болезнь Грейвса), если через 1,5-2 года после курса медикаментозной терапии тиреостатиками возник рецидив тиреотоксикоза. В некоторых случаях операция назначается раньше: обьем щитовидной железы более 40мл, непереносимость лекарственных препаратов, планирование беременности.
При аутоиммунных тиреоидитах в оперативном лечении нуждаются пациенты с гипертрофической формой тиреоидита (зоб Хашимото), при которой происходит значительное увеличение обьма щитовидной железы, т.е. при развитии компрессионного синдрома- нарушение глотания и дыхания.
Нашли узел в щитовидной железе что делать
Нетоксический зоб представляет собой увеличение щитовидной железы. Зоб может быть спорадическим или эндемическим (в районах с дефицитом йода). При аутопсии, узлы щитовидной железы обнаруживают примерно у 50% умерших. По всей видимости, этиология зоба многофакторная, задействованы как генетические факторы, так и факторы окружающей среды.
Показатели ТТГ у пациентов с зобом обычно находятся в пределах нормы, поэтому, по всей видимости, заболевание не зависит от ТТГ. Нетоксический зоб чаще встречается у женщин, часто болеют несколько членов семьи. Очень крупный зоб может причинять физические неудобства, но в большинстве случаев зоб протекает бессимптомно. Иногда зоб может смещать трахею, пищевод и сосуды шеи, становится причиной стридора и дисфагии.
В последние годы как бессимптомный зоб, так и рак щитовидной железы стали диагностироваться гораздо чаще. Связано это с разработкой и внедрением методов компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), дуплексного сканирования сонных артерий. Узлы щитовидной железы в популяции встречаются достаточно часто. В районах с достаточным содержанием йода пальпируемые узлы щитовидной железы обнаруживаются у 5% женщин и 1% мужчин. «Инсиденталомы» щитовидной железы представляют собой непапильпируемые лимфоузлы, которые, тем не менее, обнаруживаются на УЗИ высокого разрешения.
Они встречаются у 19-67% населения. Меньшая их часть, 5-15%, являются злокачественными; большинство же представляет собой простые доброкачественные узлы. И хотя заболеваемость раком щитовидной железы возросла, увеличения смертности за этим не последовало. Вероятно, это связано с тем, что рак часто обнаруживается на ранней стадии, когда размер первичной опухоли невелик. Дифференцированный рак щитовидной железы, к которому относится папиллярный и фолликулярный рак, составляет около 90% всех злокачественных опухолей щитовидной железы.
В период с 1973 по 2002 гг. заболеваемость раком щитовидной железы возросла более чем в 2,4 раза, в первую очередь за счет увеличения заболеваемости папиллярным раком.
Сбор анамнеза и осмотр помогают уточнить природу опухоли. Признаками, указывающими на злокачественность, являются мужской пол, пожилой возраст, отягощенный семейный анамнез по раку щитовидной железы. Также риск рака щитовидной железы возрастает у пациентов, подвергшихся в детстве воздействию ионизирующего излучения: лучевое лечение акне, лимфогранулематоза, облучение тимуса. Риск повышен у лиц, находившихся вблизи очагов ядерных аварий, например, на Чернобыльской АЭС. Также на злокачественную природу опухоли указывают ее быстрый рост, лимфоаденопатия, парез/паралич голосовых складок.
Учитывая высокую распространенность в популяции узлов щитовидной железы и очень благоприятный прогноз при папиллярных микрокарциномах, узлы размером менее 1 см в большинстве случаев обследования не требуют, кроме случаев, когда присутствует дополнительная клиническая симптоматика. Как правило, у пациентов с раком щитовидной железы содержание тиреоидных гормонов в крови находится на нормальном уровне, но риск рака несколько выше у пациентов с болезнью Грейвса. На рисунке ниже изображен алгоритм действий врача при обнаружении узлов щитовидной железы.
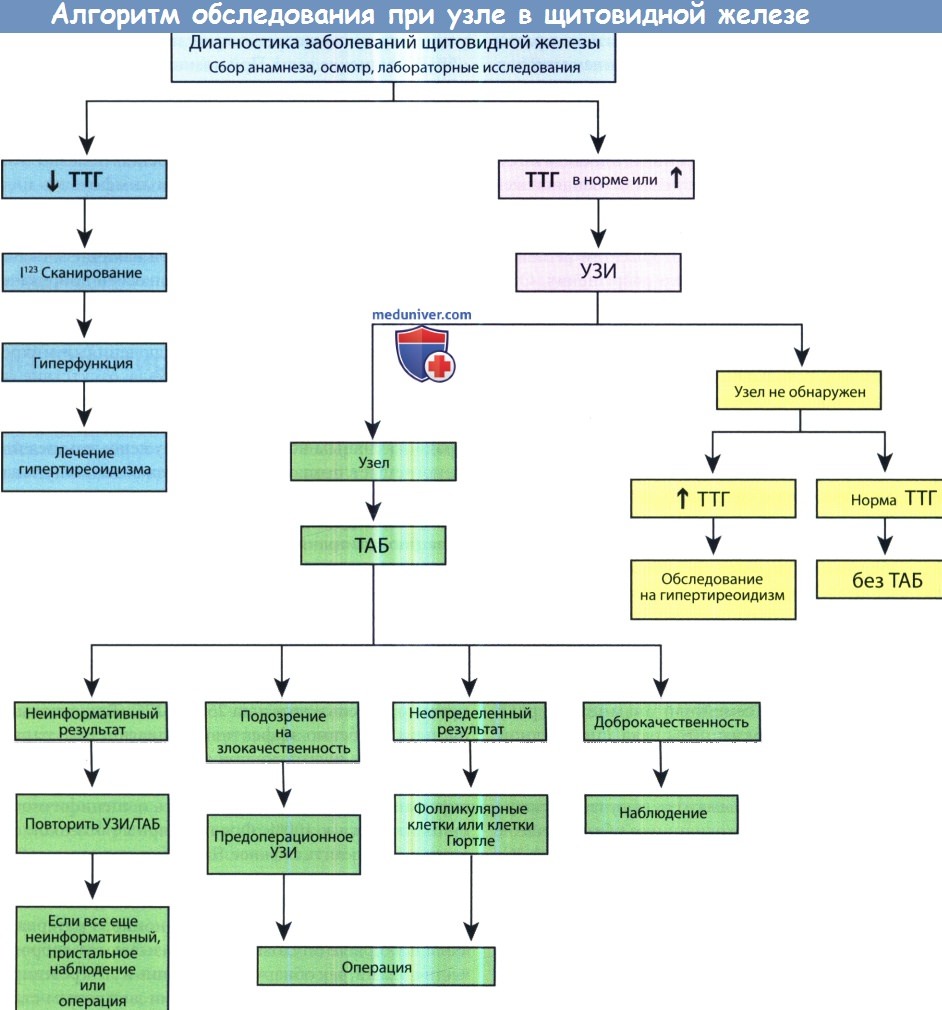
ТАБ — тонкоигольная аспирационная биопсия; ТТГ—тиреотропный гормон.
а) Дополнительные методы обследования при узле щитовидной железы. При помощи УЗИ можно обнаружить узлы даже совсем небольших размеров. Согласно данным одного исследования, у 65% пациентов при ультразвуковом исследовании щитовидной железы обнаружились ее узлы. При помощи УЗИ можно определить гетерогенную эхоструктуру псевдоузлов при тиреоидите Хашимото, а допплерография позволяет обнаружить усиление кровотока в тканях железы при болезни Грейвса. Особенно полезно УЗИ в описании ткани самой железы и лимфоузлов шеи.
УЗИ является методом выбора при обследовании пациента с узлами щитовидной железы, а определенные признаки позволяют предположить наличие злокачественного новообразования. Признаками доброкачественности являются гиперэхогенность и кистозная структура узла. Признаками малигнизации являются гипоэхогенный узл, особенно с включениями микрокальцификатов; неровными края узла; отсутствие гало; превышение вертикального размера узла над горизонтальным. Если при исследовании с радиоактивным йодом 131 обнаружено, что узел йод не поглощает, показана аспирационная тонкоигольная биопсия узла под контролем УЗИ.
При обнаружении узла, подозрительного на малигнизацию, выполняется его тонкоигольная биопсия. Данный метод диагностики, особенно при выполнении его под контролем УЗИ, имеет превосходные чувствительность и специфичность, превышающие 90%. Метод прост в исполнении, безопасен, не доставляет дискомфорта пациенту. В материале должно содержаться как минимум 10-15 клеток, полученных за 3-6 вколов. Как правило, используется игла 25 или 27G. Тонкоигольная биопсия особенно эффективна в диагностике папиллярного рака, поскольку при цитологическом исследовании раковые клетки характеризуются четкими изменениями в ядрах; чувствительность и специфичность приближаются к 100%.
Фолликулярные опухоли, напротив, определить сложнее. Часто биоптат оказывается неинформативным, и для постановки окончательного диагноза требуется удаление пораженной доли железы с последующим изучением операционного материала. Фолликулярные опухоли часто оказываются доброкачественными, рак обнаруживают лишь в 20% резецированных желез. Недавно коммерчески доступным стало исследование на мутацию BRAF. Данная мутация часто встречается при папиллярном и фолликулярном раке, выявление BRAF помогает спланировать лечение при получении неинформативного биоптата.
Риск обнаружении рака у пациентов с множественными узлами такой же, что и у пациентов с единичным узлом. Согласно рекомендациями Американского общества щитовидной железы, биопсии подлежат лимфоузлы размером более 1 см и имеющие признаки злокачественности при УЗИ. Если при УЗИ крупный узел выглядит доброкачественным, рекомендуется повторное выполнение УЗИ. При увеличении узла на 50% или на 2 мм и больше в двух измерениях необходимо выполнение биопсии.
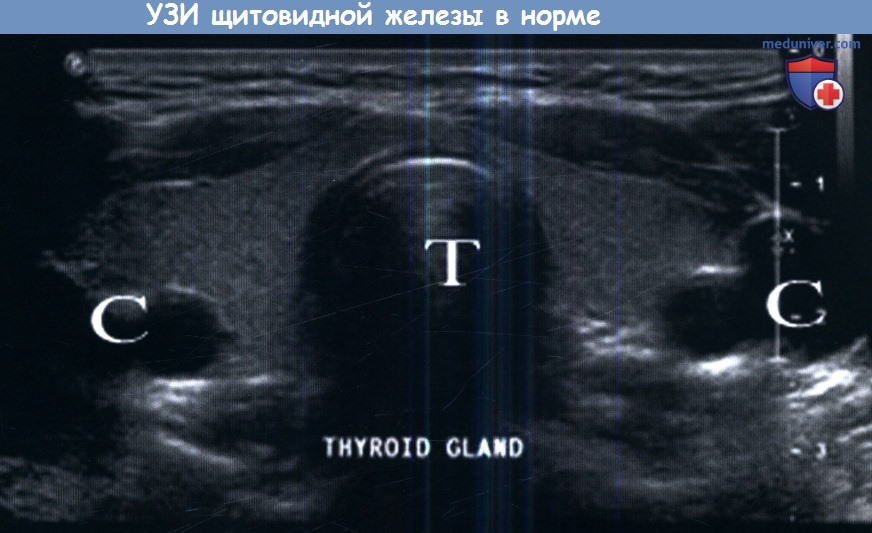
Железа лежит над и вокруг трахеи, а также над сонными артериями.
Т, treachea — Т, трахея; С, carotid artery — С, сонные артерии; Thyroid gland — Щитовидная железа.
б) Эпидемиология (частота) рака щитовидной железы. В большинстве случаев рак щитовидной железы представлен дифференцированными формами. 80% всех злокачественных опухолей щитовидной железы составляет папиллярный рак, 15% — фолликулярный рак. Медуллярный рак, нейроэндокринная опухоль вырабатывающих кальцитонин клеток щитовидной железы, встречается в 3% случаев и может быть связана с множественной эндокринной неоплазией II типа. Анапластический рак, отличающийся агрессивным течением, составляет 1-2% от всех злокачественных опухолей щитовидной железы. Иногда на фоне тиреоидита Хашимото развивается лимфома щитовидной железы, заподозрить ее нужно при появлении новообразования, быстро увеличивающегося в размерах.
в) Классификация и стадирование рака щитовидной железы. Рак щитовидной железы сталируется на основании его формы, размера опухоли, распространения за пределы железы, наличия метастазов в лимфатические узлы, возраста пациента.
Опухоли Т1а имеют размер 1 см и меньше, T1b — 1-2 см.
Т2 — опухоль 2-4 см, не распространяется за пределы железы.
Т3 — опухоль более 4 см без распространения за пределы железы, либо любые опухоли с ограниченным ростом за пределы опухоли (в грудино-щитовидную мышцу или окружающие железу мягкие ткани).
Т4а — опухоль любого размера, распространяющаяся в гортань, трахею, пищевод, возвратные гортанные нервы или подкожную клетчатку.
Т4b — опухоль прорастает в превертебральную фасцию или включает в себя сонную артерию. Описанная выше система стадирования относится ко всем формам рака, за исключением анапластического.
Любой анапластический рак считается опухолью Т4: Т4а — опухоль ограничена пределами железы, Т4b — опухоль распространяется за пределы железы.
N1a — поражение лимфоузлов VI уровня (предтрахеальные, паратрахеальные, предгортанные).
N1b — поражение шейных, заглоточных или верхних медиастинальных лимфоузлов с обеих, либо с одной стороны.
Папиллярный и фолликулярный рак. У пациентов моложе 45 лет выставляется стадия I, за исключением наличия отдаленных метастазов, при которых выставляется II стадия. У пациентов старше 45 лет опухоль Т1 соответствует I стадии, опухоль Т2 соответствует II стадии. Стадия III — Т3 с№), либо Т1-Т3сN1а. Стадия IVA — Т1-Т3 с N1b, либо опухоль Т4а. Стадия IVB — опухоль Т4b без отдаленных метастазов. При наличии отдаленных метастазов выставляется стадия IVC.
Медуллярный рак. Стадия I — первичная опухоль Т1. Стадия II — Т2-Т3 без метастазов в лимфоузлы. Стадия III — Т1-Т3 с лимфоузлами Nla. Стадия IVA — Т1-Т3 с N1b, либо опухоль Т4а. Стадия IVB-все опухоли Т4b. Стадия IVC выставляется при наличии отдаленных метастазов.
Анапластический рак. Любой анапластический рак щитовидной железы соответствует IV стадии заболевания. Стадия IVA—Т4а, стадия IVB — Т4b. Стадия IVC выставляется при наличии отдаленных метастазов.
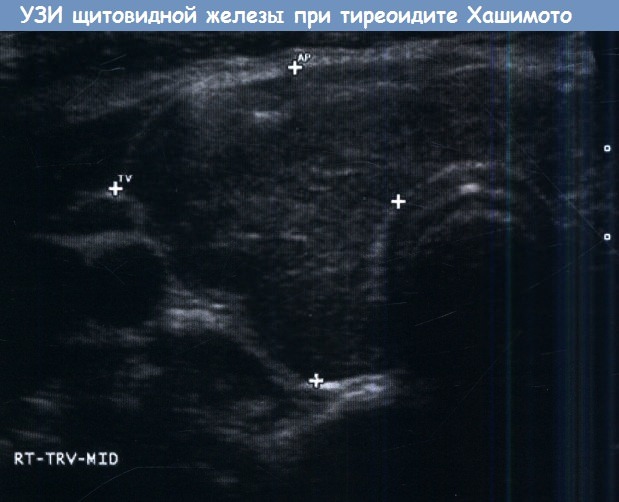
характерные для тиреоидита Хашимото. 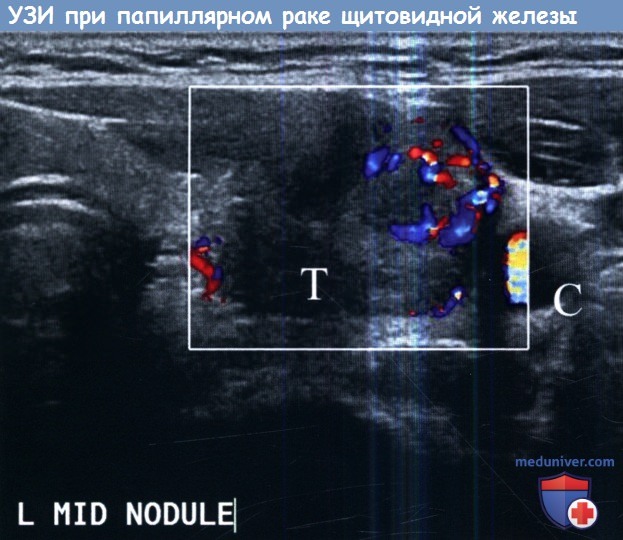
Визуализируются нечеткие границы опухоли, микрокальцификаты, повышенное кровенаполнение тканей при допплерографии.
Т — трахея; С — сонные артерии.
г) Лечение рака щитовидной железы. Основой лечения рака щитовидной железы является хирургическая резекция. Выполняется тиреоидэктомия, а при наличии показаний и шейная лимфодиссекция. При опухолях размером менее 1 см и отсутствии других угрожающих признаков возможно выполнение лобэктомии. Тиреоидэктомия также показана при неопределенном состоянии узла, выраженной атипии при цитологическом исследовании, отягощенном семейном анамнезе по раку щитовидной железы, воздействии ионизирующего облучения. Перед операцией рекомендуется выполнение УЗИ щитовидной железы и лимфатических узлов шеи. Для подтверждения метастазов в лимфоузлы выполняется их тонкоигольная биопсия под контролем УЗИ. После хирургического лечения прогноз и наблюдения основываются на стадии заболевания по системе TNM.
д) Послеоперационное лечение при раке щитовидной железы. В зависимости от результатов гистологического исследования, перенесшим тиреоидэтомию пациентам может быть показана терапия радиоактивным йодом. При низком риске рецидива дополнительное лечение обычно не требуется, оно проводится больным с опухолями большого размера, либо с распространением первичной опухоли за пределы железы. Абляция небольшого количества остаточной нормальной щитовидной ткани после тиреоидэктомии может способствовать раннему обнаружению рецидива на основе определения концентрации тиреоглобулина плазмы. Согласно последним данным, при малом риске рецидива низкие дозы радиоактивного йода обладают такой же эффективностью, что и более высокие дозировки.
Терапия высокими дозами может использоваться у пациентов с гистологически агрессивными формами рака (высококлеточный, инсулярный рак). Пациентам, которым проводится терапия радиоактивным йодом, может быть показана отмена левотироксина до достижения уровня ТТГ в 30 мМЕ/л, также они должны придерживаться диеты с низким содержанием йода. Иногда вместо отмены левотироксина можно назначать рекомбинантный ТТГ, показавший в исследованиях аналогичный краткосрочный риск рецидива. Через неделю после курса терапии радиоактивным йодом проводится посттерапевтическое сканирование всего тела с целью обнаружения отдаленных метастазов.
Дифференцированные раковые клетки щитовидной железы экспрессируют рецепторы к ТТГ, поэтому в ответ на стимуляцию ТТГ они начинают интенсивно делиться, а также продуцируют некоторые специфические белки. Для подавления продукции ТТГ и снижения риска рецидива проводится терапия левотироксином. У пациентов со средним и высоким риском рецидива рекомендуется подавление уровня ТТГ ниже 0,1 мМЕ/л. Пациентам с низким риском рецидива допустимо поддерживать уровень ТТГ на уровне нижней границы нормы или чуть меньше (0,1-0,5 мМЕ/л).
При дифференцированном раке щитовидной железы необходимо длительное наблюдение. Пациентам, которым не выполнялась тотальная ларингэктомия и терапия радиоактивным йодом 131, в послеоперационном периоде необходим контроль уровня тиреоглобулина и антител к тиреоглобулину, а также УЗИ органов шеи. Антитела к тиреоглобулину (АТ-ТГ), обнаруживаемые примерно у 25% пациентов с раком щитовидной железы, могут приводить к ложному занижению показателей тиреоглобулина. Примерно 20% пациентов без симптомов заболевания, у которых на фоне гормональной супрессии ТТГ уровни тиреоглобулина плазмы находятся на уровне ниже 1 нг/мл, через год после проведения операции на фоне стимуляции ТТГ показатели тиреоглобулина плазмы достигнут определяемых значений.
Примерно у одной трети данных пациентов возникнет рецидив или персистирование рака, в то время как у других 2/3 показатели стимулированного тиреоглоубилина постепенно снизятся, либо останутся на прежнем уровне. При появлении рецидива опухоли в лимфоузлах или мягких тканях шеи, необходимо повторное оперативное вмешательство.
е) Ключевые моменты:
• Тонкоигольная биопсия является чувствительным и специфичным методом диагностики папиллярного рака щитовидной железы. После анализа операционного материала только 20% всех фолликулярных образований щитовидной железы оказываются злокачественными.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021


