Натрий 2 со3 что это
Карбонат натрия: способы получения и химические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
Что такое карбонат натрия
Карбонат натрия – это кальцинированная сода или же безводный карбонат натрия. Когда-то ею мыли посуду, а пищевую соду (гидрокарбонат натрия) добавляли в тесто. Школьники отмывали и той, и другой содой следы чернил с поверхности парт. Каждый узнает о химической формуле и происхождении этого мелкокристаллического порошка белого цвета в школе.
Получение вещества
Химическая формула карбоната натрия – Na2CO3 (натриевая соль слабой угольной кислоты). Содой пользовались еще со времен Древнего Египта. Тогда источником кальцинированной соды были естественные месторождения, такие пласты залегали в слоях земной коры. Теперь натрия карбонат выделяют из некоторых минералов. В природе источником соды служат содовые озера, которые расположены в Забайкалье, в США, а самое популярное озеро в Танзании.
Позже научились добывать соду из золы морских водорослей и некоторых прибрежных растений. Благодаря названию растения Salsola Soda (солянка содоносная) карбонат натрия получил свое название в быту. Его добыча из водорослей являлась основным способом производства вплоть до 19 века.
Химическая промышленность не стояла на месте. В 1791 году французский ученый химик Леблан запатентовал метод превращения глауберовой соли в натриевую соль. Так впервые в лабораторных условиях получили кальцинированную соду. Пищевая сода появилась позже. В 1861 году бельгийский инженер-химик Сольве запатентовал промышленный способ создания соды путем соединения хлорида натрия, аммиака и диоксида углерода. Этот метод получения карбоната натрия используют и сейчас.
Видео: получение карбоната натрия из пищевой соды
Применение кальцинированной соды
Карбонат натрия широко применяется в технической и химической промышленности. Его используют при производстве стиральных порошков и чистящих средств, стекла и чугуна. Соду применяют в мыловарении, для смягчения воды, либо для полного устранения ее жесткости. Также ее используют в текстильной и нефтепромышленности. Помогает кальцинированная сода и в быту.
Карбонат натрия в быту
Натрия карбонат замечательно справляется с накипью на посуде. Достаточно в воду добавить 1-2 столовые ложки кальцинированной соды и прокипятить в течение 30 минут, и чайник засияет, как новый. Не забудьте после чистки сполоснуть чайник от содового порошка чистой водой.
Сода избавит от нагара на посуде снаружи. Следует на губку насыпать немного нашего чудо-порошка и потереть поверхность, с которой нужно убрать загрязнение. Эмаль на кастрюлях и чайнике засияет, как новая, а жирные пятна и нагар исчезнут.
Кальцинированная сода поможет чистить унитаз, ванну и умывальник. Убрать загрязнение, плесень, ржавчину и ужасный осадок с сантехники можно при помощи карбоната натрия. Для этого нужно ½ стакана соды всыпать в чашу унитаза, затем туда же влить столько же 9% уксуса, тщательно распределить смесь по внутренней части унитаза туалетным ершиком и дать постоять так от 15 до 30 минут. Время выдержки зависит от степени загрязнения и количества пятен. Затем хорошо промыть поверхность водой.
Чтоб вычистить внешнюю часть унитаза и другую керамику в ванной, смешайте карбонат натрия с водой до состояния мягкой кашицы. Ее следует нанести ее на обрабатываемую поверхность губкой, выдержать от 10 минут или более, а после смыть уксусным раствором. По окончании работ промойте все чистой водой. Помните о мерах предосторожности: проводите манипуляции в хорошо проветриваемом помещении (откройте двери, окно или включите вытяжку), а кожу рук защищайте резиновыми перчатками.
Натрия карбонат замечательно выполняет функции пятновыводителя и деликатного отбеливателя для тканей. Чтоб вывести пятно, следует смешать столовую ложку бельевой соды (она же кальцинированная сода) с водой и нанести на пятно. Через 15 минут смойте раствор. Если пятно не исчезло, процедуру требуется повторить. Желаете усилить эффект – вместо воды добавьте нашатырный спирт или перекись водорода. Чтобы отбелить одежду, замочите ее на 2-5 часов в таком растворе: пять ложек соды и две ложки нашатыря на пять литров чистой воды. Далее белье тщательно прополощите и постирайте, как обычно.
Обратите внимание: этот рецепт поможет устранить желтизну с тканей, если в этом растворе белье прокипятить не менее получаса.
Можно ли кальцинированной содой стирать в машинке? Конечно – загрузите в лоток для порошка полстакана соды и включайте привычную программу.
Бельевая сода используется и для ручной стирки. На пять литров чистой воды добавьте 5 столовых ложек содового порошка и раствор готов для стирки. Такие рецепты стирки, отбеливания не подойдут для деликатных тканей – шелка, шерсти, кашемира и др.
Ремонтные работы
Сода – превосходная помощница во время ремонта. Если требуется обновить покрытие пола, а тратить время на скобление от старой краски нет времени и сил, тогда заранее посыпьте карбонатом натрия поверхность, накройте влажной мешковиной, и через 12 часов снять старую краску не составит труда.
Если желаете избавиться от засора в трубах, то с этой задачей легко справится натрия карбонат. Достаточно полстакана соды залить 2-3 литрами кипятка, чтобы устранить проблему. Засыпаем соду в слив, заливаем кипяток, оставляем на тридцать минут, через полчаса смываем большим количеством воды.
Водный раствор кальцинированной соды легко отчистит бытовую технику от пыли, грязи, жира и других загрязнений. При въевшихся пятнах рекомендуется потереть влажной губкой с нанесенной на нее кашицей из соды и воды. Точно так можно проводить влажную уборку в доме добавляя немного карбоната натрия в воду.
Работая с карбонатом натрия, помните о безопасности. Предохраняйте от попадания вещества и раствора слизистую глаз, рта, открытую кожу, защищайте руки перчатками, избегайте отравления и аллергических реакций (возможны зуд, жжение и покраснение). Держите порошок подальше от детей. Все работы проводите в хорошо проветриваемых помещениях.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Использование соды в кулинарии
Карбонат натрия (кальцинированную соду) в кулинарии применять нельзя. Для пищевых продуктов используют только гидрокарбонат натрия (пищевая сода, NaHCO3), он входит в состав многих продуктов, разрыхлителей, применяется для улучшения вкуса мяса и рыбы, добавляет воздушности тесту. Многие рецепты не обходятся без пищевой соды.
Важно! В кулинарии применяют только пищевую соду – бикарбонат натрия.
Видео: отличия кальцинированной и пищевой соды
Польза и вред карбонатов натрия
Использование питьевой соды (пищевой, гидрокарбоната натрия, бикарбоната натрия, натрия двууглекислого) способно улучшить состояние здоровья. Доказано, что пищевая сода
Чрезмерное использование NaHCO3 (бикарбоната натрия, пищевой соды) может повысить кислотность желудка вследствие инверсных реакций. Перед использованием того или иного метода лечения натрием двууглекислым обязательно проконсультируйтесь со своим семейным доктором.
А вот карбонат натрия (соду кальцинированную) внутрь применять нельзя. При использовании этого вещества для уборки всегда помните о мерах предосторожности и дозировке. Кальцинированная сода не просто вызывает раздражение, а разъедает кожу, поэтому если она попала туда, необходимо как можно скорее смыть порошок или его раствор большим количеством воды.
Карбонат натрия (кальцинированная сода) обладает сильным разъедающим действием.
Упаковывается кальцинированная сода чаще всего в плотный полиэтилен, масса колеблется от 125 грамм в упаковке до мешков весом в 25 килограмм. Транспортировка не требует специальных условий, поэтому перевозят карбонат натрия обычным способом. Но помните о высокой гигроскопичности соды, поэтому нужно предупредить попадание влаги при хранении и транспортировке.
Не стоит путать кальцинированную соду с пищевой. Для стирки и уборки применяется и та, и другая разновидность соды. А вот в пищевых целях используют исключительно натрий двууглекислый, поэтому будьте внимательны!
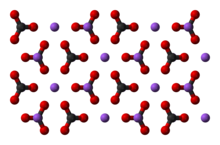
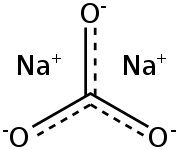
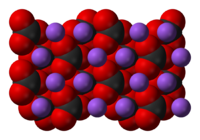
Карбонат натрия
| Карбонат натрия | |
  | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | динатрий триоксокарбонат [1] |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Химическая формула | Na 2 C O 3 |
| Физические свойства | |
| Отн. молек. масса | 106 а. е. м. |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Температура плавления | 852 °C |
| Температура кипения | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| Рег. номер EINECS | 207-838-8 |
Содержание
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Сульфид натрия реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказал фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода). [источник не указан 293 дня]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Карбонат натрия (кальцинированная сода) Название и функция вещества:
Карбонат натрия (кальцинированная сода) — регулятор кислотности; окислитель. Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Примечания
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Прочие: Воск (E900—909) • Глазурь (E910—919) • Восстановитель (E920—929) • Газ для упаковки (E930—949) • Заменители сахара (E950—969) • Вспениватель (E990—999)
Полезное
Смотреть что такое «Карбонат натрия» в других словарях:
КАРБОНАТ НАТРИЯ — (сода, стиральная сода), белая кристаллическая соль (Na2CO3 ) обычно получаемая из хлорида натрия (поваренной соли, NaCL), и АММИАКА При помощи ПРОЦЕССА СОЛЬВЕ. Дегидратированная (безводная) форма (На2СО3) известна как кальцинированная сода,… … Научно-технический энциклопедический словарь
карбонат натрия — углекислый натрий … Cловарь химических синонимов I
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
Карбонат серебра(I) — Общие Систематическое наименование … Википедия
Карбонат калия — Карбонат калия … Википедия
Натрия гидроксид — Гидроксид натрия [править] Наименование едкий натр, каустик, каустическая сода, едкая щелочь Химическая формула Na OH Молярная масса 39.9971 г/моль … Википедия
Натрия гидрокарбонат — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
НАТРИЯ КАРБОНАТ — Natrii carbonas. Синонимы: натрий углекислый, сода неочищенная, угленатриевая соль. Свойства. Белый рыхлый порошок, хорошо поглощающий воду, щелочной реакции. Легко растворяется в воде, частично распадается с образованием едкой щелочи и гидрокар … Отечественные ветеринарные препараты
Карбонат марганца(II) — Карбонат марганца(II) … Википедия