Митозы в клетках стромы есть что значит
Митозы в клетках стромы есть что значит
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
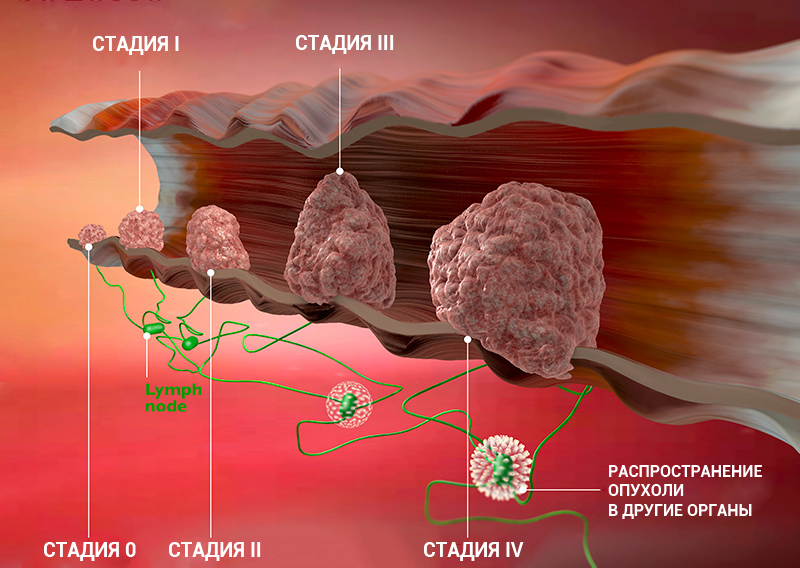
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Митозы в клетках стромы есть что значит
Опухолевые клетки отличаются от нормальных нарушениями прочной сопряженности между процессами роста и дифференцировки [9]. Увеличение темпа воспроизводства озлокачествленных клеток обеспечивается не столько через укорочение митотического цикла, сколько за счет возрастания количества тех элементов, которые вместо достижения терминальной степени дифференцировки остаются во фракции роста [6, 11, 13]. В качестве еще одного механизма немалую роль играет «карикатурная» сигнальная связь, то есть нарушенная интеграция между малигнизированными клетками, проходящими через этапы дифференцировки, и микроокружением [2, 4]. Достигнут значительный прогресс в области изучения морфофункциональных особенностей слизистой оболочки желудка при предраке и раке, отчасти связанный с развитием высокочувствительных способов выявления в гистологических срезах отдельных тканевых и клеточных компонентов [1, 3]. Однако многие аспекты структурно-метаболической перестройки слизистой оболочки желудка при ее малигнизации остаются предметом дискуссий, и поиск изменений, предшествующих возникновению опухоли, по-прежнему актуален [5, 10].
Материал и методы исследования
Срезы окрашивали гематоксилином и эозином в комбинации с реакцией Перлса, по ван Гизону с окраской эластических волокон резорцин-фуксином Вейгерта, ставили ШИК-реакцию. Полутонкие срезы окрашивали реактивом Шиффа и азуром II. Исследования проводили в универсальном микроскопе Leica DM 4000B (Германия). Ультратонкие срезы, контрастированные уранилацетатом и цитратом свинца, исследовали в электронном микроскопе JEM 1010 при ускоряющем напряжении 80 кВт.
Результаты исследования и их обсуждение
Светооптическое исследование первичных опухолей пациентов 1-й группы выявило превалирование зрелых форм аденокарцином, характеризующихся формированием папиллярных и тубулярных железистых структур, умеренно выраженной тканевой и клеточной атипией, появлением патологических митозов, в разной степени выраженными фиброзными изменениями стромы. В низкодифференцированной аденокарциноме среди обширных скоплений опухолевых клеток или фиброзных полей с трудом обнаруживались мелкие железы, степень анаплазии опухолевых клеток возрастала. Перстневидно-клеточный рак отличался диффузным распределением клеток типичной перстневидной формы и, как правило, отсутствием десмопластической реакции стромы.
Особый интерес представляло изучение состояния слизистой оболочки желудка в отдаленных от опухоли участках. При кишечном типе рака светооптическое исследование фрагментов пилорического отдела желудка во всех наблюдениях выявило наличие распространенной неполной кишечной метаплазии. Обращала на себя внимание атрофия слизистой оболочки, иногда выраженная, с заметным истончением собственной пластинки, дистрофическими изменениями покровно-ямочного эпителия и уменьшением количества желез [7]. Диспластические изменения эпителия от слабой до тяжелой степени (увеличение ядерно-цитоплазматического соотношения, снижение секреции мукоида, псевдомногорядность, повышение митотической активности) обнаружены в большинстве исследованных фрагментов. Характерна многофокусность диспластических изменений, нарастающих по направлению к опухолевому очагу.
В фундальном отделе желудка очаговая кишечная метаплазия эпителиоцитов отмечена у 25% пациентов. Диспластические изменения энтеролизованного и интактного эпителия выявлены в половине наблюдений. Мононуклеарная инфильтрация отличалась слабой интенсивностью и поверхностной локализацией. В целом, патологические изменения в фундальном отделе желудка носили менее выраженный характер по сравнению с пилорическим отделом.
При изучении регионарных лимфатических узлов обращали внимание на наличие, размер и множественность метастазов. У пациентов с аденокарциномами метастазы в лимфатических узлах обнаружили у 37% больных.
Таким образом, светооптическое исследование первичных опухолей желудка пациентов 1-й группы выявило преобладание зрелых форм аденокарцином, характеризующихся формированием капиллярных и тубулярных железистых структур, умеренно выраженной тканевой и клеточной атипией. В большинстве случаев зрелых аденокарцином опухолевый очаг хорошо отграничен от окружающих тканей стенки желудка. Перстневидно-клеточный рак отличался диффузным распределением изолированных округлой формы клеток, содержащих в цитоплазме большое количество слизи. Опухоль характеризовалась инфильтративным ростом и была плохо отграничена от окружающих тканей [8, 12].
Новообразования у пациентов 2-й группы состояли из полиморфных либо мономорфных по составу анапластических клеток, располагающихся в виде тяжей, комплексов, или изолированно друг от друга. Клеточные ядра различались по основным светооптическим характеристикам: форме, размерам, окраске. Наиболее часто в клетках недифференцированного рака желудка встречались крупные гиперхромные угловатой формы ядра, а также небольшие светлые пузырьковые ядра. Цитоплазма была, как правило, скудная и плохо различима. Анализ частоты и выраженности патологических изменений нетрансформированной слизистой оболочки обнаружил их сходство с перифокальными процессами при диффузном типе карцином в первой группе наблюдений, что свидетельствует об определенном гистогенетическом единстве этих вариантов рака желудка. Ведущим патологическим изменением являлась дисплазия генеративных зон желудочного эпителия на фоне атрофически-склеротических процессов. Метастазы в регионарных лимфатических узлах обнаружены у 38% пациентов, что соответствует аналогичному показателю в первой группе.
Таким образом, светооптическое исследование опухолей желудка пациентов 2-й группы выявило наличие недифференцированного рака с солидным или скиррозным характером роста. Опухолевый очаг был плохо отграничен от окружающих тканей стенки желудка, отличался инфильтративным ростом и латеральным распространением опухоли по подслизистому слою.
Смешанные формы (3-я группа) сочетали в одном опухолевом очаге участки аденокарцином с различной степенью дифференцировки (часто с перстневидными клетками) либо разные патогистологические варианты рака желудка. Морфологическая картина отражала направление «дедифференцировки» клеточных популяций от центра к периферии опухоли. Практически во всех исследованных случаях карцинома распространялась в глубь желудочной стенки, инвазируя подслизистый, мышечный, иногда серозный слои, в ряде наблюдений комплексы раковых клеток выявлялись в большом сальнике или брыжейке поперечной ободочной кишки.
В слизистой оболочке вне опухолевого очага у 60% пациентов имелась кишечная метаплазия, ограниченная пилорическим отделом желудка; с такой же частотой встречались атрофия, склероз и густая полиморфно-клеточная инфильтрация. Наличие метастазов в регионарных лимфатических узлах выявлено у 60% оперированных больных этой группы, что значительно превышало данные первых двух анализируемых групп.
Таким образом, светооптический анализ перифокальных процессов в слизистой оболочке при различных патогистологических формах рака желудка показал, что при высоко- и умереннодифференцированных аденокарциномах наиболее типичными изменениями являются распространенная неполная кишечная метаплазия и ассоциированная с этими участками дисплазия на фоне диффузной атрофии эпителия. При низкодифференцированной и перстневидно-клеточной аденокарциномах, а также при недифференцированном раке желудка на первый план выходят атрофические изменения слизистой оболочки и дисплазия генеративных зон эпителия [14].
Электронно-микроскопический анализ аденокарциномы желудка выявил множественные патологические изменения ультраструктуры малигнизированных клеток: большие, неправильной формы ядра с изрезанными контурами и неравномерным распределением крупноглыбчатого гетерохроматина в кариоплазме, увеличенным количеством ядрышек, иногда атипичными митозами.
При перстневидно-клеточном раке желудка преобладали опухолевые клетки с переполненной секреторными гранулами цитоплазмой и эксцентрически расположенным ядром аномальной формы. Слизистая оболочка желудка вне опухолевого очага отличалась мозаичностью ультраструктурной картины. В очагах кишечной метаплазии, кроме типичных покровно-ямочных эпителиоцитов, обнаружены также каемчатые и бокаловидные клетки, цитоплазма которых была переполнена крупными электронно-прозрачными глобулами слизи, а уплощенные ядра оттеснены к базальному полюсу клеток. На апикальной поверхности каемчатых эпителиоцитов выявлялись высокие, нерегулярно расположенные микроворсинки. В цитоплазматическом матриксе большое число митохондрий и развитая гранулярная цитоплазматическая сеть. Отражением атрофических процессов в слизистой оболочке желудка было наличие большого числа эпителиоцитов, почти лишенных микроворсинок, имеющих электронно-плотную цитоплазму с едва различимыми органеллами. В дистрофически измененных клетках покровно-ямочного эпителия наблюдалось уменьшение количества секреторных мукоидных гранул, среди которых преобладали незрелые, с плотным содержимым и неровными контурами. Диспластические изменения эпителиоцитов выражались в увеличении размеров ядер, появлении крупных ядрышек, значительном снижении содержания внутриклеточного муцина.
При недифференцированном раке желудка преобладали атипичные клетки с гладкими, лишенными микроворсинок контурами. Клеточные ядра отличались большими размерами, с глубокими инвагинациями в нуклеолемме, придающими ядру причудливую двухлопастную или трехлопастную форму. Изучение желудка при недифференцированном раке на отдалении от первичной опухоли показало высокую степень развития атрофически-склеротических процессов слизистой оболочки и наличие диспластических изменений эпителия, ассоциированных с генеративными зонами (желудочные ямки, верхние отделы шеек желез). Неполная кишечная метаплазия носила очаговый характер и была ограничена, как правило, пилорическим отделом желудка. Анализ частоты и выраженности патологических изменений нетрансформированной слизистой оболочки при недифференцированном раке выявил их сходство с перифокальными процессами при диффузном типе карцином в первой группе наблюдений, что свидетельствует об определенном гистогенетическом единстве этих вариантов рака желудка.
Ультраструктурный анализ карцином желудка со смешанным типом строения подтвердил полиморфизм тканей и клеточную атипию, обнаруженные при светооптическом исследовании. В участках опухоли обнаружили злокачественные клетки с признаками секреции слизи в виде различных по размеру гранул, содержащих муцин. При снижении уровня дифференцировки по направлению к периферии опухоли наблюдалось прогрессирующее изменение ядерно-цитоплазматического соотношения в сторону увеличения размеров ядер. В слизистой оболочке желудка на отдалении от опухолевого очага в ряде случаев отсутствовали патологические изменения покровно-ямочного эпителия. По мере приближения к опухолевому очагу нарастала выраженность и гетерогенность изменений эпителиальных структур слизистой оболочки желудка. Анализ перифокальных процессов в окружающей слизистой оболочке желудка выявил меньшую распространенность и частоту предраковых изменений (дисплазии, неполные кишечные метаплазии и атрофии эпителия), чем в других исследованных группах пациентов. В целом, это свидетельствует о более высоких темпах опухолевой прогрессии смешанных форм карцином желудка.
Проведен комплексный морфологический анализ, включающий световую и электронную микроскопию опухолевых очагов, нетрансформированной слизистой оболочки, и регионарных лимфатических узлов при раке желудка. По результатам микроскопического исследования слизистой оболочки желудка на отдалении от опухолевого очага у пациентов с высоко- и умереннодифференцированными карциномами желудка установлено, что наиболее типичными изменениями являются распространенная неполная кишечная метаплазия и ассоциированная с этими участками дисплазия. В прилежащих к опухоли участках слизистой оболочки нередко обнаруживалась неравномерная гиперплазия эпителия. При низкодифференцированной и перстневидно-клеточной карциномах, а также при недифференцированном раке желудка на первый план выходит дисплазия генеративных зон эпителия; неполная кишечная метаплазия носит очаговый характер.
Патологоанатомическая диагностика состояния эндометрия по биопсиям : методические рекомендации
Патологоанатомическая диагностика состояния эндометрия по биопсиям / Прянишников В.А., Топчиева О.И. ; под. ред. проф. О.К. Хмельницкого. — Ленинград.
Методические рекомендации составлены старшим научным сотрудником, кандидатом медицинских наук В.А. Прянишниковым и кандидатом медицинских наук О.И. Топчиевой.
Редактор — профессор О. К. Хмельницкий
Диагностика по биопсиям эндометрия часто представляет большие трудности в связи с тем, что одна и та же очень сходная микроскопическая картина эндометрия бывает обусловлена различными причинами (О.И. Топчиева 1968). Кроме того, ткань эндометрия отличается исключительным многообразием морфологических структур, зависящим от уровня стероидных гормонов, секретогруемых яичниками в норме и при патологических условиях, связанных с нарушением эндокринной регуляции.
код для вставки на форум:
ПАТОЛОГОАНАТОМИЧЕСКАЯ ДИАГНОСТИКА СОСТОЯНИЙ ЭНДОМЕТРИЯ ПО БИОПСИЯМ
Точная микроскопическая диагностика по соскобам эндометрия имеет большое значение для повседневной работы акушера-гинеколога. Биопсии (соскобы) эндометрия составляют значительную часть материала, направляемого акушерско-гинекологическими стационарами для микроскопического исследования.
Диагностика по биопсиям эндометрия часто представляет большие трудности в связи с тем, что одна и та же очень сходная микроскопическая картина эндометрия бывает обусловлена различными причинами (О. И. Топчиева 1968). Кроме того, ткань эндометрия отличается исключительным многообразием морфологических структур, зависящим от уровня стероидных гормонов, секретируемых яичниками в норме и при патологических условиях, связанных с нарушением эндокринной регуляции.
Опыт показывает, что ответственная и сложная диагностика изменений эндометрия по соскобам оказывается полноценной только при наличии тесного контакта в работе между патологоанатомом и гинекологом.
Использование гистохимических методов, наряду с классическими морфологическими методами исследования, существенно расширяет возможности патологоанатомической диагностики и включает такие гистохимические реакции как реакция на гликоген, щелочную и кислую фосфатазы, моноаминоксидазу и др. Применение этих реакций позволяет более точно оценивать степень нарушения баланса эстрогенов и гестагенов в организме женщины, а также дает возможность определять степень и характер гормоночувствительности эндометрия при гиперпластических процессах и опухолях, что имеет большое значение при выборе методов лечения этих заболеваний.
МЕТОДИКА ПОЛУЧЕНИЯ И ПОДГОТОВКА МАТЕРИАЛА ДЛЯ ИССЛЕДОВАНИЯ
Важное значение для правильной микроскопической диагностики по соскобам эндометрия имеет соблюдение ряда условий при заборе материала.
Первым условием является правильное определение времени, которое наиболее благоприятно для производства выскабливания. Существуют следующие показания для проведения выскабливания:
Вторым условием является технически правильное проведение выскабливания полости матки. “Точность” ответа патологоанатома в значительной степени зависит от того, как взят соскоб эндометрия. Если для исследования поступают мелкие, раздробленные кусочки ткани, то крайне затруднительно или даже невозможно восстановить структуру эндометрия. Это устранимо при правильном произведении выскабливания, целью которого является получение по возможности крупных нераздробленных полосок ткани слизистой матки. Это достигается тем, что после проведения кю-ретки по стенке матки она должна быть каждый раз выведена из цервикальното канала, а полученная при этом ткань слизистой осторожно складывается на марлю. В том случае если кюретка не выводится каждый раз, то отделенная от стенки матки слизистая при повторных движениях кюретки измельчается и часть ее остается в полости матки.
При наличии кровотечения, особенно у женщин, находящихся в климактерическом периоде или в менопаузе, следует выскоблить маленькой кюреткой трубные углы матки, помня, что именно в этих участках могут локализоваться поли-позные разрастания эндометрия, в которых наиболее часто встречаются участки малигнизации.
Если при выскабливании из матки удалено большое количество ткани то необходимо отправить в лабораторию весь материал целиком, а не часть его.
Методику цугов ни в коем случае не следует применять при наличии маточных кровотечений, так как в таких случаях необходимо иметь для исследования эндометрий с поверхности всех стенок матки.
Аспирационная биопсия — получение кусочков ткани эндометрия путем отсоса из полости матки, может быть рекомендована для массовых профилактических осмотров женщин в целя1Х выявления предопухолевых состояний и рака эндометрия в “группах повышенного риска”. Вместе с тем отрицательные результаты аспирационной биопсии не позволяю! с уверенностью отвергнуть начальные формы бессимптомно протекающего рака. В связи с этим, при подозрении на рак тела матки наиболее надежным и единственно показанным диагностическим методом остается [полное выскабливание полости матки (В. А. Мандельштам, 1970).
После произведения биопсии, врач, посылающий материал для исследования, должен заполнить сопроводительное направление л о предлагаемой нами форме.
В направлении должно быть указано:
Имеют также значение данные о:
Гистологическая обработка материала 6иопсий включает фиксацию в 10% нейтральном растворе формалина с последующим обезвоживанием и заливкой в парафин. Можно использовать также ускоренный метод заливки в парафин по Г.А. Меркулову с фиксацией в формалине, нагретом до 37°С в термостате в течение 1—2 часов.
В повседневной работе можно ограничиться окраской препаратов гематоксилин-эозином, по Ван-Гизону, муцикармином или альциановьим оитаим.
Криостатные срезы, полученные из нефиксированной ткани эндометрия, замороженной при температуре жидкого азота (—196°) могут быть использованы не только для исследования с помощью обычных гистологических методов окраски (гематоксилин-эозин и др.), но также для определения содержания гликогена и активности ферментов в морфологических структурах слизистой матки.
Для проведения гистологических и гистохимических исследований с биопсий эндометрия на криостатных срезах патологоанатомическая лаборатория должна быть оснащена следующим оборудованием: криостат марки МК-25, жидкий азот или углекислота (“сухой лед”), сосуды Дьюара (или бытовой термос), PH-метр, холодильник на +4°С, термостат или водяная баня. Для получения криостатных срезов можно использовать метод, разработанный В.А.Прянишниковым с сотрудниками (1974).
Согласно этому методу выделяют следующие этапы приготовления криостатных срезов:
ИЗМЕНЕНИЯ В ЭНДОМЕТРИИ, НАБЛЮДАЕМЫЕ НА ПРОТЯЖЕНИИ ДВУХФАЗНОГО МЕНСТРУАЛЬНОГО ЦИКЛА
Базальный слой содержит немногочисленные узкие железы, выстланные цилиндрическим однорядным эпителием, клетки которого имеют овальные, интенсивно окрашивающиеся гематоксилином ядра. Реакция ткани базального слоя на гормональные воздействия выражена слабо и непостоянно.
Из ткани базального слоя происходит регенерация функционального слоя после различных нарушений его целостности: отторжения в менструальную фазу цикла, при дисфунк-циональных кровотечениях, после абортов, родов, а также после выскабливания.
Функциональный слой является тканью с особой, биологически обусловленной высокой чувствительностью к половым стероидным гормонам—эстрогенам и гестагенам, под воздействием которых изменяется его структура и функция.
Высота функционального слоя у половозрелых женщин колеблется в зависимости от фазы менструального цикла: около 1 мм в начале фазы пролиферации и до 8 мм в фазе секреции—в конце 3-й недели цикла. В этом периоде в функциональном слое наиболее отчетливо обозначаются глубокий, спонгиозный слой, где железы расположены более тесно, и поверхностный—компактный, в котором преобладает цито-генная строма.
В основе циклических изменений морфологической картины эндометрия, наблюдаемых на протяжении менструального цикла лежит способность половых стероидов—эстрогенов вызывать характерные изменения в структуре и поведении ткани слизистой тела матки.
Так, эстрогены стимулируют пролиферацию клеток желез и стромы, способствуют регенераторным процессам, обладают сосудорасширяющим действием и повышают проницаемость капилляров эндометрия.
Прогестерон оказывает действие на эндометрий только после предварительного воздействия эстрогенов. В этих условиях гестагены (прогестерон) вызывают: а) секреторные изменения в железах, б) децидуальную реакцию клеток стромы, в) развитие спиральных сосудов в функциональном слое эндометрия.
Указанные выше морфологические признаки были положены в основу морфологического деления менструального цикла па фазы и стадии.
Согласно современным представлениям менструальный цикл делят на:
При оценке изменений, происходящих в эндометрии соответственно дням менструального цикла, необходимо учитывать:
Фаза пролиферации продолжается 14 дней, однако, и в физиологических условиях она может быть удлиненной или укороченной в пределах 3 дней. Изменения, наблюдаемые в эндометрии фазы пролиферации, возникают в результате действия нарастающего количества эстрогенов, секретируемых растущим и созревающим фолликулом.
Наиболее выраженные морфологические изменения в фазу пролиферации отмечаются в железах. В ранней стадии железы имеют вид прямых или слепка извитых трубочек с узким просветом, контуры желез округлые или овальные. Эпителий желез однорядный низкий цилиндрический, ядра овальные, расположены у основания клеток интенсивно окрашены гематоксилином. В поздней стадии железы приобретают извилистые, иногда штопорообразные очертания с несколько расширенным просветом. Эпителий становится высоким призматическим, отмечается большое количество митозов. В результате интенсивного деления и увеличения количества эпителиальных клеток ядра их находятся на различном уровне. Для клеток эпителия желез ранней фазы пролиферации характерно отсутствие гликогена и умеренная активность щелочной фосфатазы. К концу фазы пролиферации в железах отмечается появление мелких пылевидных гранул гликогена и высокая активность щелочной фосфатазы.
В строме эндометрия на протяжении фазы пролиферации происходит увеличение делящихся клеток, а также тонкостенных сосудов.
Фаза секреции, непосредственно связанная с гормональной активностью менструального желтого тела и соответствующей секрецией прогестерона, длится 14±1 дней. Укорочение или удлинение фазы секреции более, чем на два дня, у женщин, находящихся в репродуктивном периоде, следует рассматривать как патологическое состояние, поскольку такие циклы оказываются стерильными.
На протяжении первой недели фазы секреции день произошедшей овуляции определяется по изменениям в эпителии желез, в то время как во второй неделе этот день наиболее точно может быть определен по состоянию клеток стромы эндометрия.
Так, на 2-й день после овуляции (16-й день цикла) в эпителии желез появляются субнуклеарные вакуоли. На 3-й день после овуляции (17-й день цикла) субнуклеарные вакуоли оттесняют ядра в апикальные отделы клеток, в результате чего последние находятся на одном уровне. На 4-й день после овуляции (18-й день цикла) вакуоли частично передвигаются из базальных отделов в апикальные и к 5-му дню (19-й день цикла) практически все вакуоли перемещаются в апикальные отделы клеток, а ядра—смещаются в базаль-ные отделы. В последующие 6-й, 7-й и 8-й дни после овуляции, т. е. на 20-й, 21-й и 22-й дни цикла в клетках эпителия желез отмечаются выраженные процессы апокриновой секреции, в результате которой апикальные “рая клеток имеют как бы зазубрины, неровные. Просвет желез в этот период как правило расширен, заполнен эозинофилыным секретом, стенки желез становятся складчатыми. На 9-й день после овуляции (23-й день менструального цикла) секреция желез закончена.
Использование гистохимических методов позволило установить, что субнуклеарные вакуоли содержат крупные гранулы гликогена, которые на протяжении ранней и в начале средней стади фазы секреции выбрасывается путем апокриновой секреции в просвет желез. Наряду с гликогеном в просвете желез содержатся также кислые мукополисахариды. По мере накопления гликогена и секреции его в просвет желез происходит отчетливое снижение активности щелочной фосфатазы в клетках эпителия, которая практически полностью исчезает к 20—23 дню цикла.
В строме характерные изменения для фазы секреции начинают появляться на 6-й, 7-й день после овуляции (20-й, 21-й день цикла) в виде возникновения периваскулярной децидуаподобной реакции. Наиболее выражена эта реакция в клетках стромы компактного слоя и сопровождается увеличением цитоплазмы клеток, они приобретают полигональные или округлые очертания, отмечается накопление гликогена. Характерным для этой стадии фазы секреции является также появление клубков спиральных сосудов не только в глубоких отделах функционального слоя, но и в поверхностном компактном слое.
Следует подчеркнуть, что наличие спиральных артерий в функциональном слое эндометрия является одним из наиболее достоверных признаков, определяющих полноценный гестагенный эффект.
Наоборот, субнуклеарная вакуолизация в эпителии желез не всегда является признаком, указывающим на произошедшую овуляцию и начавшуюся секрецию прогестерона желтым телом.
Субнуклеарные вакуоли могут иногда обнаруживаться в железах смешаното гипопластического эндометрия при д.ис-функциональных маточных кровотечениях у женщин любого возраста, включая и период менопаузы (О. И. Топчиева, 1962). Однако, в эндометрии, где возникновение вакуолей не овязано с овуляцией, они содержатся в отдельных железах или в группе желез как правило только в части клеток. Сами вакуоля имеют различную величину, наиболее часто они мелкие.
В поздней стадии фазы секреции, с 10-го дня после ову-ляшии, т. е. на 24-й день цикла, в овязи с началом регресса желтого тела и снижением уровня прогестерона в крови в эндометрии наблюдаются морфологические признаки регресса, а на 26-й и 27-й день присоединяются признаки ишемии. В результате сморщивания стромы функционального слоя железы приобретают звездообразные очертания на поперечных срезах и пилообразные на продольных.
Регенерация эндометрия происходит за счет пролиферации клеток базальных отделов желез и заканчивается в течение 24—48 часов.
ИЗМЕНЕНИЯ ЭНДОМЕТРИЯ ПРИ НАРУШЕНИИ ЭНДОКРИННОЙ ФУНКЦИИ ЯИЧНИКОВ
С точки зрения этиологии, патогенеза, а также с учетом клинических симптомов морфологические изменения в эндометрии, возникающие при нарушении эндокринной функции яичников, могут быть разделены на три группы:
Вне зависимости от характера перечисленных выше нарушений эндокринной функции яичников, наиболее распространенными симптомами, с которыми встречаются клиницисты и морфологи являются маточные кровотечения и аменорея.
1. Изменения эндометрия при нарушении секреции эстрогенных гормонов
а) в недостаточном количестве эстрогенов и образовании нефункционирующего (покоящегося) эндометрия.
б) в продолжительной секреции эстрогенов из персистирующих фолликулов, сопровождающейся ановуляторными монофазными циклами. Удлиненные однофазные циклы, возникающие в результате длительной персистенции фолликула, приводят к развитию дисгормональной пролиферации эндометрия типа железистой или железистокистозной гиперплазии.
Структура железистой гиперплазии эндометрия, в которой не содержится кистевидно расширенных желез, называется “.простой гиперплазией”.
В зависимости от выраженности пролиферативных процессов железистую гиперплазию эндометрия делят на “активную” и “покоящуюся” (которые соответствуют состояниям “острой” и “хронической” эстрогении). Для активной формы характерно большое количество митозов как в клетках эпителия желез, так и в клетках стромы, высокая активность щелочной фосфатазы и появление скоплений “светлых” клеток в железах. Все эти признаки указывают на интенсивную эстроген.ную стимуляцию (“острая эстрогения”).
Необходимо иметь в виду также, что дисгормональна.я пролиферация эндометрия может возникнуть и при наличии цилиоэпителиальных и псевдомуцинозных кистом яичника, как малигнизированных так и доброкачественных, а также при некоторых других новообразованиях яичника, например при опухоли Бреннера (М. Ф. Глазунов 1961).
2. Изменения эндометрия при нарушении секреции гестагенов
Гиполютеиновые циклы при недостаточности желтого тела в 25% случаев бывают укороченными; овуляция обычно наступает своевременно, но секреторная фаза может быть укорочена до 8 дней. Наступающая раньше времени менструация связана с преждевременной гибелью неполноценного желтого тела и прекращением секреции протестерона.
Гистологические изменения в эндометрии при гиполютеиновых циклах заключаются в неравномерном и недостаточном секреторном превращении слизистой. Так, например, незадолого перед наступлением менструации, яа 4-й неделе цикла, наряду с железами, свойственными поздней стадии фазы секреции, имеются железы, резко отстающие в своей секреторной функции и соответствующие только началу фазы секреции.
Предецидуальные превращения соединительнотканных клеток строимы бывают выражены крайне слабо или отсутствуют вовсе, спиральные сосуды — недоразвиты.
В первом случае изменения, возникающие в эндометрии были названы ультраменструальной гипертрофией и имеют сходство со структурами, наблюдаемыми при беременности раннего срока. Слизистая утолщена до 1 см, секреция интенсивная, имеется выраженное децидуаподобное превращение стромы и развитие спиральных артерий. Дифференциальная диагностика с нарушенной беременностью (у женщин репродуктивного возраста) — крайне затруднительна. Отмечают возможность возникновения подобных изменений и эндометрии женщин климактерического периода (у которых беременность можно исключить).
В случае снижения гормональной функции желтого тела, когда оно подвергается неполному постепенному регрессу, процесс отторжения эндометрия замедляется и сопровождается удлинением фазы кровотечения в виде менорагии.
Микроскопическая картина соскобов эндометрия, полученных при таких кровотечениях после 5-го дня, представляется весьма пестрой: в соскобе обнаруживаются участки некроти-зирующейся ткани, участки в состоянии обратного развития, секреторный и пролиферативный эндометрий. Такие изменения в эндометрии могут быть обнаружены у женщин с ациклическими дисфункциональными маточньгми кровотечениями, находящихся в климактерическом периоде.
Иногда воздействие низких концентраций прогестерона приводит к замедлению его отторжения, инволюции, т. е. обратному развитию глубоких отделов функционального слоя. Этот процесс создает условия для возвращения эндометрия к той исходной структуре, которая была перед началом циклических изменений и встречается три аменорее, обусловленной так называемыми “скрытыми циклами” или скрытой менструацией (Е. И. Кватер 1961).
3. Эндометрий “смешанного типа”
Эндометрий называют смешанным, если в его ткани содержатся структуры, одновременно отражающие воздействие эстрогенных и гестагенных гормонов.
Различают две формы смешанного эндометрия: а) смешанный гипопластический, б) смешанный гиперпластический.
Строение смешанного гипопластического эндометрия представляет пеструю картину: функциональный слой слабо развит и представлен железами индифферентного типа, а такдее участками с секреторными изменениями, митозы встречаются крайне редко.
Такой эндометрий встречается у женщин репродуктивного возраста с гипофункцией яичников, у женщин в климактерическом периоде с дисфункциональными маточными кровотечениями, при кровотечениях в менопаузе.
К гиперпластическому смешанному эндометрию может быть отнесена железистая гиперплазия эндометрия с выраженными признаками воздействия гестагенных гормонов. Если среди тканей железистой гиперплазии эндометрия наряду с типичными железами, отражающими эстрогенный эффект, имеются участки с групп ами желез, в которых секреторные признаки, то такую структуру эндометрия называют — смешанной формой железистой гиперплазии. Наряду с секреторными изменениями в железах, наблюдаются также изменения в строме, а именно: очаговое децидуаподобное превращение соединительнотканных клеток и образование клубков спиральных сосудов.
ПРЕДРАКОВЫЕ СОСТОЯНИЯ И РАК ЭНДОМЕТРИЯ
Несмотря на большую противоречивость данных о возможности возникновения рака эндометрия на фоне железистой гиперплазии, большинство авторов считает, что возможность прямого перехода железистой гиперплазии в рак эндометрия маловероятна (А. И. Серебров 1968; Я. В. Бохмаи 1972), Однако в отличие от обычной (типичной) железистой гиперплазии эндометрия атипическая форма (аденоматоз) многими исследователями рассматривается как предрак (А. И. Серебров 1968, Л. А. Новикова 1971 и др.).
Аденоматоз представляет собой патологическую пролиферацию эндометрия, в которой утрачиваются черты, свойственные гормональной гиперплазии и появляются атипические структуры, имеющие сходство со злокачественными разрастаниями. Аденоматоз разделяют по распространенности на диффузный и очаговый, а по выраженности пролиферативных процессов — на нерезкую и выраженную формы (Б.И. Железной, 1972).
Несмотря на значительное разнообразие морфологических признаков аденоматоза, большинство встречающихся в практике патологоанатома форм имеет ряд характерных морфологических признаков.
Значительные трудности возникают у морфолога при попытке проведения дифференциальной диагностики между выраженными пролиферативными формами аденоматоза и высокодифференцированными вариантами рака эндометрия. Для выраженных форм аденоматоза характерны интенсивная пролиферация и атипизм железистого эпителия в виде увеличения размеров клеток и ядер, что позволило Хертигу с соавт. (1949) назвать такие формы аденоматоза “нулевой стадией” рака эндометрия.
Однако в связи с отсутствием четких морфологических критериев этой формы рака эндометрия (в отличие от аналогичной формы рака шейки матки) использование этого термина при диагностике по соскобам эндометрия не представляется оправданным (Е. Новак 1974, Б. И. Железнов 1973).
Рак эндометрия
Большинство существующих классификаций эпителиальных злокачественных опухолей эндометрия основано на принципе степени выраженности дифференцировки опухоли (М.Ф. Глазунов, 1947; П.В. Симповский и О.К. Хмельницкий, 1963; Е.Н. Петрова, 1964; Н.А. Краевский, 1969).
Согласно этой классификации выделяют следующие морфологические формы рака эндометрия:
Необходимо подчеркнуть, что более 80% злокачественных эпителиальных опухолей эндометрия составляют аденокарциномы различной степени дифференцировки.
Отличительной чертой опухолей с гистологическими строениями высокодифференцированных раков эндометрия является то, что железистые структуры опухоли, хотя и имеют признаки атипии, тем не менее все же напоминают обычный эндометриальный эпителий. Железистые разрастания эндометрия эпителия с папиллярными выростами окружены скудными прослойками соединительной ткани с незначительным количеством сосудов. Железы выстланы высоко- и низко-призматическим эпителием со слабо выраженным полиморфизмом и относительно редко встречающимися митозами.
По мере снижения дифференцировки железистые раки теряют признаки, свойственные эндометриальному эпителию, в них начинают преобладать железистые структуры альвеолярного, трубчатого или папиллярного строения, которые не отличаются по своему строению от железистых раков другой локализации.
По гистохимическим признакам высокодифференцированные железистые раки напоминают эпителий эндометрия, так как в значительном проценте содержат гликоген и дают реакцию на щелочную фосфатазу. Кроме того, указанные формы рака эндометрия обладают высокой чувствительностью к гормонотерапии препаратами синтетических гестагенов (17-оксипрогестерон капроноат), под действием которых в опухолевых клетках развиваются секреторные изменения, накапливается гликоген, снижается активность щелочной фосфатазы (В. А. Прянишников, Я. В. Бохман, О. Ф. Че-пик 1976). Значительно реже подобный дифференцирующий эффект гестагенов развивается в клетках умереннодиффе-ренцированных раков эндометрия.
ИЗМЕНЕНИЯ В ЭНДОМЕТРИИ ПРИ НАЗНАЧЕНИИ ГОРМОНАЛЬНЫХ ПРЕПАРАТОВ
В настоящее время в гинекологической практике широко используются препараты эстрогенов и гестагенов для лечения дисфункциональных маточных кровотечений, некоторых форм аменореи, а также в качестве противозачаточных средств.
Используя различные сочетания эстрогенов и гестагенов можно искусственно получить в эндометрии человека морфологические изменения, свойственные той или иной фазе менструального цикла при нормально функционирующих яичниках. Принципы, лежащие в основе гормонотерапии дисфункциональных маточных кровотечений и аменореи, базируются на общих закономерностях, свойственных действию эстрогенов и гестагенов на нормальный эндометрий человека.
Введение эстрогенов приводит, в зависимости от длительности и дозы, к развитию в эндометрии пролиферативных процессов вплоть до железистой гиперплазии. При длительном применении эстрогенов на фоне пролиферации могут возникать обильные ациклические маточные кровотечения.
Введение прогестерона в пролиферативной фазе цикла приводит к торможению пролиферации эпителия желез и подавляет овуляцию. Действие прогестерона на пролиферирующий эндометрий зависит от длительности введения гормона и проявляется в виде следующих морфологических изменений:
Для морфолога и клинициста-гинеколога важно знать, что подбор дозировки эстрогенов и гестагенов при лечении нарушений менструального цикла и патологических состояний эндометрия должен производиться под гистологическим контролем, путем забора повторных цугов эндометрия.
При использовании комбинированных гормональных контрацептивов в нормальном эндометрии женщины происходят закономерные морфологические изменения, зависящие в первую очередь от длительности применения препарата.
Прежде всего наблюдается укорочение пролиферативной фазы с развитием неполноценных желез, в которых в дальнейшем развивается абортивная секреция. Эти изменения связаны с тем, что при приеме данных препаратов, содержащиеся в них гестагены тормозят процессы пролиферации в железах, в результате чего последние не достигают своего полного развития, как это имеет место при нормальном цикле. Секреторные изменения, развивающиеся в таких железах, имеют абортивный невыраженный характер,
Другой типичной чертой изменений в эндометрии при приеме гормональных контрацептивов является резко выраженная очаговость, пестрота морфологической картины эндометрия, а именно: существование различных но степени зрелости участков желез и стромы, не соответствующих дню цикла. Эти закономерности характерны как для пролиферативной, так и для секреторной фаз цикла.
Таким образом, при приеме комбинированных гормональных контрацептивов в эндометрии женщин возникают выраженные отклонения от морфологической картины эндометрия соответствующих фаз нормального цикла. Однако, как правило, после отмены препаратов отмечается постепенное и полное восстановление морфологической структуры слизистой матки (исключение составляют лишь случаи, когда препараты принимались очень длительно— 10—15 лет).
ИЗМЕНЕНИЯ В ЭНДОМЕТРИИ, ВОЗНИКАЮЩИЕ ПРИ БЕРЕМЕННОСТИ И ЕЕ ПРЕРЫВАНИИ
При наступлении беременности, имплантация оплодотворенной яйцеклетки — бластоцисты происходит на 7-й день после овуляции, т. е. на 20-й — 22-й день менструального цикла. В это время перецидуальная реакция стромы эндометрия бывает выражена еще очень слабо. Наиболее быстрое образование децидуальной ткани происходит в зоне имплантации бластоцисты. Что касается изменений эндометрия за пределами имплантации, то децидуальная ткань становится отчетливо выраженной лишь с 16-го дня после овуляции и оплодотворения, т. е. при наступившей уже задержке менструации на 3—4 дня. Это наблюдается в эндометрии в равной мере как при беременности маточной, так и внематочной.
В децидуальной оболочке, выстилающей стенки матки па всем ее протяжении, за исключением зоны имплантации бластоцисты, различают компактный слой и спонгиозный слой.
В компактном слое децидуалыюй ткани на ранних сроках беременности встречаются два типа клеток: крупные, пузырьковидные с бледно-окрашивающимся ядром и более мелкие клетки овальной или полигональной формы с более темным ядром. Крупные децидуальные клетки являются конечной формой развития мелких клеток.
Спонгиозный слой отличается от компактного исключительно сильным развитием желез, которые тесно прилежат друг к другу и образуют ткань, общий вид которой может иметь некоторое сходство с аденомой.
При гистологической диагностике по соскобам и тканям, выделившимся спонтанно из полости матки, необходимо различать клетки трофобласта от децидуальных клеток, особенно, когда вопрос стоит о дифференциальной диагностике между маточной и внематочной беременностью.
Клетки трофобласта, составляющие пласт, полиморфны с преобладанием мелких полигональных. В пласте отсутствуют сосуды, волокнистые структуры, лейкоциты. Если среди клеток, составляющих пласт, встречаются единичные крупные синтициальные образования, то это сразу решает вопрос о принадлежности его к трофобласту.
Клетки децидуальной ткани также имеют различные размеры, но они более крупны, овальны. Цитоплазма гомогенна, бледна; ядра пузырьковидные. В пласте децидуалыюй ткани содержатся сосуды и лейкоциты.
При нарушении беременности сформированная ткань децидуальной о.болочки некротизируется и обычно полностью отторгается. Если же беременность нарушается в ранние сроки, когда децидуальная ткань еще окончательно неразвита, то она подвергается обратному развитию. Несомненным признаком того, что ткань эндометрия подвергалась обратному развитию после беременности, нарушенной в ранние сроки, является наличие в функциональном слое клубков спиральных артерий. Характерным, но не абсолютным признаком является также наличие феномена Ариаса—Стеллы (появление в железах клеток с очень крупным гиперхромным ядром).
При нарушении беременности одним из наиболее важных вопросов, на который приходится отвечать морфологу, является вопрос о маточной или внематочной беременности. Абсолютными признаками маточной беременности являются наличие в соскобе ворсин хориона, децидуальной ткани с инвазией хориального эпителия, отложение фибриноида в виде очагов и тяжей в децидуальной ткани и в стенках венозных сосудов.
В тех случаях, когда в соскобе обнаруживаются децидуальная ткань без элементов хориона, то это возможно и при маточной и при внематочной беременности. В связи с этим как морфологу, так и врачу-клиницисту следует помнить, что если выскабливание производилось не ранее чем через 50 дней после бывшей последней менструации, когда область расположения плодного яйца достаточно велика, то при маточной форме беременности ворсины хориона обнаруживаются почти всегда. Отсутствие их дает основание предполагать внематочную беременность.
При более раннем сроке беременности отсутствие в соскобе элементов хориона далеко не всегда указывает на внематочную беременность, так как при этом нельзя исключить незамеченный спонтанный выкидыш: во время кровотечения маленькое плодное яйцо могло целиком выделиться еще до выскабливания.
Всесоюзный научно-методический Центр патологоанатомической службы Института морфологии человека АМН СССР
Ленинградский Государственный ордена Ленина Институт усовершенствования врачей им. С.М. Кирова
I Ленинградский ордена Трудового Красного Знамени медицинский институт им. И. П. Павлова
Методические рекомендации составлены старшим научным сотрудником, кандидатом медицинских наук В.А. Прянишниковым и кандидатом медицинских наук О.И. Топчиевой.
Редактор — профессор О. К. Хмельницкий
похожие статьи
Редкий случай бессимптомного течения множественных камней почки / Лукацкая С.Д., Атакишиев А.Р. // Судебно-медицинская экспертиза. — М., 1963. — №3. — С. 56.
Морфологические изменения в почках при остром нефротическом синдроме у мужчин молодого возраста / Слободянюк О.Н., Жарский С.Л., Евсеев А.Н. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2012. — №12. — С. 147-148.
Диабетическая остеоартропатия (стопа Шарко) / Лазарева И.Н. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2016. — №15. — С. 125-129.